部分性发作癫痫相关SCN1A基因M145fsX148突变体的构建及亚细胞定位
2013-11-17罗金杰李文斌廖卫平
罗金杰, 李文斌, 汤 斌, 廖卫平
癫痫是一种大脑神经元异常放电引起的慢性脑功能障碍综合征。国际抗癫痫联盟委员会(ILAE)在1981年制定的癫痫发作分类方案将癫痫分为部分性发作、全面性发作及不能分类的癫痫发作[1]。前者约占所有癫痫病例的60%以上,因此其研究有很高的临床意义。在目前已发现的15种癫痫相关基因中,编码电压门控钠离子通道α1亚单位的SCN1A基因是与部分性发作癫痫发病相关的最重要的基因之一[2]。
SCN1A基因编码钠离子通道α1亚单位,其突变可异化通道蛋白的正常结构和功能,造成中枢神经系统电活动的失衡,诱发异常放电,最终引发部分性发作。国内外报道的与癫痫相关的SCN1A基因突变类型有300余种[3]。其不同的突变形式和突变位置可导致不同的癫痫发作类型[4].。
本课题组在一个部分性发作癫痫患者中发现了SCN1A基因M145fsX148截断突变,迄今国内未见报道[5]。我们以该突变为研究对象,构建出携带黄色荧光蛋白(YFP)的SCN1A基因截断突变质粒,转染人类神经母细胞瘤株SH-SY5Y,观察其蛋白的亚细胞定位,以探讨此截断突变与癫痫间的关系。
1 材料与方法
1.1 材料 pCMV-SCN1A质粒由美国Alfred L.George教授惠赠,其含有正常人SCN1A基因全长编码cDNA。人类神经母细胞瘤株SH-SY5Y细胞由本实验室保存。Taq DNA聚合酶购于TaKaRa公司;DNA Marker购自于广州东盛生物科技有限公司;DNA凝胶回收试剂盒和质粒小量抽提试剂盒购自东盛生物;快速限制性内切酶和T4连接酶购自Fermentas公司。转染试剂LipofectamineTM2000和染料FM4-64FX购自Invitrogen公司。
1.2 截断突变质粒的构建以及激光扫描共聚焦显微镜观察的方法
1.2.1 M145fsX148突变体的构建 利用PCR技术,从含有正常人SCN1A基因全长编码序列的质粒pCMV-SCN1A扩增获得M145fsX148突变片段。该片段丢失了SCN1A基因3号外显子433位点上的A碱基和434位点上的T碱基。以质粒pCMVSCN1A为模板,进行PCR特异性扩增。引物序列:上 游 引 物 5’-TTTGCGGCCGCATGGAGCAAACATCTAGATTTTAGATCTGTGCTTGTACCACCAGGA-3’,下游 5’-TTTGTCGACTTACTCATTGTCAAACACACAGTTTGTCAA-3’,分别在上下游引物中引入了SalⅠ和NotⅠ的酶切位点和保护性碱基。引物由上海生工生物工程技术服务有限公司合成。PCR反应体系和参数为:总体系 50μl,10X Taq buffer 5μl,2mmol/μl dNTP 4μl,上下游引物(10pmol/μl)各2μl,模板 SCN1A 1μl,Taq 酶 0.25μl,dd H2O 36μl。反应条件:94℃预变性 2min;然后 94℃ 30s,58℃30s,72℃ 1min;35 个循环,最后 72℃ 延伸 10min。PCR产物经凝胶回收后纯化得到大小为433bp的SCN1A截断突变序列。之后与质粒pCMV-SCN1A分别用SalⅠ和 NotⅠ进行双酶切,酶切产物凝胶回收后,用T4快速连接酶在4℃链接15min。将连接反应产物转化大肠杆菌感受态细胞TOP10,用含卡那霉素的平板筛选,扩增,提取质粒。质粒行双酶切鉴定和DNA测序,证实截断突变质粒pCMV-MuSCN1A构建成功。
1.2.2 携带黄色荧光蛋白的SCN1A截断突变质粒pCMV-YFP-MuSCN1A的构建 通过PCR扩增得到黄色荧光蛋白YFP基因序列,上游引物P1:5’-CGCTCTAGAGTGAGCAAGGGCGAGGAG-3’,含 Xbal I酶切位点;下游引物 P2:5’-GTCAGATCTCAGCTCGTCCTTCTTGA-3’,有Bgl II酶切位点。引物由上海生工生物工程技术服务有限公司合成。用同样的方法进行PCR扩增,纯化回收目的片段。再将得到的YFP片段和已获得的SCN1A基因截断突变质粒pCMV-MuSCN1A分别用Xbal I和Bgl II酶切,琼脂糖凝胶回收YFP片段和载体。然后将二者以T4 DNA连接酶进行连接,转化大肠杆菌感受态细胞TOP10,在含卡那霉素平板上筛选、扩增,以碱裂解法小量提取质粒。通过酶切鉴定和DNA测序验证,YFP片段位于截断突变质粒N端第9和10个碱基之间[6],最终获得携带黄色荧光蛋白的SCN1A基因截断突变质粒pCMV-YFP-MuSCN1A。
1.2.3 人类神经母细胞瘤株SH-SY5Y细胞的培养及转染 采用含10%胎牛血清的DMEM高糖培养基,在37℃,5%CO2条件下细胞培养。将处于对数生长期的SH-SY5Y细胞,以1×105个细胞/皿的密度接种于24孔板进行爬片。当细胞生长融合至60% ~75%左右时,使用LipofectamineTM2000试剂盒将突变质粒pCMV-YFP-MuSCN1A和荧光真核表达载体 pECFP-ER各0.4μg共转染至SH-SY5Y细胞中。48h后观察转染质粒的表达情况。
1.2.4 激光扫描共聚焦显微镜观察SCN1A基因M145fsX148截断突变编码的蛋白在SH-SY5Y细胞内的定位 使用染料FM4-64FX将转染后的细胞染色,采用激光扫描共聚焦显微镜观察荧光的表达。
2 结果
2.1 PCR扩增产物及质粒构建体的鉴定 以pCMV-SCN1A质粒为模板,用设计的引物进行PCR扩增,所得特异性条带与预期长度为433bp的目的基因相符(见图1)。该基因序列433-434位点上丢失AT两个碱基。将所得截断突变质粒pCMV-YFPMuSCN1A用SalⅠ和 NotⅠ进行双酶切鉴定,1% 琼脂糖凝胶电泳检测,可得到1111bp大小的片段(M145fsX148突变片段433bp+YFP片段678bp)和4214bp大小的载体片段,与理论预计相符 (见图2)。进一步将此重组质粒进行测序鉴定,DNA测序结果表明pCMV-YFP-MuSCN1A质粒丢失SCN1A基因3号外显子433-434位点上的AT碱基,提前形成终止密码子,其他序列未发生改变(见图3)。
2.2 SCN1A基因截断突变质粒在SH-SY5Y细胞中的亚细胞定位 转染后的细胞用markerFM4-64染色,其细胞膜在激光共聚焦显微镜下发红色荧光。用发蓝色荧光的pECFP-ER来标记内质网。激光扫描共聚焦显微镜显示,SH-SY5Y细胞中黄色荧光主要位于细胞质中,表示携带黄色荧光蛋白的SCN1A基因截断突变质粒主要在细胞质中表达(见图4)。

图1 PCR扩增M145fsX148突变片段

图2 pCMV-YFP-MuSCN1A酶切鉴定结果

图3 pCMV-YFP-MuSCN1A质粒测序图
3 讨论
电压门控型钠通道是一种能激活神经系统去极化的膜蛋白,钠通道由一个α亚单位和两个β亚单位组成,其中α亚单位作为主体形成通道孔,是钠离子通道的主要组成部分,主要在细胞膜上发挥功能[7]。α1亚单位含有2000个氨基酸,由4个高度同源的结构域组成,每个结构域含有6个跨膜区域,C端和N端直接朝向细胞内部,其编码的蛋白在细胞膜上表达[8]。编码钠离子通道 α1亚单位的SCN1A基因是癫痫的主要致病基因之一。80%SMEI由SCN1A基因突变引起,这些突变中一半是截断突变[9]。后者可引起转录和翻译的异常,使相应的离子通道蛋白表达减少或缺如。这些离子通道蛋白结构的改变导致离子通道的电流增加或减少均可引起癫痫发作[10]。Ogiwara等人的研究发现SCN1A基因R102X截断突变编码的异常蛋白不能在转基因小鼠神经细胞的细胞膜上表达,引起钠离子通道功能的改变,导致癫痫的发生[11]。以往的研究显示Na1.2的C末端451个氨基酸可能通过与神经细胞特异因子相互作用将 Na1.2定位到轴突[12]。这提示我们钠离子通道的C末端与钠通道的亚细胞定位相关。当C端序列丢失后则可能干扰了相关蛋白的迁移,进而影响钠通道的功能。
本实验室在部分性发作癫痫患者中首先发现了SCN1A基因框移突变 M145fsX148,位于 Domain I的SI[5]。它是在3号外显子433和434的位置丢失两个碱基,导致碱基重排,形成终止密码子,提前终止蛋白翻译,从而引起被编码的蛋白C末端大部分区域丢失。我们利用基因重组技术构建了SCN1A基因M145fsX148突变体的真核表达载体。将黄色荧光蛋白(YFP)插入到该截断蛋白N端的第3个和第4个氨基酸之间,使YFP的编码序列对离子通道蛋白的结构和亚细胞定位影响减到最小[6]。将其转染入SH-SY5Y细胞,激光扫描共聚焦显微镜显示异常的SCN1A蛋白主要在细胞质中表达,而未在膜上表达。证实该突变干扰了钠通道蛋白的分选、迁移和定位过程,进而改变钠通道的功能引起疾病。
由于SCN1A基因突变形式复杂多样,直接在人体内研究或在众多的突变动物模型进行研究亦不现实,且不经济。因此体外构建转染细胞体系进行蛋白功能研究非常重要。目前国内缺乏对SCN1A基因截断突变功能研究的相关报道。我们构建了pCMV-YFP-MuSCN1A真核表达载体,为进一步研究SCN1A基因截断突变导致I型电压门控钠离子通道功能的变化奠定了基础,也为作用于钠离子通道的抗癫痫药物的研发提供了广阔前景。
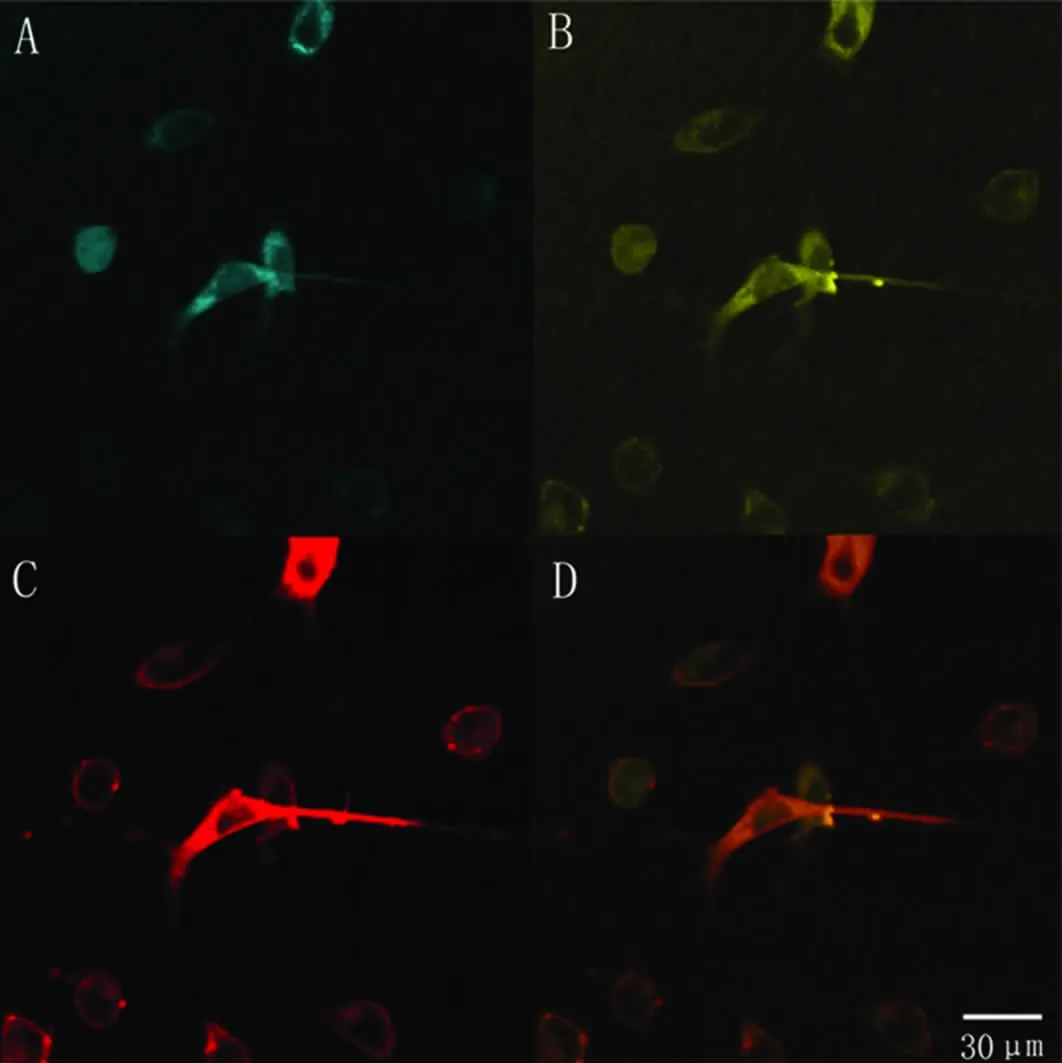
图4 重组质粒pCMV-YFP-MuSCN1A与蓝色荧光定位载体pECFP-ER共转染SH-SY5Y细胞
[1]Proposal for revised clinical and electroencephalographic classification of epileptic seizures.From the Commission on Classification and Term inology of the In ternational League Against Epilepsy[J].Epilepsia,1981,22:489-501.
[2]Mulley JC,SchefferIE,Petrou S,et al.SCN1A mutations and epilepsy[J].Hum Mutat,2005,25(6):535-542.
[3]Lossin C.A catalog of SCN1A variants[J].Brain Dev,2009,31(2):114-130.
[4]Gambardella A,Marini C.Clinical spectrum of SCN1A mutations[J].Epilepsia,2009,50(Suppl.5):20-23.
[5]Yu MJ,Shi YW,Gao MM,et al.Milder phenotype with SCN1A truncation mutation other than SMEI[J].Seizure,2010,19(20):443-445.
[6]Kang JQ,Shen WZ,Robert L,et al.The GABRG2 Mutation,Q351X,Associated with Generalized Epilepsia with Febrile Seizures Plus,Has Both Loss of Function and Dominant-Negative Suppression[J].J Neurosci,2009,29(9):2845-2856.
[7]Oliva M,Samuel Y,Berkovic F,et al.Sodium channels and the neurobiology of epilepsy[J].Epilepsia,2012,53(11):1849-1859.
[8]Meisler MH,Kearney JA.Sodium channel mutations in epilepsy and other neurological disorders[J].Clin Invest,2005,115(8):2010-2017.
[9]孙慧慧,张月华,刘晓燕,等.婴儿严重肌阵挛癫痫钠离子通道SCNIA基因突变分析[J].中华医学遗传杂志,2009,26(2):345-348.
[10]Spampanato J,Escayg A,Meisler MH,et al.Functional effects of two voltage-gated sodium channel mutations that cause generalizedepilepsy with febrile seizures plus type[J].J Neurosci,2001,21:7481-7490.
[11]Ogiwara I,Miyamoto H,Morita N,et al.Nav1.1 localizes to axons of parvalbumin-positive inhibitory interneurons:a circuit basis for epileptic seizures in mice carrying an Scn1a gene mutation[J].JNeurosci,2007,27(22):5903-5914.
[12]Lee A,Goldin AL.Role the Terminal Domains in Sodium Localization[J].Channels,2009,3(3):171-180
