铁皮石斛甘露糖结合凝聚素的分子建模与对接研究
2013-11-14朱梦丽朱乾坤邹嘉欣冯沛春范高韬王万军
朱梦丽,朱乾坤,邹嘉欣,冯沛春,范高韬,王万军
(西南交通大学生命科学与工程学院,成都610031)
凝集素(lectin)[1]是一种非免疫源性蛋白,能专一识别特定的糖类并与之可逆共价结合,形成可使细胞凝集的糖蛋白,广泛分布于植物,动物和微生物中。植物凝集素存在于很多植物的种子和营养组织中,根据氨基酸序列的同源性及其进化关系,可以分为7个家族:豆科凝集素、单子叶植物甘露糖结合凝集素(Monocot mannose-binding lectin,MBL)、含橡胶素结构域的几丁质结合凝集素、II型核糖体失活蛋白、葫芦科韧皮部凝集素、木菠萝素相关凝集素和苋科凝集素[2]。单子叶植物MBL存在于石蒜科、百合科、兰科等植物中,可特异结合甘露糖。甘露糖在植物中的分布很少,但却广泛分布于昆虫、病毒、细菌、真菌的表面,当植物组织受昆虫或高等动物袭击时,MBL就从受袭击的细胞中释放至捕食者的消化道,通过消化道细胞上的糖类结合引发毒性效应,凝集素随食物进入昆虫肠道后,就可结合到这些糖蛋白的受体上,阻碍昆虫的生长发育,甚至杀死昆虫;MBL还可与微生物表面的甘露糖等糖类结合,干扰其细胞壁的合成,影响其细胞的正常代谢[2-3]。因此,MBL在植物抵御害虫,病原微生物和植食性动物中起重要作用。已有研究将外源MBL(如雪花莲MBL)基因导入水稻、烟草、棉花、甘蔗、油菜等[4]作物中,培育出抗虫新品种。有研究表明,一些植物MBL(如雪花莲MBL,洋水仙MBL)对人类免疫缺陷病毒和猫免疫缺陷病毒显示抑制活性[5]。
单子叶植物铁皮石斛(Dendrobium officinale)为兰科(Orchidaceae)石斛属(Dendrobium)植物,《神农本草经》将其列为上品,具有伤中、除痹、下气、久服厚肠胃等功效。现代医学研究表明,铁皮石斛具有抗衰老、抗肿瘤、降低血糖和提高免疫等作用[6]。野生铁皮石斛生长环境苛刻,加之长期无节制采摘,已是濒危药材。基于植物MBL的重要作用,陈中海等[7]克隆了铁皮石斛甘露糖结合凝集素(Dendrobium officinale mannose-binding lectin,DOL)基因的cDNA序列并推导出其编码的氨基酸(amino acid,AA)序列。本文在此基础上对DOL进行同源建模,分子对接和动力学模拟,以进一步研究DOL的结构特征及其与甘露糖的作用机制,为研究铁皮石斛的药效及新品种的选育提供信息。
1 材料与方法
1.1 序列分析与同源建模
DOL前体氨基酸序列[7]来源于NCBI GenBank,序列登录号为AAV66418。DOL与相关MBL的氨基酸序列比对和同源性分析采用DNAMAN[8]完成。DOL同源建模采用的模板为洋水仙MBL[9](Narcissus pseudonarcissus mannose-binding lectin,NPL),与DOL的同源一致性为57%,其晶体结构来源于PDB,PDB登录号为3DZW,通过X射线晶体学解析,分辨率达到 1.7 A。DOL的同源建模采用SWISS-MODEL[10](http://swissmodel.expasy.org/)的项目模式(Project mode)完成。
1.2 动力学模拟
DOL模型分子动力学(Molecular dynamics,MD)模拟采用 Discovery StudioTM(DS)2.0[11](Accelrys,San Diego,USA)中基于CHARMm力场的Simulation模块完成:将整个体系加入5 Å TIP3P水分子,先采用最陡下降法(Steepest descent,SD)进行1 000步能量最小化,收敛标准为0.1 kJ/mol,再用共轭梯度法(Conjugate gradient,CG)进行2 000步能量优化,收敛标准为0.05 J/mol。系统再从50 K进行100 ps加热到300 K,在300 K进行200 ps平衡。最后在1 atm 300 K条件下以NPT系统进行2 000 ps采样,选择保存1 000个构象。蛋白质结构质量检测采用PROCHECK[12](http://nihserver.mbi.ucla.edu/SAVS/)和DS Verify Protein(Profiles-3D)工具完成。
1.3 分子对接
由于DOL与NPL具有相同的配体甘露糖,而NPL的复合结构中已含有甘露糖,所以DOL的分子对接配体就采用NPL的配体甘露糖。DOL与配体甘露糖的分子对接采用DS CDOCKER对接模块完成,对接范围采用球形,半径10 Å,其他参数默认。将得到的配体构象进行成簇分析(成簇参数为0.5 Å),最后依据成簇情况和最低结合能来选取合理的对接结果。对接形成的复合物模型进行动力学分析,模拟参数同DOL模型,对接结果用Ligplot程序分析[13]。
2 结果与分析
2.1 DOL 序列分析
DOL前体(Precursor)氨基酸序列全长165 AA,通过NCBI BLAST以DOL为提交序列搜索蛋白质序列数据库得到同源性最高的3条MBL前体序列和3条结构已解析的MBL成熟蛋白序列(mat-peptide),3 条前体序列分别为对叶兰[14]MBL(Listera ovata mannose-binding lectin,LOL)、生 姜[15]MBL(Zingiber officinale mannose-binding lectin,ZOL)、红花石蒜[16]MBL(Lycoris radiata mannose-binding lectin,LRL),GenBank 登 录号 依次 为 AAC37422、AAV70492、BAD98797,与DOL前体序列的同源一致性分别为53%、50%、49%;3条成熟蛋白序列分别为洋水仙[9]MBL(Narcissus pseudonarcissus mannose-binding lectin,NPL)、雪花莲[17]MBL(Galanthus nivalis mannose-binding lectin,GNL)、天麻[18]MBL(Gastrodia elata mannose-binding lectin,GEL)、PDB登录号依次为3DZW、1MSA、1XD5,与DOL的同源一致性分别为57%、54%、47%。
用DNAMAN将DOL与得到的六条序列进行多序列比对(见图1)。分析结果显示,DOL同其他三种植物的MBL前体序列一样均存在信号肽(1-24 AA),成熟蛋白区域(Maturation peptide region)(25-134 AA)和C端切除肽(135-165 AA)。成熟蛋白区包含3个识别甘露糖所必需的甘露糖结合部位(Mannose-binding domain,MBD)(MBD1:50-58 AA,MBD2:81-89 AA,MBD3:116-124 AA),构成了一个特征序列QXDXNXVXY。3个保守基序中的甘露糖结合位点为依次为“50、52、54、56、58”,“81、83、85、87、89”,“116、118、120、122、124”。

图1 DOL与其他6种植物MBL的多序列比对 LOL,ZOL,LRL为前体序列;NPL,GNL,GEL为结构已解析的成熟蛋白Fig.1 The multiple sequence alignment between DOL and six MBLs from different plants LOL,ZOL,LRL are precursor sequences;NPL,GNL,GEL are maturation proteins and their crystal structures were resolved
2.2 DOL 同源建模
根据2.1的分析结果,同源建模采用的DOL序列是DOL成熟蛋白序列(25-134 AA),选定的模板为NPL成熟蛋白的晶体结构。以NPL为模板用SWISSMODEL构建DOL的三维结构(见图2),将DOL与模板NPL结构进行叠合比较,二者的结构具有很高的相似性,其叠合的均方根差(RMSD)为0.77 Å,二者结构均由11个β-折叠区与12个无规则卷曲区构成,除N端一个β-折叠结构只有部分重叠和92-93 AA处产生3个空位以外,其他各区的二级结构基本重叠。DOL的三维结构呈中空的三棱柱结构,棱柱3个侧面由β-折叠构成,分别为 sheet 3-6,sheet 2/7-9,sheet 1/10-11。3个MBD分别位于3个侧面的coil 5和 sheet5、coil 8 和 sheet 8、coil 11 和 sheet 11。
2.3 DOL模型动力学模拟
为研究DOL模型的稳定性,上述得到的同源模型需要进一步进行动力学模拟。动力学模拟轨迹的均方根偏差(Root mean square,RMSD)是衡量一个体系是否稳定的重要依据,为了检测动力学轨迹的稳定性,对复合物中DOL骨架原子的均方根偏差进行了分析,如图3(a)所示,DOL骨架原子的 RMSD在开始阶段呈上升趋势;在大约800 ps之后,轨迹平稳已达到平衡且 RMSD值一直稳定在2.5 Å左右,轨迹略有波动。
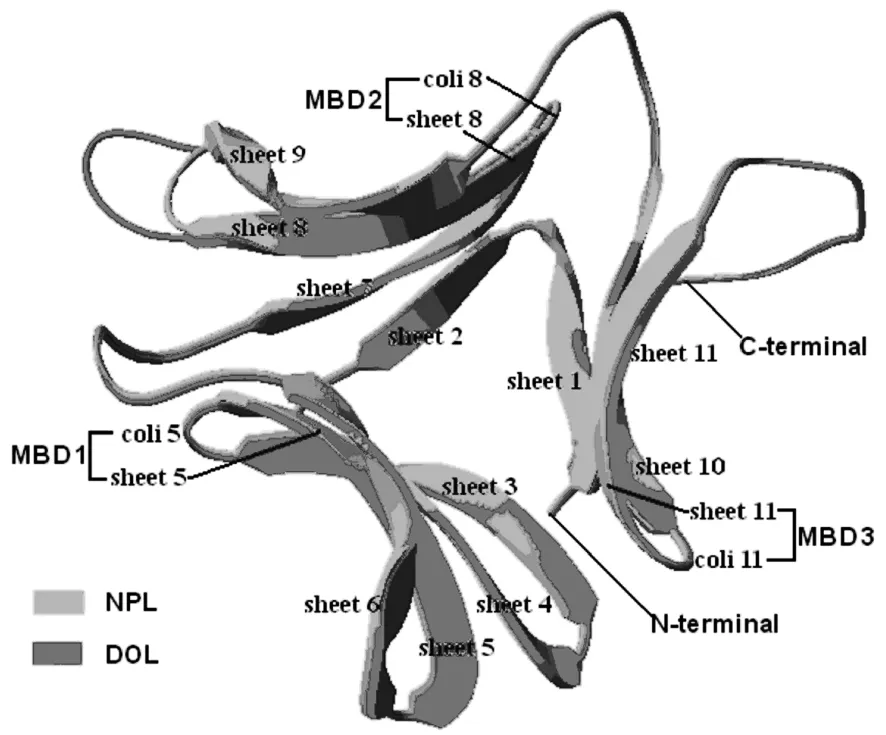
图2 DOL结构和模板NPL结构的叠合Fig.2 The superimposition between the monomer structure of DOL and that of template NPL
此外,在大约1 000 ns的MD模拟之后,体系势能也趋向最小值而达到稳定。均方根波动(Root mean square fluctuation,RMSF)是反应蛋白质的柔性和稳定性的一个重要参数,如图3(b)所示,DOL的N端25-125位置的氨基酸RMSF值都在2.0 Å以下,氨基酸比较稳定,只有49、69、82、94略显波动。DOL的柔性区域主要集中在其C端(125-136)(见图3(b)),该区主要是无规则卷曲,从三棱柱上延伸出来(见图2)。
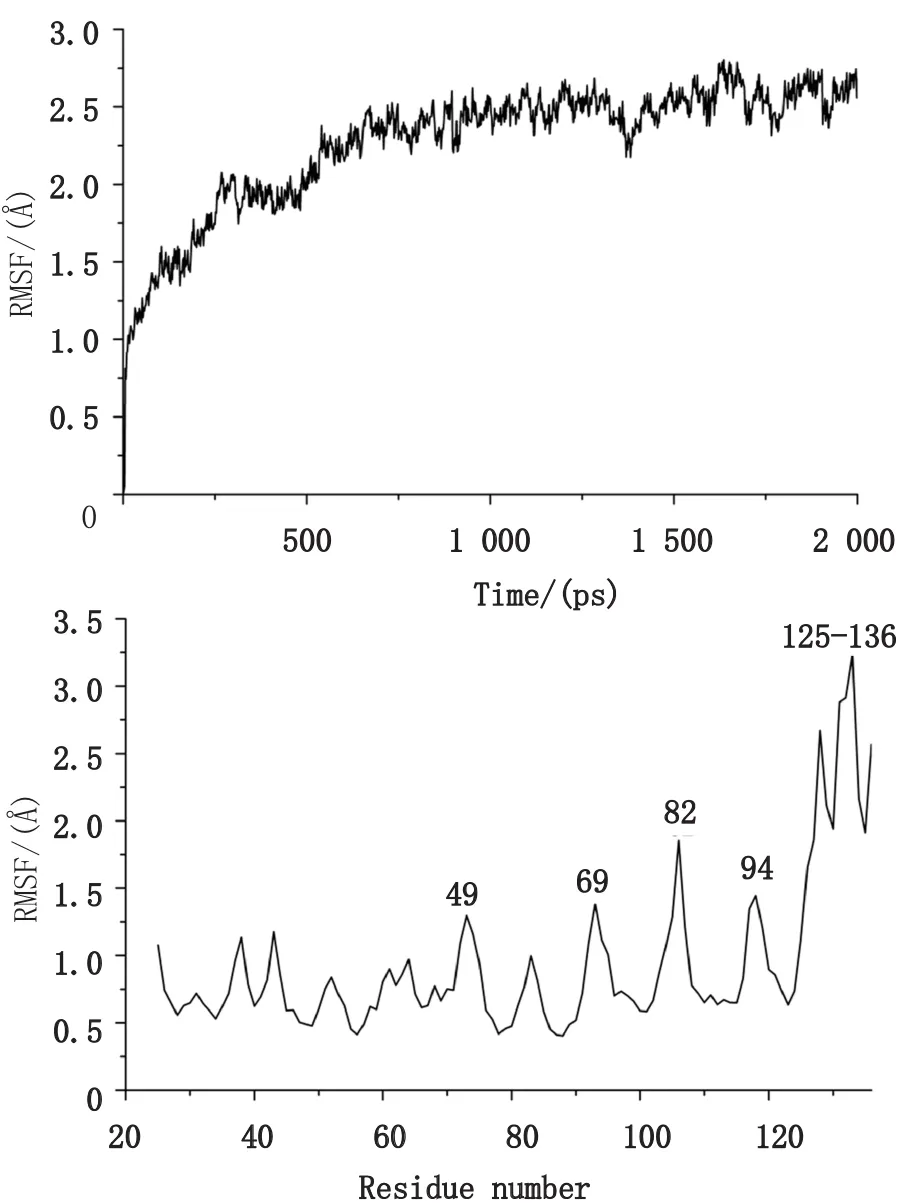
图3 (a)DOL模型C骨架的RMSD曲线;(b)DOL氨基酸残基的RMSF曲线Fig.3 (a)The RMSD curve of DOL model backbone;(b)the RMSF curve of DOL residue
2.4 DOL 结构检验
DOL结构用PROCHECK进行质量评估,如图4(a)的Ramachandran图所示,在参与建模的112个氨基酸残基中,在允许范围之内的占96.9%。不合理区的氨基酸残基Arg95、Leu60、Asp43,这3个残基均在功能位点之外,不影响后续研究。优化后的DOL进一步用Profiles-3D进行检测,如图4(b)的Verify-3D图所示,98%以上的氨基酸残基的分值均在0以上,只有C端有两个氨基酸(Arg135,Phe136)分值在0以下。PROCHECK和Verify-3D结果表明,得到的DOL结构合理,可进一步进行后续研究。
2.5 DOL与配体的分子对接
基于上述分析的活性位点,利用DS Binding Site tools将甘露糖的对接范围(对接半径10 Å)定位于3个甘露糖结合部位 (MBD1:50-58AA,MBD2:81-89AA,MBD3:116-124AA)。用 DS从 NPL晶体结构中分离出所需配体甘露糖的三维结构。用DS CDOCKER将甘露糖对接于相应的位置,得到了DOL和甘露糖的复合结构。如图5所示,3个甘露糖Man1,Man2,Man3 分别作用于 MBD1,MBD2,MBD3三个结合部位,其相互作用能分别为 -64.71 kJ.mol-1、-69.19 kJ.mol-1、-56.5 kJ.mol-1。从相互作用能来看,MBD1,MBD2与甘露糖的结合要强于MBD3(见表1)。
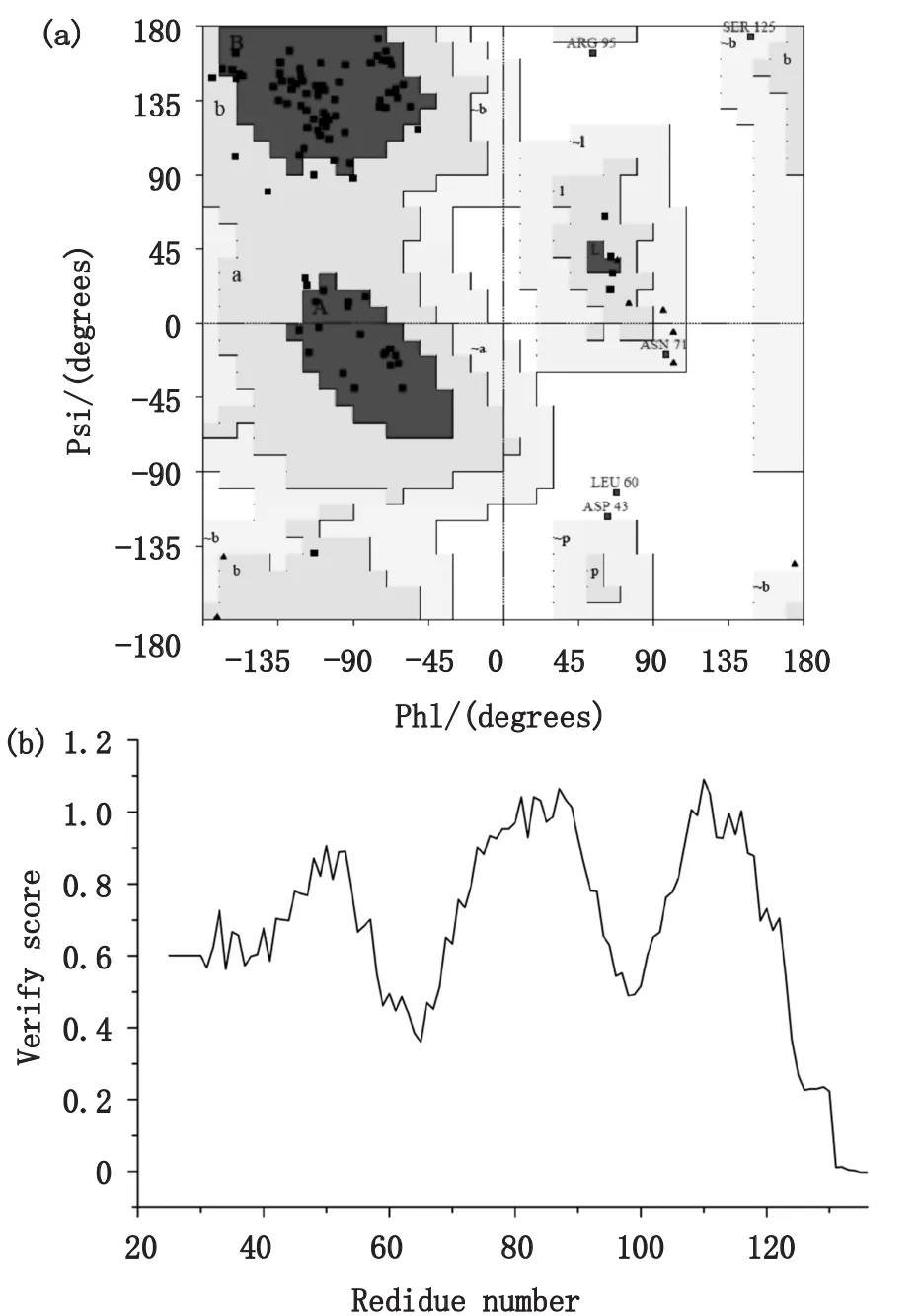
图4 (a)DOL模型的Ramachandran图;(b)DOL模型的Verify-3D图Fig.4 (a)The Ramachandran plot of DOL model;(b)the Verify-3D curve of DOL modelIn
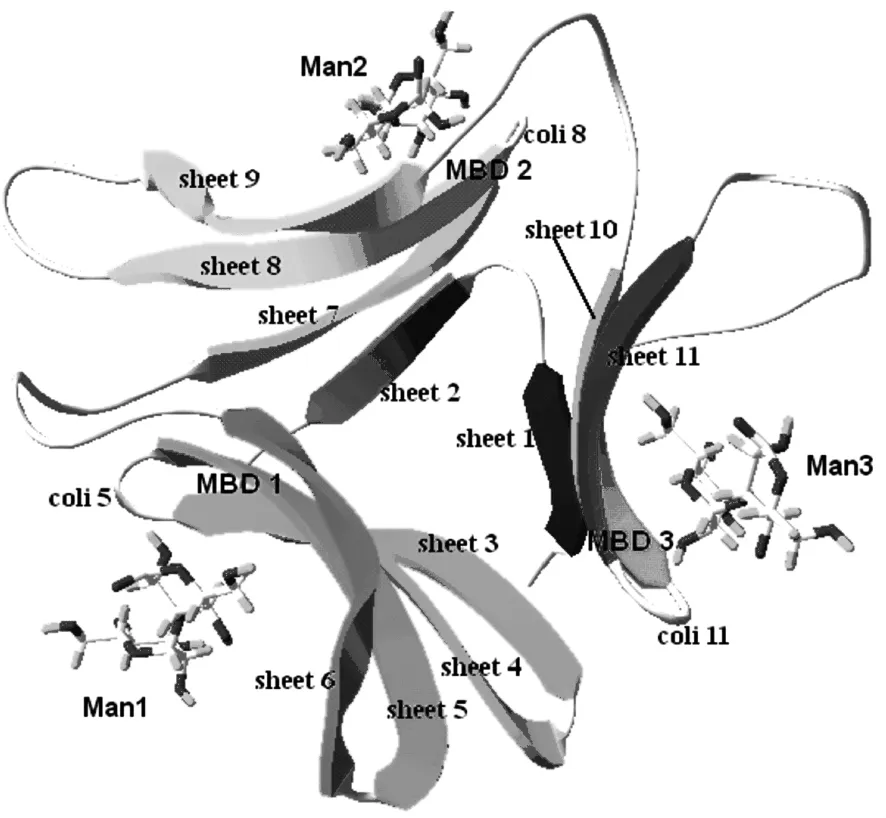
图5 DOL与甘露糖的复合结构Fig.5 The complex structure of DOL and mannobioses
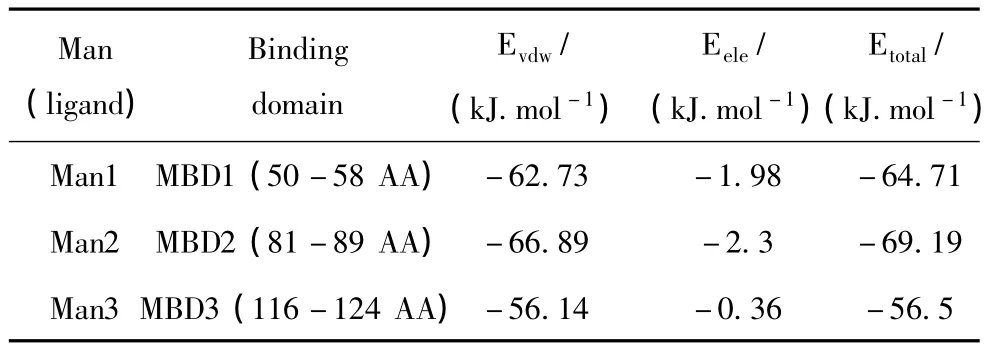
表1 DOL和甘露糖间的范德华力(Evdw),静电作用(Eele)和总的相互作用能(Etotal)Table 1 The van der Waal energy(Evdw),electrostatic energy(Eele)and Total energy(Etotal)between DOL and Mannobioses
为了研究对接复合物的稳定性,得到的对接模型进行了2 000 ps的动力学模拟。整个复合物的RMSD曲线如图6所示,复合物在750 ps左右开始趋向于平衡,RMSD值维持在2.2 Å左右,略有波动。与前面的DOL空蛋白的动力学模拟过程相比可知,由于复合物中存在三个配体,使得其RMSD值降低,表明甘露糖与DOL结合可以稳定复合物结构。另外,3个甘露糖 Man1、Man2、Man3的 RMSD最大值分别为 1.12 Å、1.06 Å、1.34 Å,平均 值分别 为0.82 Å、0.80 Å、0.97 Å,说明三者在动力学过程中与DOL结合的很牢靠,没有脱离DOL结合部位[19]。其中Man3的RMSD值略偏高,说明DOL上的MBD1和MBD2较MBD3更利于甘露糖结合。
在对接的复合物中,3个MBD结构相似,都有一个配体与之结合。甘露糖通过范德华力和氢键作用特异性地结合于3个MBD(见图7)。从图7(a)、(b)、(c)可以看出,在三组甘露糖结合残基中与甘露糖直接发生氢键作用的都是Gln、Asp、Asn和Tyr,而Val都没与之发生氢键作用。可见在与甘露糖结合的过程中发挥关键作用的为Gln、Asp、Asn和Tyr。甘露糖上参与形成氢键作用的基团为氧原子。MBD1、MBD2和MBD3与甘露糖的结合都是甘露糖的O分别与Asp、Gln、Tyr、Asn形成氢键。甘露糖上MBD1和MBD2与甘露糖的结合方位相似(见图7(a)、(b)),但是由于结合部位中其它氨基酸的影响,所以氢键距离和总的结合能有所区别。
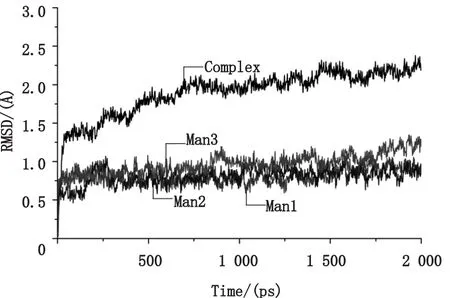
图6 DOL和甘露糖对接复合物的RMSD曲线Fig.6 The RMSD curve of docking complex of DOL and Mannobioses
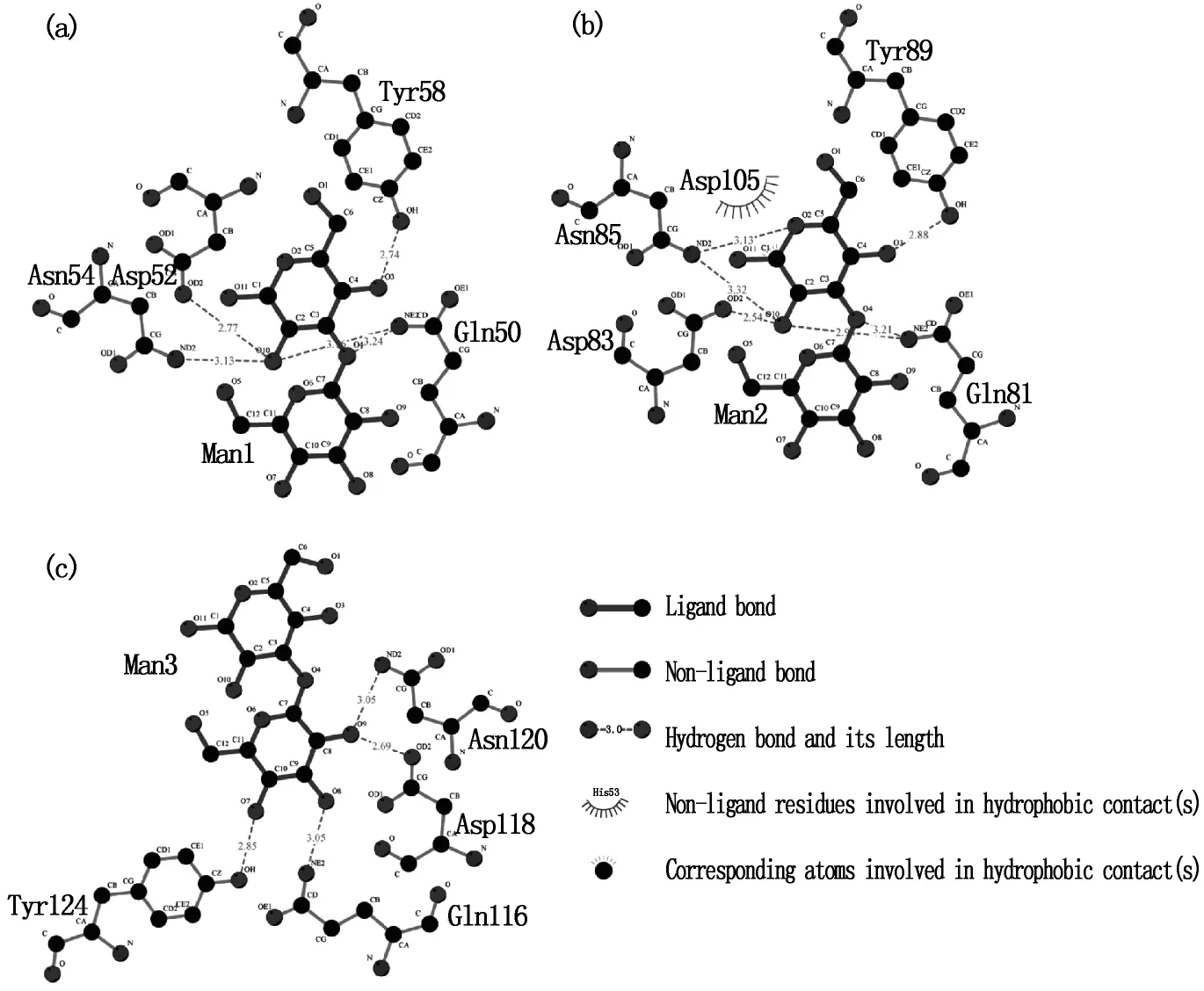
图7 DOL的MBD氨基酸残基与甘露糖的相互作用Fig.7 The interactions between the MBD residues of DOL and mannobiose
在MBD1(见图7(a))中,Gln50 NE(2)与甘露糖O4和 O(10)、Asp52 OD(2)与甘露糖 O(10)、Asn54 ND(2)与甘露糖O(10)、Tyr58 OH与甘露糖O(3)形成氢键,氢键供体原子间距分别为3.24 Å、3.16 Å、2.77 Å、3.13 Å、2.74 Å。 在 MBD2(图7(b))中,Gln81 NE2与甘露糖O(4)和O(10)、Asp83 OD(2)与甘露糖O(10)、Asn85 ND(2)与甘露糖O(2)和O(10)、Tyr89 OH与甘露糖O(3)形成氢键,氢键供体原子间距分别为 3.21 Å、2.94 Å、2.54 Å、3.32 Å、3.13 Å、3.32 Å。MBD2 中除了氢键,还有Asp105与甘露糖 C1产生静电作用。在 MBD3(见图7(b))中,Gln116 NE(2)与甘露糖 O(8)、Asp118 OD(2)与甘露糖O(9)、Asn85 ND(2)与甘露糖O(9)、Tyr124 OH与甘露糖O(3)形成氢键,氢键供体 原 子 间 距 分 别 为 3.05 Å、2.69 Å、3.05 Å、2.85 Å。综上,MBD2 由于 Gln81、Asp83、Asn120、Tyr89的氢键和Asp105的静电作用,其与甘露糖的结合要强于MDB1和MBD3,而MBD3与甘露糖的结合较MBD1和MBD2弱。
3 讨论
本文分析了DOL前体序列的信号肽(1-24 AA)和C端切除肽(135-165 AA),获得了DOL成熟肽(25-134 AA)。通过序列分析得到DOL上的甘露糖结合部位 QXDXNXVXY(50-58 AA,81-89 AA,116-124 AA)。以NPL为同源模板建立了DOL的三维结构模型,DOL呈中空的三棱柱结构,三棱柱的3个侧面主要由β折叠构成,3个侧面各有一个甘露糖结合基序。根据分析的活性位点确定DOL的配体对接部位,将甘露糖对接进DOL结构中建立了DOL与甘露糖的复合结构。通过分子对接结果和动力学分析表明,结合区50-58 AA和81-89 AA对甘露糖的结合能力要强于116-124 AA,在与甘露糖结合的过程中发挥关键作用的氨基酸残基为Gln、Asp、Asn和Tyr。另外,由于81-89 AA与甘露糖的结合作用最强,因此可以试图通过点突变的方式,将50-58 AA和116-124 AA突变成81-89 AA的模式,构建突变基因培育转基因植物,同时也能进一步研究突变蛋白的药理作用。
单子叶甘露糖结合凝集素(MBL)在农业抗病虫害上的成功应用引起了人们的广泛关注,本文DOL的同源建模与分子模拟研究为在分子水平上解释DOL的功能提供依据,对研究铁皮石斛抗病毒,抗虫害有关的基因,通过基因工程等手段获得铁皮石斛新品种具有重要意义。另外,已有研究发现MBL对人类或动物逆转录病毒具有抑制作用,如雪花莲凝集素和洋水仙凝集素对人类免疫缺陷病毒和猫免疫缺陷病毒显示抑制活性[5],本研究以单子叶植物铁皮石斛的MBL为研究对象,分析了DOL与甘露糖的作用位点和作用机制,可为凝集素抗病机理及凝集素相关药物研究奠定基础。
References)
[1] 鲍锦库.植物凝集素的功能[J].生命科学,2011,23(6):533-540.
[2] Ghequíre MGK,Li W,Proost P,et al.Plant lectin-like antibacterial proteins from phytopathogens Pseudomonas syringae and Xanthomonas citri[J].Environmental microbiology reports,2012,4(4):373-380.
[3] De Hoff PL,Brill LM,Hirsch AM.Plant lectins:the ties that bind in root symbiosis and plant defense[J].Molecular Genetics and Genomics,2009,282(1):1-15.
[4] 周晓宇,陈杰,杨敬,黄海涛,宋翔.植物凝集素及其在抗虫基因工程中的应用[J].山地农业生物学报,2010,29(003):255-260.
[5] López Susana,Armand-Ugon Mercedes,Bastida Jaume,Viladomat Francesc,Esté José A,Stewart Derek,Codina Carles.Anti-human immunodeficiency virus type 1(HIV-1)activity of lectins from Narcissus species[J].Planta Medica,2003,69(2):109-112.
[6] LI Juan,LI Shunxiang,,HUANG Dan,ZHAO Xingbing,CAI Guangxian.Advances in the of Resources,Constituents and Pharmacological Effects of Dendrobium officinale[J].Science Technology Review,2011,29(18):75-79.
[7]CHEN Zhonghai,SUN Xiaofen,TANG Kexuan.Molecular Cloning and characterization ofa mannose-binding lectin gene from Dendrobium officinale[J].Journal of Plant Biochemistry and Biotechnolegy,2005,14(1):4-10.
[8]FU Zhaodi,WANG Huinan,LIU Juan,LIU Juanxu,WANG Jing,ZHANG ZHAOqi and YU Yixun.Cloning and characterization of a DCEIN2 gene responsive to ethylene and sucrose in cut flower carnation [J].Plant Cell,Tissue and Organ Culture,2011,105(3):447-455.
[9] Sauerborn MK,Wright LM,Reynolds CD,et al.Insights into carbohydrate recognition by Narcissus pseudonarcissus lectin:the crystal structure at 2 Å resolution in complex with alpha1-3 mannobiose[J].Journal of Molecular Biology,1999,290(1):185-199.
[10] Guex N,Peitsch MC,Schwede T.Automated comparative protein structure modeling with SWISS-MODEL and Swiss-PdbViewer:A historical perspective [J].Electrophoresis,2009,30(S1):S162-S173.
[11] Gao YD,Huang JF.An extension strategy of Discovery Studio 2.0 for non-bonded interaction energy automatic calculation at the residue level[J].Zoological Research,2011,32(3):262-266.
[12] Satpathy R,Behera R,Guru RK.Homology modelling and molecular dynamics study of plant defensin DM-AMP1 [J].Journal of Biochemical Technology,2011,3(4):309-311.
[13]安康,柴晓杰,薛飞,王媛,张婷.VEGFR-2与抑制剂 Sunitinib的分子对接及分子动力学研究[J].化学学报,2012,70(010):1232-1236.
[14] Van Damme JM,Smeets K,Torrekens S,et al.Characterization and molecularcloning ofmannose-binding lectins from the Orchidaceae species Listera ovata,Epipactis helleborineand Cymbidium hybrid[J].European Journal of Biochemistry,1994,221(2):769-777.
[15] Chen ZH,Kai GY,Liu XJ,et al.cDNA cloning and characterization of a mannose-binding lectin from Zingiber officinale Roscoe(ginger)rhizomes[J].Journal of Biosciences,2005,30(2):8-16.
[16] Hayashi Akiko,Saito Toshiyuki,Mukai Yasuhiko,Kurita Siro,Hori Tada-aki.Genetic variations in Lycoris radiata var.radiata in Japan[J].Genes Genetic Systems,2005,80(3):199-212.
[17] Wright CS,Kaku H,and Goldstein IJ.Crystallization and preliminary X-ray diffraction results of snowdrop(Galanthus nivalis)lectin [J].Journal of Biological Chemistry,1990,265(3):1676-1677.
[18] LIU Wei,YANG Na,DING Jingjin,HUANG Ren-huai,HU Zhong,WANG Da-Cheng.Structural mechanism governing the quaternary organization of monocot mannose-binding lectin revealed by the novel monomeric structure of an orchid lectin[J].Journal of Biological Chemistry,2005,280(15):14865-14876.
[19] Zhu QK,Zhou JY,Zhang G,et al.Homology Modeling and Molecular Docking Studies of(S)-Scoulerine 9-O-Methyltransferase from Coptis chinensis[J].Chinese Journal of Chemistry,2012,30(10):2533-2538.
