不同灵芝、多孔菌样品对LN-CaP和A549细胞生长的影响
2013-11-13XinheShan翟云燕吴金洋柯传奎
Xinhe Shan 翟云燕 吴金洋 柯传奎*
(1.chapman parkway ,stonybrook, NY, US. 11790;2.杭州柯氏生物科技有限公司,浙江 杭州 310053)
中国两千年前的《神农本草经》将灵芝按菌盖和菌柄的颜色(赤、黑、青、白、黄、紫)分类,统称“六芝”,并记载各自的功效。中国明朝太医院·刘文泰等纂修的《本草品汇精要》[1]记载灵芝有赤芝、黒芝、青芝、白芝、黄芝、紫芝。它们的产地、中药的“性”、功效与主治的疾病见表1。

表1 六芝的产地、中药的性、功效与主治
记载“六芝”的共同功效为“久服轻身,不老延年,神仙”[1]。根据中医药理论对各种灵芝的“功能主治”分析,“六芝”涉及到中医的归经:心、肝、脾、肺、肾,而黒芝和紫芝都是以归肾经为主。提示:不同产地、不同品种的“灵芝”可能有不同的生理效应。
当今对“六芝”的具体生物物种说法不一,菌类分类专家赵继鼎[2]对“六芝”经初步考证认为:赤芝是灵芝属的灵芝(Ganoderma lucidum);紫芝是灵芝属的紫芝(Ganoderma sinense);黄芝可能是硫磺菌(Laetiporus Sulphureus);白芝可能是苦白蹄(Fomitopsis officinalis);黑芝可能是灵芝科假芝属的种类,尤以假芝(Amauroderma Sugosum)最相似,也可能是多孔菌属的黑柄多孔菌(Polyporus Melanopus);青芝可能是云芝(Coriolus versicolor)。
中华人民共和国药典(2010年一部)在灵芝项下只指赤芝(Ganoderma lucidum)或紫芝(G. sinense)的干燥子实体[3]。但是在中国文献和市场上的“灵芝”可能涉及到灵芝科(Ganodermataceae)和多孔菌科(Polyporaceae)的许多个属和种,往往没有注明拉丁种名。虽然,有实验报告[4]表明,赤芝主要通过灵芝三萜成分阻断I、II型5α-还原酶,而灵芝醇B可以和双氢睾酮受体结合。并且指出灵芝的乙醇及甲醇提取物均能显著地抑制睾酮诱导的 BPH大鼠的腹侧前列腺的增长。但文中忽视了生物学分类中数以百计的灵芝科和多孔菌科物种及产地对其乙醇及甲醇提取物含量、成分组成,尤其是忽视了给药量对药效的影响。所以,中医临床常用灵芝配伍的处方,由于药材来源问题,临床疗效不稳定。
本实验通过细胞培养人激素依赖性前列腺癌细胞株(LN-CaP)和肺腺癌细胞株(A549),在细胞培养液中加入不同浓度的各种灵芝的水提取液或不同浓度的丙酸睾酮,实时记录细胞生长曲线,重点分析各种样品对以上细胞株的生理效应,探讨样品给药量与其效应的关系。
1 材 料
(1)不同灵芝样品的形态记录见表2。
(2)细胞株、试剂和实验仪器。前列腺癌细胞株为人激素依赖性前列腺癌细胞株(LN-CaP),由北大绍兴生物中心赠送;肺腺癌细胞株A549购于美国ATCC。其他试剂和实验仪器有:RPMI1640培养基(美国Hyclone),0.25%TRYPSIN(美国Hyclone),胎牛血清(美国Hyclone),丙酸睾酮(上海通用药业股份有限公司,批号121201),无水乙醇(分析纯,国药集团化学试剂有限公司),培养皿(上海圣纳堡生物科技开发有限公司),培养箱(美国Thermo Fisher Scientific),倒置显微镜(日本 OLYMPUS),xCELLigence和 96 孔微电子细胞芯片由艾森(杭州)生物有限公司生产[7],离心机1(上海HealForce),离心机2(德国Eppendorf),水浴锅(上海博迅实业有限公司),超声机(昆山市超声仪器有限公司),金属浴(杭州奥盛仪器有限公司)。
2 方 法
2.1 灵芝样品的水提
将样品切碎为直径0.5 cm 大小,置60 ℃烘箱中烘干至恒重。用打粉机将样品粉碎成50~200目的粉末。参照《中国人民共和国药典》2010年版一部(P175)灵芝用量6~12 g[3]的中间值9 g,计算细胞培养液中含药量按照《药典》中人体用药的千分之一(9 mg·mL-1)。称取1.296g样品,放入15 mL离心管,加入9 mL纯水,旋涡振荡器混匀,冷水浸泡30 min。超声机超声处理5 min;置水浴锅,99.9℃水浴1 h;超声10 min,5 000 rpm离心15 min;再用高速离心机,10 000 rpm离心10 min;每个样品吸取上清液2 mL,用金属浴99.9 ℃浓缩至500 µl,4℃保存。实验前先做不同给药浓度的梯度预实验,选择最佳给药浓度做正式实验。
2.2 丙酸睾酮的配制
市售原注射液浓度 25 mg·mL-1,用细胞生长培养基和无水乙醇配制成 0.25 mg·mL-1~2.5×10-6mg·mL-1,其中无水乙醇浓度为1.6%。细胞培养实验时取配制好的不同浓度丙酸睾酮10µl,加入到150µl细胞培养液中,使丙酸睾酮的终浓度为 1.5×10-9~1.5×10-3mg·mL-1。
2.3 xCELLigence系统检测不同样品细胞图谱
采用xCELLigene系统96 孔微电子细胞芯片[7],加入细胞生长培养基,50µl /孔,将96 孔微电子细胞芯片放到 xCELLigence系统上测基线。用胰酶消化细胞,并计数,配制细胞浓度,每个孔接种100 µl细胞悬液,LN-CaP细胞接种密度为每孔2×104个细胞,检测48 h后加入“灵芝”样品,使样品提取液终浓度为 2.5 mg·mL-1,5 mg·mL-1,10 mg·mL-1,120 mg·mL-1,150 mg·mL-1。丙酸睾酮终浓度为1.5×10-9~1.5×10-3mg·mL-1(无水乙醇终浓度为0.1%),对照组不加药物,阴性对照只加0.1%无水乙醇。A549细胞每孔接种密度6 000个细胞,检测20 h后加入不同体积样品提取液,使细胞培养孔内的终浓度为 20 mg·mL-1,40 mg·mL-1,80 mg·mL-1,100 mg·mL-1,120 mg·mL-1,对照组 Ctr不加药物。各种样品加入到受试细胞后通过xCELLigene系统来测量细胞状态的改变,包括细胞数量、细胞粘附、细胞活力和细胞形态等。数据分析使用 RTCA 软件,对每孔的数据在样品添加前时间点进行标准化处理。将检测结果数据导出至Microsoft Excel,进行后续处理。通过xCELLigence 系统连续监测可获取动态细胞效应曲线(细胞图谱)[8,9,10]。(说明:人肺腺癌细胞株A549生长较快,选择培养20 h后加药。人激素依赖性前列腺癌细胞株LN-CaP细胞倍增时间长,生长缓慢,选择培养48 h后加药。)

表2 不同灵芝样品的产地和形态记录
3 结 果
3.1 不同浓度灵芝样品的LN-CaP细胞图谱
将1#~9#灵芝样品按上述操作方法,为便于比较,将每条曲线合并到一个坐标图内。不同浓度的样品作用于 LN-CaP 的细胞生长图谱见图 1、图 2:样品 1#~9#在 2.5、5.0、10 mg·mL-1,1#~8#在 2.5~10 mg·mL-1对LN-CaP细胞作用不明显(图1 A~C);唯有样品9#在2.5~10 mg·mL-1对LN-CaP细胞呈与众不同的生长曲线,即对LN-CaP细胞生长抑制呈浓度梯度依赖(图1 D)。
将样品1#~8#的浓度加大到120、150 mg·mL-1,显示抑制LN-CaP细胞生长且具有差异(图2)。
3.2 不同浓度灵芝样品的A549细胞图谱
1#~8#灵芝样品不同浓度对A549细胞生长的影响见图3(A-H),样品质量浓度大于40 mg·mL-1时对细胞生长抑制作用明显。
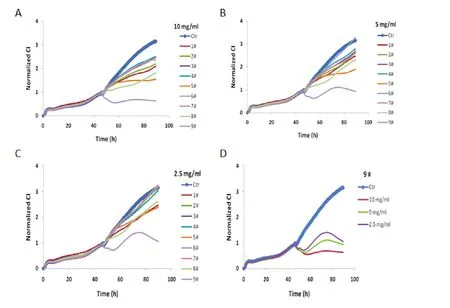
图1 低浓度灵芝样品的LN-CaP细胞图谱
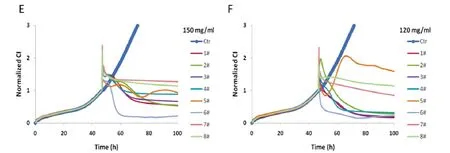
图2 高浓度灵芝样品的LN-CaP细胞图谱
3.3 不同浓度丙酸睾酮的LN-CaP细胞图谱
因为已有文章报道[4]抑制睾酮诱导的BPH大鼠的腹侧前列腺的增长,本实验采用人激素依赖性前列腺癌细胞株LN-CaP,在观察不同浓度灵芝作用情况的同时观察丙酸睾酮对LN-CaP细胞生长的影响(图4):阴性对照0.1%EtOH较对照Ctr没有受到明显影响,丙酸睾酮在较低浓度1.5×10-9、1.5×10-8mg·mL-1时,刺激 LN-CaP 细胞增殖;而在较高浓度 1.5×10-7~1.5×10-3mg·mL-1时,对 LN-CaP 细胞的生长起抑制作用。
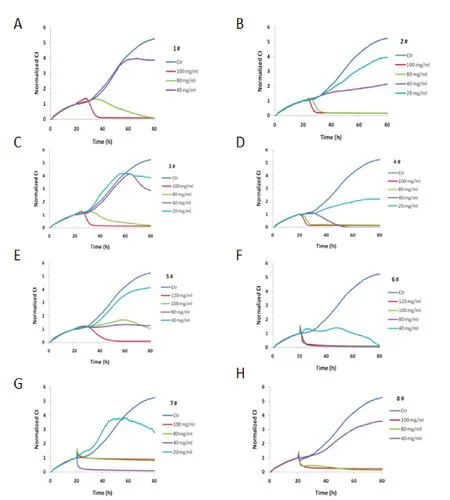
图3 不同浓度灵芝样品的A549细胞图谱
4 讨 论
实时细胞记录仪器xCELLigence系统[7]通过微电极整合在细胞培养孔的底部,能自动、连续地监测测量电阻来反映细胞生长状态,获取细胞全过程动态信息。Huiying Fuet[11]使用xCELLigence系统,以三百五十多种中药材和青藏高原产地采集的十多种冬虫夏草为例,建立了道地药材的鉴别方法,推测中药材的作用机理和作用部位(受体),利用非线性的量效关系判断有效成分高低,筛选真菌菌种,筛选已知药物的抑制剂,提出生物物种的演化关系。本实验使用xCELLigence系统,参照以上的鉴别中药材的方法,得到启示。
市面上“灵芝”类产品从生物学分类上看,分别涉及到灵芝科和多孔菌科的属和种,古文献早就记载了灵芝的产地、形态和功效的关系,而中国药典只记载多孔菌科(现代分类为灵芝科)灵芝属的赤芝和紫芝,灵芝项下的“归经”:心、肺、肝、肾。从图1、2看出,样品1#~8#在 2.5~10 mg·mL-1加药量时抑制作用有差异,但差异不明显,而在 20~120 mg·mL-1时,各种“灵芝”呈现出明显的差异。样品1#,系云南丽江的野生黑芝,在80 mg·mL-1以上对人激素依赖性前列腺癌细胞株LN-CaP有抑制作用;样品2#~8#,抑制浓度分别为40,80,20,80,40,40,80 mg·mL-1。其中西藏林芝产的赤芝(样品6#)对人激素依赖性前列腺癌细胞株LN-CaP和肺腺癌细胞株A549作用最强。提示用于治疗前列腺疾病的用量按中医习惯用量和药典用量可能偏低,鉴于在高浓度120 mg·mL-1和150 mg·mL-1时抑制作用比较明显,为此,建议中药处方用量应该增加到20~40 g·d-1以上,而且需要考虑灵芝的产地和品种。
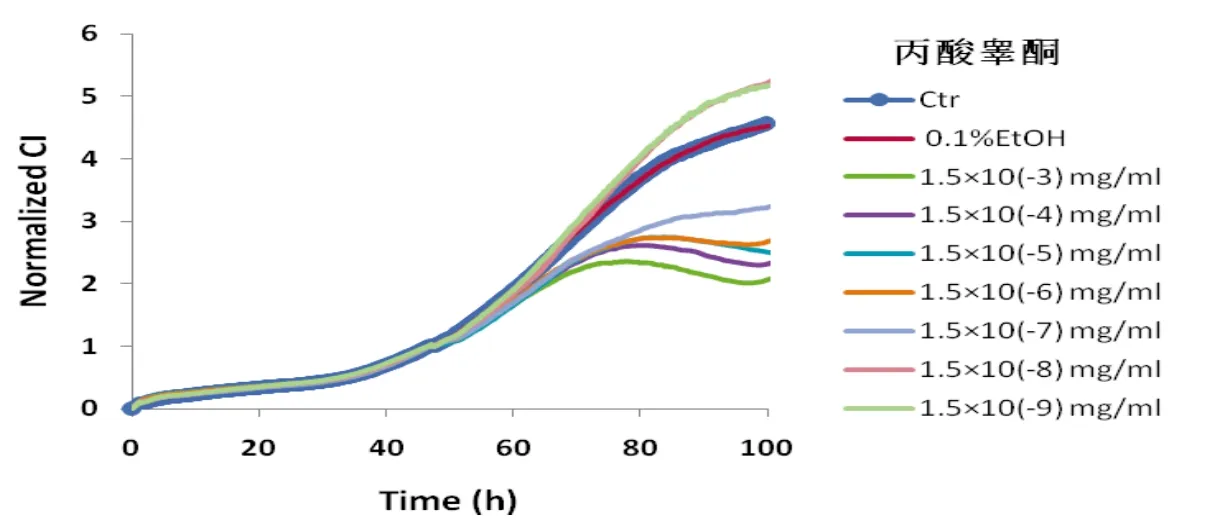
图4 不同浓度的丙酸睾酮对LN-CaP细胞生长图谱
从图3看出,丙酸睾酮对人激素依赖性前列腺癌细胞株LN-CaP有生理效应,在浓度小于1.5×10-7mg·mL-1时有促进作用,而大于1.5×10-5mg·mL-1有抑制作用,而且呈非线性的量效关系。前列腺癌较多发生在老年男性而不在青壮年,可能是青壮年时期体内的雄激素浓度较高,对前列腺癌的发生起抑制作用;而老年时期的雄激素浓度下降,可能会对前列腺癌的发生起促进作用,因此,前列腺癌的发病率反而增加。这与老年男性因雄性激素分泌下降导致前列腺肥大的现象一致。提示常用促进雄性激素分泌的中药“补肾药”,可能对预防前列腺肥大或前列腺癌有益。
从图1发现样品9#(吉林产的桦褐孔菌)在2.5 mg·mL-1低浓度时显示出与众不同的细胞图谱,图1-D显示2.5~10 mg·mL-1的非线性抑制关系,这是否提示:桦褐孔菌对人激素依赖性前列腺癌细胞株LN-CaP的生理活性高于灵芝样品1#~8#,有进一步研究的价值。
以上实验提示,来自不同产地的灵芝,可能存在真菌生理菌种不同,而导致临床作用的强度不同,认为有必要用以上方法选择菌种,以使产业化后的产品稳定有效。
美国编著者凯西丽医生谈中草药保健品及流行疗法的中文版《传闻与真相1》[12]第188页“科研证据”项下记载,“缓解下泌尿道症状:88位男性,有轻度到中度泌尿道症状,被给予一种灵芝提取物(每天6毫克)或安慰剂,为期12周。相比安慰剂,灵芝提取物较大幅度改善下泌尿道症状,也没有不良反应的报告”。这个信息说明,灵芝有可能是一种副作用小且能治疗下泌尿道症状疾病的中草药。遗憾的是,以上记载也没有注明灵芝的产地、种名和灵芝提取物的得率。
[1] 明·刘文泰, 等. 《本草品汇精要》[M]. 华夏出版社, 2004, 1: 125-127.
[2] 赵继鼎.我国古籍中记载六芝的初步考证[J].微生物学通报,1989, 3:180-181.
[3] 国家药典委员会.《中华人民共和国药典》.一部.2010年版[S].中国医药科技出版社,2010:174-175.
[4] Ryuichiro Kondo et al. Utility of functional mushrooms in aging society——The preventative effect of benign prostatic hyperplasia and osteoporosis by Ganoderma lucidum[C], Proceedings of China-Japan Pan Asia Pacific Mycology Forum Symposium, 2008:35-36.
[5] 张小青, 赵继鼎. 《中国真菌志》第十八卷灵芝科[M]. 科学出版社, 2000: 30-165.
[6] 刘波. 《中国药用真菌》第二版[M]. 山西人民出版社, 1978, 5: 103.
[7] Xi B., Wang T., Li N. et al. Functional cardiotoxicity profiling and screening using the xCELLigence RTCA Cardio System[J]. J Lab Autom, 2011, 16(6): 415-421.
[8] Solly K., Wang X., Xu X. et al.Application of real-time cell electronic sensing(RT-CES) technology to cell-based assays[J].Assay and Drug Development Technologies, 2004, 2: 363-372.
[9] Jenny Zhu., Xiaobo Wang., Xiao Xu. et al. Dynamic and label-free monitoring of natural killer cell cytotoxic activity using electronic cell sensor arrays[J]. Journal of Immunological Methods, 2006, 309: 25-33.
[10]Abassi Y., Jackson J.A., Zhu J. et al. Label free,real-time monitoring of IgE-mediated mast cell activation on microelectronic cell sensor arrays[J]. Journal of Immunological Methods, 2004, 292: 195-205.
[11] Huiying Fu., Wenqing Fu., Mingjiao Sun. et al. Kinetic Cellular Phenotypic Profiling:Prediction,Identification,and Analysis of Bioactive Natural Products[J]. Analytical Chemistry, 2011, 83: 6518-6526.
[12] 凯西丽(美)等主编, 刘爱民等翻译. 传闻和真相1[M]. 江苏科学技术出版社, 2012, 9: 188.
