携带抗药基因的CNS对乙醇消毒剂抗性的研究
2013-11-13肖佳庆谭金煜尹世辉
杜 丽 李 俐 林 玲 肖佳庆 谭金煜 孟 琳 尹世辉 孙 宏*
1 黑龙江省疾病预防控制中心,哈尔滨 150030;
2 哈尔滨医科大学公共卫生学院,哈尔滨 150081
随着抗生素广泛使用,CNS引起的医院感染有逐年上升的趋势,而且常表现出耐药性甚至多重耐药而造成难治性感染。人们研究发现随着消毒剂在大量领域的使用,CNS的耐药现象已不仅局限于抗生素,且已扩展到了消毒剂。如何合理使用消毒剂已成为医院感染管理的又一个难题。临床标本的多重耐药监测已经引起重视,但医院环境致病菌耐受消毒剂却很少有人关注。本文通过对医院环境分离的CNS进行耐药基因检测以及与实验室标准菌株对乙醇消毒剂抗性的比较,为消毒剂与抗生素存在交叉耐药的可能性提供参考,并为合理使用消毒剂加强医院感染控制提供依据。
1 材料与方法
1.1 材料
(1)菌株
本次所研究的试验菌株均来自2008~2009年医疗机构环境物体表面及医护人员手的样本,样本共计841份,质控菌株为金黄色葡萄球菌ATCC25923和ATCC43300,(由中国菌种保藏中心提供)。金黄色葡萄球菌(ATCC6538)(由中国军事医学科学院消毒检测中心提供)和qacA基因阳性凝固酶阴性葡萄球菌(TS77)(由重庆医科大学附属第一医院感染科贾蓓教授赠送)。
(2)仪器 PCR仪Labcycler,凝胶成像仪Gel DocXR(BIO-Rad),电泳系统JUNI JY600c,细菌生化鉴定仪WalkaWay-40s1,微量生化管由杭州天和生物有限公司生产。
(3)消毒剂
为>99%分析乙醇,由天津市永大化学试剂开发中心生产。
1.2 方法
1.2.1 标本培养鉴定
对采集标本进行接种培养,从中分离出病原菌凝固酶阴性葡萄球菌(CNS),制备成标本。用细菌生化鉴定仪做菌株鉴定。少数不能鉴定的菌株,采用微量生化管法进行鉴定。
1.2.2 抗药基因检测
1.2.2.1 DNA模板液制备 用无菌枪头挑取平板上数个新鲜菌落,置入200uL灭菌纯水离心管中,充分混匀制成菌悬液,然后将盛装此混合物的离心管置100℃煮沸10min后,在冰上短暂冷却,13000r/min离心10min,上清液即为模板液。
1.2.2.2基因引物序列
引物 qacA:
qacA-F 5′-3′GCTGCA TTTA TGACAA TGTTTG;
qacA-R 5′-3′AATCCCACCTACTAAAGCAG 扩增产物为629bp[3]。
引物mecA:
P1 : 5′GAAATGACTGAACGTCCG-3′;
P2:5′ACTTAGTTCTTTAGCGAT-3′扩增产物为393bp[1]。
1.2.2.3 PCR热循环参数
qacA反应条件:93℃预热2min;93℃30s,55℃ 30s,72℃60s,35个循环;72℃延伸5min。反应结束后,将PCR扩增产物置4℃ 保存。
mecA反应条件:94℃预热10min;94℃30s,52℃ 30s,72℃60s,30个循环;72℃延伸10min。反应结束后,将PCR扩增产物置4℃保存。
1.2.2.4 PCR反应结果检测 将PCR扩增产物经2%琼脂糖凝胶电泳,于紫外凝胶电泳成像仪下观察,出现与阳性对照分子相当的目的条带为阳性,并摄像保存。
1.2.3 药敏试验
用纸片扩散法(K-B法)进行药敏试验,测定具有mecA基因的葡萄球菌对19种抗生素的敏感性。药敏纸片为阿莫西林/克拉维酸(AMC)、氨苄西林/舒巴坦(AMS)、苯唑西林(OXA)、呋喃妥因(NIT)、红霉素(CLA)、环丙沙星(NOR)、复方新诺明(SXT)、克林霉素(CLI)、奎奴普丁/达夫普丁(Q-D)、利福平(RIF)、利奈唑胺(LNZ)、氯霉素(CAP)、青霉素(PEN)、庆大霉素(GEN)、四环素(TET)、头孢唑林(CFZ)、万古霉素(VAN)、亚胺培南(IMP)、左氧氟沙星(LVX),共计19种,为英国Oxoid公司生产。试验方法和结果判定按照临床和实验室标准化研究所(CLSI)《抗菌药物敏感性试验执行标准》[1]规定执行。
1.2.4 消毒剂抗力测定
1.2.4.1 菌悬液配制 将PCR试验检出携带qacA基因的凝固酶阴性葡萄球菌与标准菌株金黄色葡萄球菌(ATCC6538)分离培养,取单个菌落接种于营养琼脂斜面,37℃培养24h后,用胰蛋白胨磷酸盐缓冲液(TPS)洗下,配制成菌悬液备用。
1.2.4.2 最小抑菌浓度(MIC)试验和最小杀菌浓度(MBC)试验
MIC试验[1]:采用肉汤稀释法,将乙醇消毒剂用无菌蒸馏水做对倍系列稀释,取各浓度乙醇消毒液2.5mL加入含2.5mL双倍浓度营养肉汤中,然后加入0.1mL菌悬液,充分混匀,同时设定阳性与阴性对照。37℃48h培养后观察结果。以无菌生长的最低稀释度的浓度为MIC值。
MBC试验:是在MIC试验基础上从各浓度无菌生长的试管中吸取0.5mL样液加入到装有4.5mL含中和剂肉汤(经鉴定试验证明用5g/L硫代硫酸钠、10g/L吐温80、1g/L卵磷脂肉汤有效)的试管中混匀,放置于37℃培养箱中培养48h,观察有细菌生长。以无菌生长的最低稀释度的浓度为MBC值。
以上试验在水浴温度20℃条件下进行,均重复3次。
2 结果
2.1 基本情况
采集物体表面478份样本、医护人员手363份样本。从中分离出63株CNS,其中有15株分离自物体表面、38株源于护士手、10株分离自医生手。
2.2 分离鉴定及抗药基因检测结果
采集的841份医院环境与医务人员手样本中分离出63株CNS,检出率为7.49%。
检测结果表明:在63株CNS中有12株携带qacA抗药基因,携带率为19.05%。24株凝固酶阴性葡萄球菌(CNS)耐药基因mecA检出阳性,阳性率为38.09%。

图1 12株凝固酶阴性葡萄球菌耐药基因qacA PCR电泳图

图2 14株凝固酶阴性葡萄球菌耐药基因mecA PCR电泳图

图3 10株凝固酶阴性葡萄球菌耐药基因mecA PCR电泳图
2.2 耐药菌药敏试验结果
经检测:在医院物体表面及医护人员手上分离的63株CNS中,24株均为MRCNS,检出率为38.09%,对抗生素药物的药敏试验结果见表1。
2.3 对乙醇消毒剂抗性结果
2.3.1最小抑菌浓度(MIC)检测结果
经测定结果表明,乙醇消毒剂对分离出的12株凝固酶阴性葡萄球菌的MIC值为1株高于标准菌株,1株低于标准菌株,10株与标准菌株相同(见表2)。
2.3.2 最小杀菌浓度(MBC)检测结果
检测结果表明,乙醇消毒剂对分离出的12株凝固酶阴性葡萄球菌的MBC值为1株高于标准菌株,1株低于标准菌株,10株与标准菌株相同(见表3)。
3 讨论
近年来CNS在医院的广泛传播,造成的院内感染所带来的医疗负担已引起各国的重视。本文检测结果显示,在医院环境物体表面及医护人员手上分离出的凝固酶阴性葡萄球菌检出率比较高为7.49%,其中检出12株携带qacA抗药基因的CNS中表皮葡萄球菌6株(50.0%)、溶血性葡萄球菌4株(33.3%)、瓦氏葡萄球菌和头状葡萄球菌各一株(8.3%)。结果表明,表皮葡萄球菌是CNS感染的主要菌种[2]。而随着抗菌药物的广泛应用,细菌耐药率的逐年升高已成为临床和微生物工作者关注和研究的重要课题[3]。不合理使用抗生素与抗生素耐药性提高显著有很大关系,尤其对某些常用抗生素更为突出。本研究检出的63株CNS中24株均为MRCNS。因此,加强抗生素使用的宏观管理,合理使用抗生素十分必要。
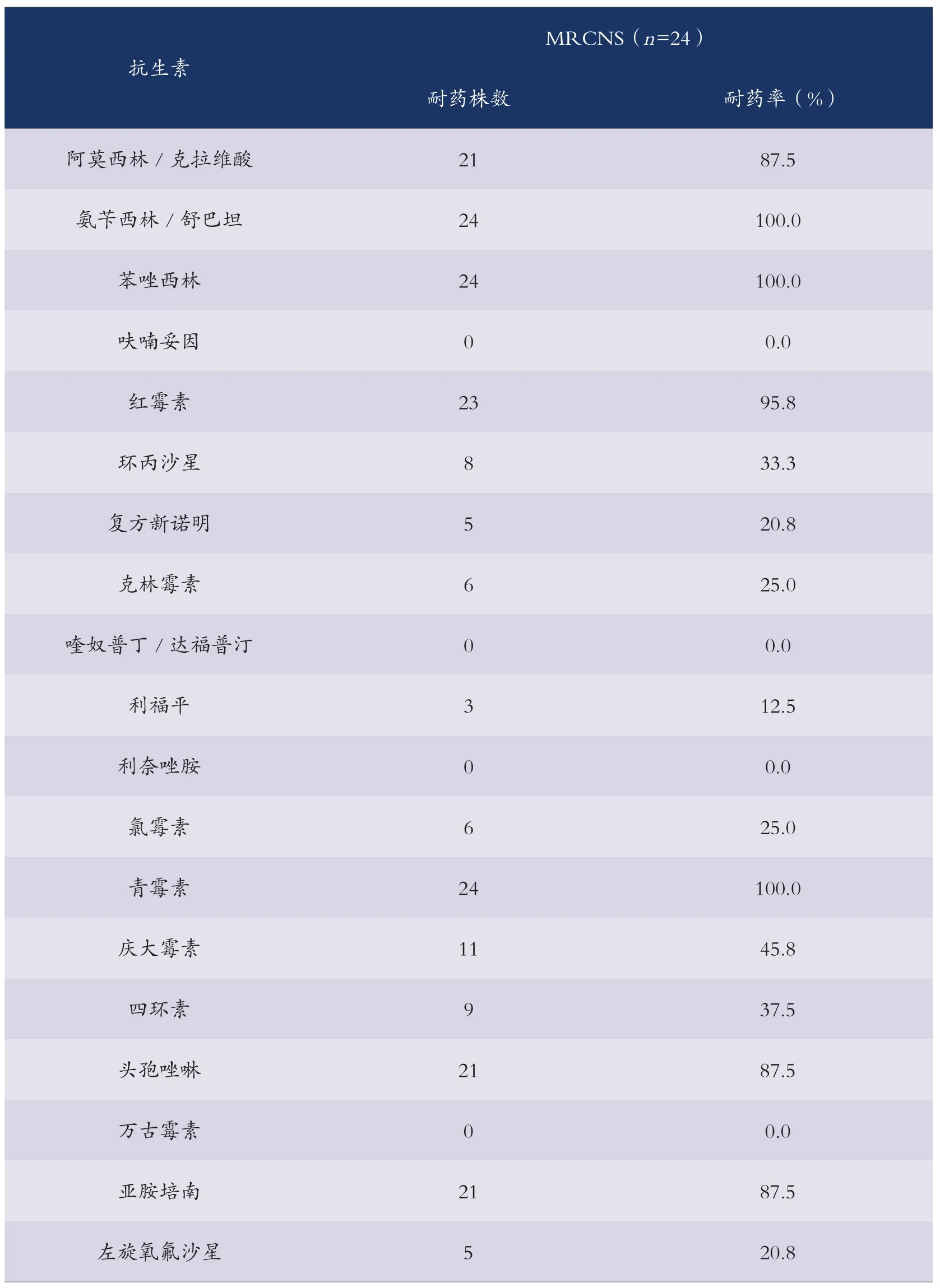
表1 24株MRCNS对19种抗生素药物的耐药率(%)
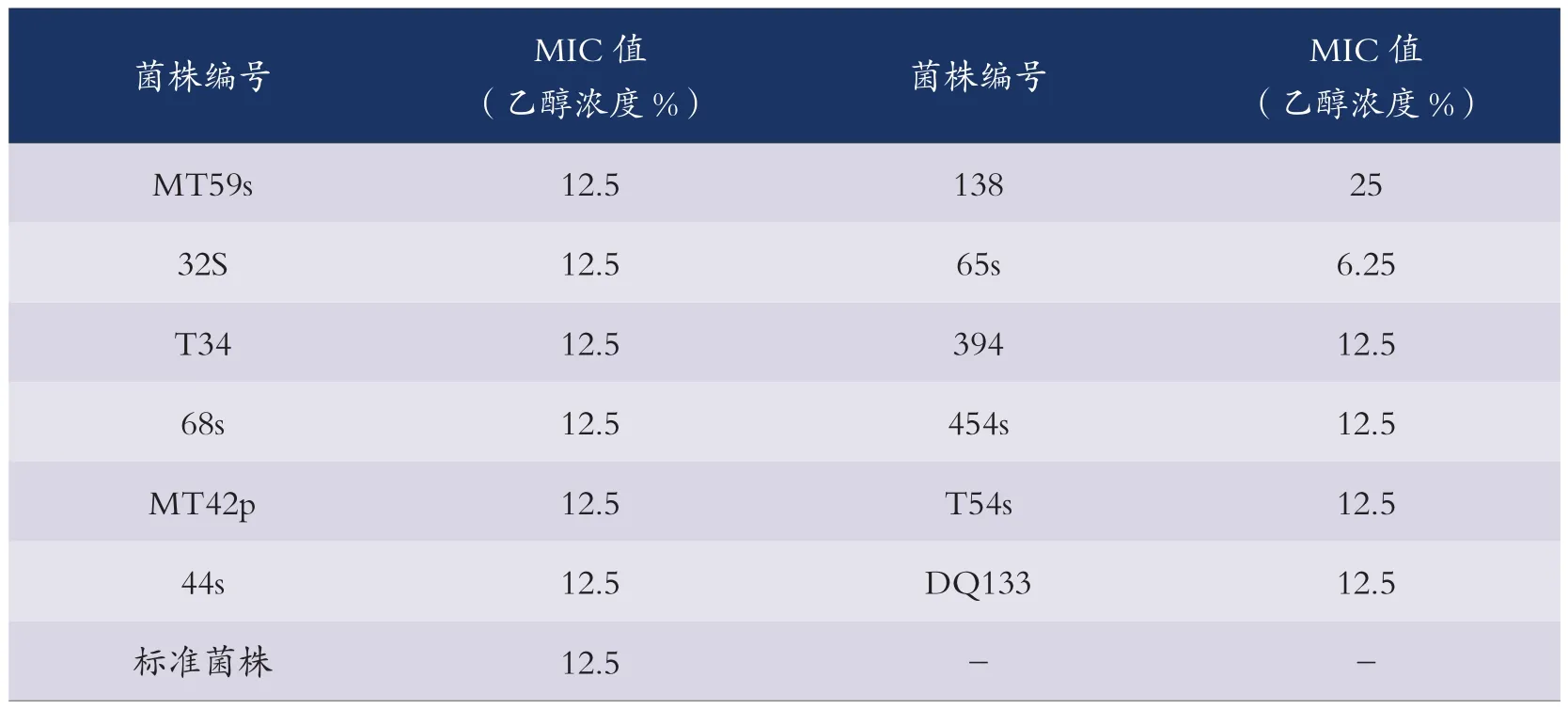
表2 乙醇消毒剂对携带qacA基因的CNS的MIC测定结果

表3 乙醇消毒剂对携带qacA基因的CNS的MBC测定结果
医院内受污染的物体表面及医护人员的手等是造成耐药细菌医院感染的重要因素,其中医护人员的手是导致患者间交叉感染、传播耐药细菌的重要途径,对污染的环境及医护人员手进行有效的消毒是控制医院感染的重要机制。本研究选用醇类消毒液,因醇类消毒剂是通过使细菌蛋白质变性起杀菌作用,其作用快速,毒性低,所以目前多数快速手消毒液配方都是以醇类作为增效或主要杀菌成分。有研究显示,消毒剂在公共环境的广泛使用、过度使用以及不当使用,可促使细菌产生耐消毒剂现象。同时具有抗生素与消毒剂抗性的菌株出现,则把医院感染控制推向更加严峻的境地[4]。本研究结果显示,12株携带qacA抗药基因的CNS对乙醇的MIC及MBC抗性均为1株高于标准菌株,1株低于标准菌株,其余10株与标准菌株相同。已有研究表明医院环境检出的CNS对聚维酮碘、二氯异氰尿酸、三氯异氰尿酸[5]、醋酸氯己定[6]、苯扎溴铵[7]等消毒剂的抗力均有不同程度的增高。
研究医院环境中物体表面和医护人员手上分离的CNS耐药性及对消毒剂的抗性,加强对医院抗生素及化学消毒剂的严格管理和正确合理使用,是预防医院感染的重要措施。而医院环境内物品和医护人员手的消毒有不同的要求,消毒剂的消毒效果又受到各种因素影响。因此,必须根据消毒剂作用于细菌的可靠资料和有关新的研究成果,慎重选用最适宜浓度,以保证最佳的消毒效果,避免因消毒剂使用不当而导致医院感染暴发事件的发生。
[1]国家卫生和计划生育委员会.消毒技术规范,[S],2002;85-86.
[2]姜绯,赵晓萌.凝固酶阴性葡萄球菌的菌种分布及流行变迁[J].实用医技杂志,2006.13(9).
[3]Scbwajber S,Stapjeton JT,Gijjigan PH.Emengncy ot Vancomycio resistance coagujose negtive staphylococci[J].N Eng J Med,1987,316:927.
[4]David W,JohnP,Derrick C,waves of trouble:MRSA strain dynamics and assessment of the impact of infection control [J]. J Antimicrob Chemother.2011,66(2):2685.
[5]林玲,李俐,孟琳等. 凝固酶阴性葡萄球菌抗药基因检测及其对消毒剂抗性研究[J].中国消毒学杂志,2011,28(5):559.
[6]李俐,林玲,谭金煜等. 携带抗药基因的CNS对醋酸氯己定的抗力研究[J].中国消毒学杂志,2012,29(8):679.
[7]孟琳,李俐,尹世辉等. 凝固酶阴性葡萄球菌对苯扎溴铵消毒剂的抗力观察[J].中国消毒学杂志,2012,29(7):563.
