递增负荷运动对大鼠早期B 细胞发育数量及凋亡情况的影响
2013-11-12耿青青
耿青青
笔者前期的实验研究证明:“运动性免疫抑制”最初是针对T 细胞发育分化调节而言,总结了前期工作,笔者认为针对B 细胞、T 细胞等免疫细胞的发育分化调节而言,称之为“运动性免疫失衡”会更准确、全面[1-5]。6周递增运动过程中,机体根据运动需要,通过改变凋亡率,进而改变早期发育中Pro B 细胞、Pre B细胞的数量百分比,以尽可能维持免疫稳态,而且发现Pre B 细胞对运动负荷更敏感,易受运动的刺激而发生凋亡,细胞数量百分比显著性下降[1]。也研究了早期B 细胞发育起着关键调控作用的转录因子、细胞因子[2],它们在6周递增负荷运动中,产生的适应性及应答性变化,以及与Pro B、Pre B 细胞之间的等级性调节。那么,骨髓早期B 细胞在经历了Pro B、Pre B 细胞发育后的immature B,mature B 细胞阶段,又发生了哪些变化?这些变化与Pro B 细胞、Pre B 细胞的变化又有着怎么样的联系?
基于此问题的思考,在前期长期递增负荷对早期Pro B 细胞、Pre B 细胞在骨髓中发育影响的基础上,利用流式细胞术,分析6周递增负荷运动对immature B,mature B 细胞数量与凋亡情况的影响及其与Pro B 细胞、Pre B 细胞的相关关系,探讨长期运动对骨髓早期B 细胞发育的调节机制,为运动性免疫失衡的调控机制及进一步的干预措施提供一定的理论依据。
1 材料与方法
1.1 实验动物
雄性SD 大鼠(8周龄,体重130~150 g)128 只(许可证号:SCXK(粤)2008-0020;NO:0043379,粤监证字F2008A002),随机分为实验组和对照组。实验组(96 只)进行6周递增强度训练;绝对安静组(对照组,32 只),正常喂养,不进行运动干预,分别于第0、2、4、6周末采样,用于判别大鼠生长对测试指标的影响(实验组实际参与运动的大鼠是106 只,以备补充建模中意外死亡大鼠。本次建模因意外死亡大鼠2只)。结果发现,对照组各指标各周之间没有显著性差异(P >0.05),表明6周生长对这些指标没有显著影响。
1.2 运动模型设计、取材时间及建模测试指标
参照Bedfor d(1979)根据大鼠体重/ 摄氧量回归方程所建立的递增负荷(跑台坡度),课题组前期通过反复实验性探索获得的运动性免疫失衡发生、发展的动物模型[6-11]:模拟运动训练安排,长时间、大强度且负荷递增。
因此,采用低强度适应性运动(10 m/min)训练1周后,负荷递增至20 m/min。随后,每周递增负荷增量5 m/min。至第6周,达到40 m/min,基本达到大鼠最大负荷强度。分别在第0、2、4、6周最后一次运动后48 h 采样。采样日进行与上周相同负荷的跑台运动,分别在运动前安静组(A)、运动后即刻组(J)、运动后3H 组(3H)无菌取大鼠(股骨)骨髓,用于流式细胞仪检测。
多年来的研究表明,分别从血液指标、生化指标、脾淋巴细胞分泌IL-2、sIL-2R、T 细胞活性、巨噬细胞吞噬能力、白细胞介素、自由基代谢、抗氧化体系、心肌离子泵、神经递质等指标,同时监测大鼠体重、皮毛亮度、进食饮用水量及饲料量,通过比较对照组与训练组的这些指标的显著性变化,来验证大鼠6周递增负荷跑台运动模型的建立是成功的[6-11]。
1.3 主要试剂与仪器
主要试剂:Alexa Fluor ® 647 anti-rat CD45RA,产品编号202312,购自BioLegend;Phycoerythrin (PE)anti- rat IgM,产品编号12-0990,购自eBioscience;Phycoerythrin (PE)Mouse IgG1,κIsotype Ctrl,产品编号12- 4714,购自eBioscience;FITC anti- rat IgD(H6/31),产品编号sc-53081,购自Santa Cruz;normal mouse IgM- FITC,产品编号sc- 2859,购自Santa Cruz;7-AAD,产品编号00-6993,购自eBioscience;BD Calibrite 3 Beads(FITC,PE,PerCP)产品编号340486,购自BD PharmingenTM;BD Calibrite APC Bead产品编号340487,购自BD PharmingenTM。主要仪器:美国BD 公司FASC Calibur 流式细胞仪;日本OLYMPUS 倒置生物显微镜;美国Thermo FORMA 725 超低温冰箱。
1.4 多色染色法流式细胞术的测定
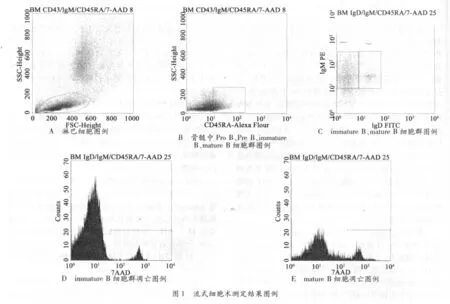
活体麻醉大鼠取股骨,置冰上快速用16 号针头抽取骨髓;制备新鲜骨髓单细胞悬液,对细胞计数,将细胞浓度调至5 ×106/ml。骨髓中两个亚群的表型分别为:Immature B cell:CD45RA+(IgM+IgD-);mature B cell:CD45RA+(IgM+IgD+);采用直接染色法,在流式细胞仪FACS Calibur(BD 公司)上收集并进行表型分析。
1.5 数据处理
2 研究结果
2.1 6周递增负荷运动中immature B 细胞、mature B细胞数量百分比及凋亡率的流式测定图例
2.2 各周运动负荷及恢复过程中immature B 细胞、mature B 细胞数量百分比的适应性及应答性变化
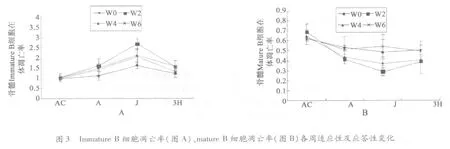
在6周递增负荷运动中,0周:各组间immature B细胞数%、mature B 细胞数% 均无显著性差异(P >0.05)。
2周:与A 组比,J 组immature B 细胞数%、mature B 细胞数%均呈显著性下降(P <0.05),3H 组均显著性上升(P <0.05);与J 组比,3H 组分别呈显著性上升(P <0.05)、非常显著性上升(P <0.01)。
4周:与A 组比,immature B 细胞数%在J 组呈显著性下降(P <0.05),而mature B 细胞数%在3H 组呈显著性上升(P <0.05);与J 组比,仅immature B 细胞数%在3H 组呈显著性上升(P <0.05)。
6周:与A 组比,J 组仅mature B 细胞数%呈显著性下降(P <0.05),immature B 细胞数%、mature B 细胞数%在3H 组均呈显著性升高(P <0.05);与J 组比,仅mature B 细胞数%在3H 组呈显著性增加(P <0.05)(见图2)。

2.3 各周运动负荷及恢复过程中immature B 细胞、mature B 细胞凋亡率的适应性及应答性变化
在6周递增负荷运动中,0周:各组间immature B细胞、mature B 细胞凋亡率均无显著性差异(P >0.05)。
2周:与A 组比,J 组immature B 细胞凋亡率呈显著性上升(P <0.05),3H 组有下降趋势(P >0.05),而mature B 细胞凋亡率则呈显著性下降(P <0.05),3H 组有上升趋势(P >0.05);与J 组比,immature B 细胞凋亡率3H 组呈显著性下降(P <0.05),而mature B细胞凋亡率则呈显著性上升(P <0.05)。
4周:与A 组比,J 组immature B 细胞凋亡率呈显著性上升(P <0.05),3H 组基本恢复到A 组水平(P>0.05),而mature B 细胞凋亡率在J 组有下降趋势(P >0.05),3H 组有上升恢复趋势(P >0.05)。
6周:与A 组比,仅immature B 细胞凋亡率J 组呈显著性上升(P <0.05),与J 组比,仅immature B 细胞凋亡率3H 组呈显著性下降(P <0.05)(见图3)。
3 讨论与分析
3.1 6周递增负荷运动对immature B 细胞数量的影响
Pre B 细胞轻链基因成功重排后,B 细胞膜上就开始出现单体膜型IgM,这标志着B 细胞抗原非依赖阶段immature B 细胞发育的完成。此时通过克隆删除,形成自身免疫耐受,发育为表达mIgM+mIgD+的成熟B 细胞(mature B cell),离开骨髓进入外周免疫器官。
6周递增负荷运动过程中,在WK0,运动并未对骨髓早期B 细胞数量百分比造成明显影响,但从WK2 开始,各运动组B 淋巴细胞出现较明显波动,表明一次性的短时间运动训练对骨髓几乎没有影响,然而大强度、长时间训练对骨髓早期B 细胞发育有较显著的影响。
经过长期的运动训练,骨髓immature B 细胞数量百分比出现不同时相的显著性变化(见图2-A),提示随训练时间的延长,运动负荷的增强,运动量的积累对immature B 细胞的影响渐趋增强,提示6周递增负荷运动中,immature B 细胞渐趋对运动应激的敏感性提高。结合我们前期对Pro B、Pre B 细胞的研究结果[1],推测是机体根据运动的需要,通过调节B 细胞所占骨髓总细胞的数量百分比,尽力维持免疫稳态。
可能的原因,一方面是运动训练的骨骼肌适应性改变的发生可能伴随如中性粒细胞和吞噬细胞在肌肉损伤处聚集、骨骼肌白细胞浸润等炎症反应。有研究显示机体发生炎症时,在多种炎性介质诱导下早期造血细胞更倾向于向髓系方向分化,而抑制向淋巴系的分化[12]。
推测另一方面可能是由于运动能够影响各群B淋巴细胞的分化成熟的同时,各种应激激素的产生,也诱导早期B 细胞的大量凋亡,导致骨髓内各群早期B淋巴细胞计数减少。因此,我们继续研究了6周递增负荷运动对骨髓早期B 细胞发育各阶段细胞凋亡的影响。此外,还可能与运动大量耗能,骨髓发育中B细胞对葡萄糖和氨基酸的摄取减少有关。
3.2 6周递增负荷运动对immature B 细胞凋亡的影响
在免疫系统的发育和功能行使过程中,细胞凋亡始终扮演重要角色,淋巴细胞的分化、成熟乃至死亡过程都伴随着凋亡。
本实验用流式7-AAD 染料,不含固定剂的红细胞溶血素处理细胞,染上7-AAD 的细胞是中晚期凋亡细胞及坏死细胞。因严格控制实验条件的一致性,可认为各组坏死细胞数相近,故各组的染色细胞的比较,可以认为是凋亡细胞的比较,也被业内人士认可。
Lu L 等运用不同的实验方法证明发育中B 细胞的丢失是由凋亡造成[13-15]。当未成熟细胞开始表达IgM 时,将会遇到并识别骨髓微环境中的自身抗原,部分表达抗自身抗原受体的B 细胞与抗原结合后被诱导凋亡而清除。
本研究中immature B 细胞凋亡率的变化特征揭示,随着运动负荷的增加和训练时间的延长,应该是机体根据运动需要,通过改变凋亡率,进而改变B 细胞所占骨髓总细胞的数量百分比,以求缓解运动性免疫失衡(如细胞免疫的抑制;体液免疫的亢进,外周B 细胞数量增多但分泌免疫球蛋白功能降低等),尽可能的维持免疫稳态。各早期B 细胞亚群凋亡率的增加,推测可能是运动减少了早期发育中各B 细胞亚群细胞膜表面抗凋亡蛋白Bcl-2 的表达而促成的。
流式实验检测到的凋亡细胞的百分数,其实仅是代表了在一个短暂时刻里可获取的、并且是在体非体外培养状态中的大量凋亡细胞的一小部分,而且是扑捉了在凋亡发生伊始与巨噬细胞吞噬这一时间段内的细胞。流式细胞术测得的骨髓中早期B 细胞的凋亡,只是一个相对的凋亡活动,本身并不能给予一个在体的真实凋亡率。因此,今后观测早期B 细胞在体发育的凋亡率,有待于探索一种更直接的检测方法。
3.3 6周递增负荷运动对mature B 细胞数量及其凋亡的影响
B 前体细胞在骨髓中的发育由Immature B 细胞向mature B 细胞转化的过程,经历了阴性选择,从而保证有效产生的mature B 细胞对自身抗原的免疫耐受,防止自身免疫性疾病的发生,所以在immature B 细胞向mature B 细胞转化的这一过程对机体来说是至关重要的。
6周递增负荷运动过程中,mature B 细胞数量百分比及凋亡率的适应性变化特征是:与WK0 A 相比,mature B 在WK2 A 呈显著性上升(P <0.05),WK4 A无显著性差异但有下降趋势(P >0.05),WK6 A 显著性高于WK0 A(P <0.05)(见图2-B)。Mature B 凋亡率适应性变化特征:与WK0 A 相比,mature B 在WK2 A、WK4 A 均呈显著性下降(P <0.05),WK6 A无显著性变化(P >0.05)(见图3-B)。与前期工作中Pro B、Pre B[1]、immature B 细胞数量百分比的变化相比,实验采点相同时相下,本研究中mature B 则呈现较多的反相变化趋势(见图2-B,图3-B),推测由以下因素造成。
Laakko 等[16]模拟了应激下的CS(皮质酮)浓度(60~95μg/ dl 血液),观察12~36h 内CS 对BM(骨髓)中的各发育阶段B 细胞的影响。发现:不成熟B细胞,由占BM 所有细胞数的约7%下降到不足1%。成熟B 细胞并未受CS 的负面影响,由占BM4%上升为12%,增加了近3 倍。研究者们对增多的成熟B 细胞的来源也不清楚,推测是外周B 细胞归巢入骨髓所导致;另一方面,可能与骨髓早期B 细胞各亚群抗凋亡原癌基因bcl-2 的表达量多少有关。在细胞进行基因重排时观测到抗凋亡蛋白Bcl-2 的下调,只有在prepro B 细胞(前祖B 细胞)和mature B 细胞表达大量的Bcl-2。
其他研究报道揭示在Pre B 阶段,可诱导产生炎性细胞因子的TLR 信号能够促进Pre B 细胞表达IgM,成为新生B 淋巴细胞[17]。另有其他研究者们进一步推测成熟B 细胞的增多是由于自身反应性B 淋巴细胞因逃避阴性选择过程而存活下来[18],这是由可诱导产生炎性细胞因子的TLR4 信号促成的。还有研究揭示,一些自身反应性的B 细胞在阴性选择过程中并不一定走向凋亡,而是有可能返回到上一个阶段重新进行V-D-J 重排,重新产生成为对自身抗原无反应的B 淋巴细胞[19]。
Osmond、Stephan、Cancro 等先后提出了代偿机制学说[17,20]。他们认为,当机体处于应激或其他需要更多能量输出状态下,存在代偿机制,出现骨髓mature B淋巴细胞增多现象。研究显示Pro B 细胞随年龄增长数量变化不大,但对IL-7 刺激的增殖能力下降,Pre B 细胞数量减少,但机体通过代偿机制使存活的Pre B细胞更多的分化成为mature B 淋巴细胞,以适应机体整合需要[20]。
本研究中mature B 细胞的变化特征,产生原因可能是在6周递增负荷运动中,长时间的运动消耗,引起HPA 轴活动加强,皮质酮明显上升,机体分解代谢加速;同时,雄激素分泌减少,合成代谢减弱,以此满足持续运动对机体大量耗能的需求。推测这些变化驱动了骨髓发育中B 细胞的代偿机制,即促使存活的Pre B细胞更多的分化为mature B 细胞,以适应机体大量耗能的需要。
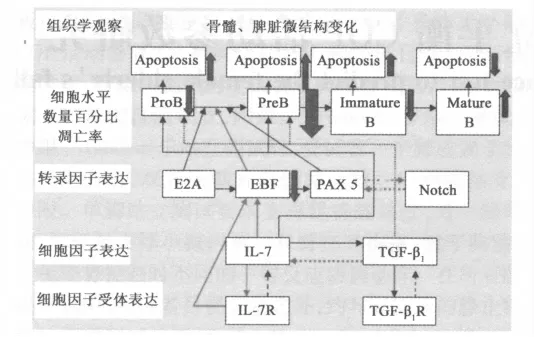
图4 实验各指标在第2周的变化及相互关联
运动对早期B 淋巴细胞发育的影响,涉及多方面、错综复杂的调节因素网络,今后还有大量的实验研究工作待进行。如图4 所示,本课题研究希望进一步通过组织学观察,细胞水平,转录因子、细胞因子及其受体、趋化因子及其受体、Notch 信号转导通路等各层面进一步探讨长期运动对骨髓早期B 细胞发育的调节机制,为运动性免疫失衡的调控机制及进一步的干预措施提供理论依据。
4 研究结论
4.1 提示6周递增运动过程中,机体根据运动需要,通过改变凋亡率,进而促成早期发育中B 细胞的数量百分比的改变,以求缓解运动性免疫失衡(如细胞免疫的抑制、体液免疫的亢进等),尽可能维持免疫稳态;
4.2 联系前期对Pro B、Pre B 细胞数量及凋亡率的影响,本研究提示随训练时间的延长,运动负荷的增强,运动应激对mature B 凋亡率的影响却是渐趋减弱的;
4.3 结合前期对Pro B、Pre B 细胞的研究工作,实验采点相同时相下,本研究中mature B 则呈现较多的反相变化趋势。提示6周递增负荷运动可能通过代偿机制促使存活的Pre B 细胞更多地分化为mature B 淋巴细胞,以适应机体大量耗能的需要。
[1]耿青青,郝选明.长期递增负荷跑台对大鼠骨髓Pro B 细胞、Pre B 细胞发育的影响[J].广州体育学院学报,2011,31(5):101-105.
[2]耿青青,郝选明.递增负荷运动中调控淋巴细胞发育分化的转录因子的动态变化[C].第九届全国体育科学大会,上海:2011.
[3]耿青青,郝选明.骨髓中IL-7、IL-7R 及EBF 表达与运动性免疫失衡[J].体育学刊,2011,18(1):139-144.
[4]耿青青,郝选明.免疫细胞、细胞因子与延迟性肌肉酸痛症[J].体育学刊,2009,16(12):107-112.
[5]耿青青.Effects of Long- term Incremental Exercise on the Transcription Factor in Development of Early Precursor B Lymphocytes in Rats Bone[C].The international convention on Science,Education and Medicine in Sport,2012.
[6]耿青青,郝选明.The effect of long-term incremental exercise on Glutamate Decarboxylase in the hippocampus of rats[C].The international convention on Science,Education and Medicine in Sport,2008.
[7]郝选明,李杰,黄治官.Response and adaptation of IL-2 and sIL-2R secreted from lymphocytes during long-term exercise in rats[C].The international convention on Science,Education and Medicine in Sport,2008.
[8]郝选明,曾志刚,黄治官.The response and adaptation of neurtransmitters (Ach.DA.NA.AD)in the hypothalamic arcuate nucleus during long-term exercise[C].The international convention on Science,Education and Medicine in Sport,2008.
[9]林玲.大鼠心肌HSP70、自由基代谢和Na+-K+-ATPase活性对有氧耐力运动的应答性和适应性变化[D].广州:华南师范大学,2003.
[10]唐亮.大鼠细胞免疫功能对6周递增负荷运动的应答性和适应性特征[D].广州:华南师范大学,2007.
[11]万发达.血细胞和血红蛋白对长期递增负荷运动的反应与适应特征[D].广州:华南师范大学,2005.
[12]Ueda,Y.,Kondo,M.,Kelsoe,G.Inflammation and the reciprocal production of granulocytes and lymphocytes in bone marrow[J].J.Exp.Med,2005,201:1771–1780.
[13]Lu L,Chappel MS,Humphrise RK,et al.Regulation of cell survival during B lymphopoiesis:increased pre-B cell apoptosis in CD24 transgenic mouse bone marrow[J].Eur J Immunol,2000,30:2686.
[14]Lu L,Chaudhury P,Osmond DG.Regulation of cell survival during B lymphopoiesis:enhanced pre-B cell apoptosis in CSF-1 deficient op/op mutant mice[J].Exp Hematol,2001,29:596.
[15]Lu L,Osmond DG.Apoptosis and its modulations during B lymphopoiesis in mouse bone marrow[J].Immunol Rev,2000,175:158-168.
[16]Laakko T,Fraker P.Rapid changes in the lymphopoietic and granulopoietic compartments of the marrow caused by stress levels of corticosterone[J].Immunology,2002,105:111-19.
[17]Cancro MP,Hao Y,Scholz JL,et al.B cells and aging:molecules and mechanisms[J].Trends Immunol,2009,30(7):313-8.
[18]Nemazee D.Receptor editing in lymphocyte development and central tolerance[J].Nat Rev Immunol,2006,6(10):728-40.
[19]Luning Prak ET,Monestier M,Eisenberg RA.B cell receptor editing in tolerance and autoimmunity[J].Ann N Y Acad Sci,2011 Jan,1217:96-121.
[20]Wei B,Su TT,Stephan RP,et al.Resident enteric microbiota and CD8+T cells shape the abundance of marginal zone B cells[J].Eur J Immunol,2008,38(12):3411-25.
