用重组8型腺相关病毒载体介导的乙型肝炎病毒持续感染小鼠模型评价核苷类似物的抗病毒效果
2013-11-12王国婧王刚董小岩田文洪尉迟捷魏国超孟红吴小兵
王国婧,王刚,董小岩,田文洪,尉迟捷,魏国超,孟红,吴小兵
1 山东省医学科学院基础医学研究所 济南大学 山东省医学科学院医学与生命科学学院,山东 济南 250000
2 中国疾病预防控制中心 病毒病预防控制所,北京 100052
3 北京五加和分子医学研究所,北京 100176
4 吉林大学生命科学学院,吉林 长春 130012
5 北京亦庄国际生物医药投资管理有限公司,北京 100111
乙型肝炎病毒 (Hepatitis B virus,HBV)属嗜肝DNA病毒科,是引起病毒性乙型肝炎的病原体[1]。全球约 1/3的人曾感染过 HBV,慢性HBV感染者约3~4亿,其中25%~40%人死于HBV感染相关性疾病[2]。我国属于 HBV感染的高流行区,一般人群的 HBsAg阳性率接近10%[3]。对现有病毒性乙型肝炎患者及 HBsAg携带者的防治工作,在今后几十年里仍是一项艰巨的任务。
目前,治疗乙型肝炎的药物主要包括核苷酸类似物和干扰素等[4],其中以核苷酸类似物临床应用最广泛[5]。由于HBV耐药突变株不断出现[6],使得现有抗 HBV药物难以达到理想的治疗效果,因此需要研发新的药物。而新型乙肝药物的筛查鉴定需要合适的HBV动物模型。因小鼠容易获得、研究背景清楚、经济实用等优点,HBV相关小鼠模型是理想的新型乙肝治疗药物的筛选动物模型。
2010年本课题组利用高嗜肝性 8型重组腺相关病毒携带1.3个拷贝的HBV基因组 (ayw亚型)(Recombinant adeno-associated virus type 8 carrying 1.3 copies of HBV genome (ayw),rAAV8-1.3HBV),体内转导C57BL/6小鼠,成功制备乙型肝炎病毒持续感染小鼠模型[7]。该模型与HBV转基因小鼠类似,小鼠体内可持续检测到HBeAg和HBsAg的表达以及HBV DNA的复制。HBV转基因小鼠模型已广泛应用于治疗病毒性乙型肝炎核苷酸类似药物的筛选和评价。为探讨该模型是否也可用于新型核苷酸类抗 HBV药物筛选和评价,本研究选用目前临床治疗病毒性乙型肝炎最常用的两种核苷酸类似物 (拉米夫定和恩替卡韦)作用于该模型,对比给药前后及停药前后小鼠血清学 HBV DNA、HBeAg、HBsAg检测指标的变化情况,判断此模型能否反映核苷类药物的抗HBV效果。
1 材料与方法
1.1 材料
4~6周龄雄性C57BL/6小鼠购自北京华阜康生物科技股份有限公司;乙型肝炎病毒 (HBV)核酸定量检测试剂盒 (PCR-荧光探针法) (国药准字 S20020033)购自深圳匹基生物有限公司;HBeAg、HBsAg定性诊断试剂盒购自北京万泰生物药业股份有限公司;HBeAg、HBsAg定量检测试剂盒购自美国Abbott公司;恩替卡韦片 (国药准字H20052237)购自中美上海施贵宝制药有限公司;拉米夫定片 (国药准字 H20030581)购自葛兰素史克公司。
1.2 重组病毒rAAV8-1.3HBV的制备
重组腺相关病毒 rAAV8-1.3HBV由北京五加和分子医学研究所制备和提供。主要步骤为:用pAAV2neo-1.3HBV质粒转染BHK21细胞后,800 μg/mL G418培养基选择培养 15 d,得到BHK21/AAV-1.3HBV细胞;用携带rep2cap8基因的重组单纯疱疹病毒 (MOI=1~5)感染BHK21/AAV-1.3HBV细胞,72 h收获病变细胞以及培养上清液,按照吴小兵等报道的AAV载体纯化方法[8]进行粗纯化,之后使用离子交换柱层析方法进一步纯化,点杂交方法测定病毒滴度。
1.3 动物模型
将 rAAV8-1.3HBV病毒经尾静脉注射至30只 C57BL/6小鼠体内。注射剂量为 1×1011vg/200 μL/只。注射病毒14、28和42 d后,分别小鼠尾静脉采血,分离血清,测定血清中 HBeAg和HBsAg表达水平以及HBV DNA拷贝数,判断模型构建成功与否。
1.4 荧光定量PCR检测血清HBV DNA
病毒注射后第42天、实验过程中第5天、第10天、第25天4个时间点尾静脉取血,分离血清,按照乙型肝炎病毒 (HBV)核酸扩增(PCR)荧光定量检测试剂盒的说明书检测小鼠血清HBV DNA表达水平。
1.5 ELISA检测小鼠血清HBeAg、HBsAg
病毒注射第14天和第28天后分别尾静脉取血,分离血清,去离子水稀释 20倍后,用万泰公司 HBeAg、HBsAg诊断试剂盒检测小鼠血清HBeAg和HBsAg表达水平,检测过程参见试剂盒说明书。两项指标阳性判断标准均为样品OD450≥阴性对照孔平均值×2.1。
病毒注射第 42天以及实验第 10天和第 25天后分别尾静脉取血,分离血清,生理盐水稀释40倍后,用Abbott公司的HBeAg、HBsAg定量检测试剂盒检测小鼠血清HBeAg和HBsAg表达水平,检测过程参见试剂盒说明书。阳性参考值分别为:HBeAg (S/CO)>1,HBsAg (mIU/mL)>0.05。
1.6 实验设计
整个实验流程如图1所示,分为建立、筛选慢性HBV感染小鼠模型并对该模型的成模率进行评价,以及评价核苷酸类似物药物作用效果两个阶段。具体如下所述。
1.6.1 实验分组
根据病毒注射第14天和第28天后每只小鼠的 HBeAg、HBsAg表达定性检测结果,以及第42天 (药物处理0 d) 后HBeAg、HBsAg和HBV DNA的定量检测结果,从 30只注射 rAAV8-1.3HBV小鼠中挑选27只小鼠用于后续实验。挑选出的27只小鼠各自HBV DNA表达水平都大于1×105IU/mL,HBeAg和HBsAg在第14天和第 28天时的定性检测均为阳性,且第 42天时HBeAg、HBsAg和HBV DNA的定性检测结果都较高。用随机数表法,对挑选出的 27只模型小鼠进行分组,其中空白对照组 (Untreated) 5只、生理盐水组 (NS) 4只、ETV高剂量组(1.0 mg/(kg·d))5只、ETV低剂量组 (0.1 mg/(kg·d))4只、LAM高剂量组 (500 mg/(kg·d))5只、LAM低剂量组 (100 mg/(kg·d))4只。
1.6.2 药品
恩替卡韦、拉米夫定研成粉末,损失量以每片20%计算,生理盐水配置药品溶液,4 ℃保存备用。
1.6.3 处理
根据 1.6.1中小鼠模型分组时设定的每组给药种类和剂量给药。每组小鼠以灌胃方式连续给药10 d (第1~10天),每日1次,之后停药15 d(第11~25天)。实验过程中,第0天、第5天、第10天和第 25天,分别尾静脉采血,分离血清,−20 ℃保存备用。第 25天采血后,处死全部小鼠。
1.6.4 统计学分析
图1 实验流程示意图Fig. 1 The schematic map of procedure for experiment. In the whole of experiment process, mouse model of HBV chronic infection was firstly established by injection of rAAV8-1.3HBV and determination of model. Then suitable models were chosen, different kinds of drugs were given and effects of drugs on model were assessed.
采用成组 t检验分析相对应时间点 (0 d、10 d和25 d)给药组与NS组的血清学HBV DNA表达水平统计学差异;采用配对t检验分析给药组给药前后和停药前后的HBV DNA表达水平的统计学差异。HBeAg、HBsAg定量检测两项指标分别采用成组 t检验分析相对应时间点 (0 d、10 d和25 d)给药组与NS组的统计学差异;采用配对t检验分析给药组给药前后和停药前后的统计学差异。以上分析过程均采用 SPSS16.0软件分析完成。
2 结果
2.1 小鼠成模情况
将 rAAV8-1.3HBV病毒经尾静脉注射至 30只C57BL/6小鼠体内,第14天和第28天后分别对30只小鼠采血并定性检测 HBeAg和HBsAg表达水平。结果显示,第14天除11号、25号小鼠HBeAg检测结果为阴性外,其余小鼠均为阳性;30只小鼠HBsAg检测结果均为阳性。第28天除25号小鼠HBeAg检测结果为阴性外,其余小鼠均为阳性;同时各小鼠 HBsAg检测结果均为阳性。第 42天定量检测小鼠血清学 HBV DNA、HBeAg、HBsAg的表达水平,结果如图2所示。30只小鼠血清学 HBV DNA表达情况(lg (IU/mL)),除11号小鼠为4.13,25号小鼠为3.85,28号小鼠为4.46以外,其余27只小鼠均大于 5.00,平均值为 5.38±0.34。进一步定量检测小鼠血清HBeAg及HBsAg的表达情况。以上3只血清HBV DNA表达水平较低的小鼠情况如下:11号小鼠HBeAg表达为2.00 S/CO,HBsAg表达为23.07 mIU/mL;25号小鼠HBeAg表达为1.13 S/CO,HBsAg表达为8.10 mIU/mL;28号小鼠HBeAg表达为8.27 S/CO,HBsAg表达为81.54 mIU/mL。其他27只小鼠血清HBeAg平均值 13.22±1.78 S/CO,最低值为 9.50 S/CO;HBsAg平均值 93.24±7.24 mIU/mL,最低值为81.69 mIU/mL。结合血清HBV DNA表达水平及HBeAg、HBsAg情况,在 30只小鼠中剔除 11号、25号、28号小鼠,挑选其他27只小鼠用于后续实验。
2.2 药物处理对小鼠模型血清HBV DNA的影响
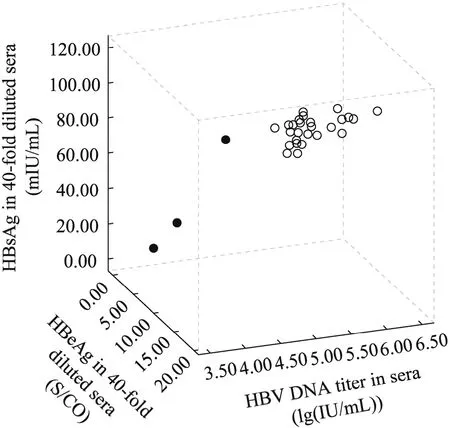
图2 HBV慢性感染小鼠模型的确定Fig. 2 Determination of mouse model of HBV chronic infection. Thirty mice were injected with rAAV8-1.3HBV. Forty-two days post-injection, HBsAg, HBeAg,and HBV DNA titer in sera were assayed. Mouse whose HBV DNA, HBsAg (40-fold diluted), and HBeAg(40-fold diluted)titer in sera was separately more than 5.00 (lg(IU/mL)), 81.00 mIU/mL, and 9.50 S/CO was determined as model. Twenty-seven mice were chose as models. The hollow circles indicated the mouse model of HBV chronic infection; the solid circles indicated the mice which were not determined as models.
rAAV8-1.3HBV介导的HBV持续感染小鼠模型成功建立后,按照 ETV高、低剂量分别给药10 d后停药15 d,尾静脉取血检测血清学HBV DNA的变化情况,结果见表1。相同时间点ETV低剂量组与生理盐水组对比分析,发现给药10 d后相比于生理盐水组,ETV低剂量组血清学HBV DNA表达水平下降显著,差异存在统计学意义(P<0.05)。不同时间点 ETV低剂量组组内对比(图3),给药5 d与0 d相比,血清学HBV DNA表达水平 (lg (IU/mL))由 5.31±0.42下降到4.54±0.46,差异具有统计学意义 (P<0.05);给药10 d与0 d相比,下降到4.26±0.05,差异具有统计学意义 (P<0.05);停药15 d与给药10 d对比,HBV DNA表达水平有所反弹,上升到4.57±0.14,差异具有统计学意义 (P<0.05)。
相同时间点血清 HBV DNA表达水平 ETV高剂量组与生理盐水组对比分析 (表1),相比于生理盐水组,ETV高剂量组给药5 d即出现显著下降,差异存在统计学意义 (P<0.01);给药10 d继续下降,差异存在统计学意义 (P<0.01);停药15 d差异仍具有统计学意义 (P<0.01)。不同时间点 ETV高剂量组组内对比分析 (图 3),给药5 d与0 d相比,血清学HBV DNA表达水平(lg (IU/mL))由 5.36±0.36 下降到 4.29±0.18,差异具有统计学意义 (P<0.01);给药10 d与0 d相比,下降至 3.75±0.21,差异具有统计学意义(P<0.01);停药第15天与给药第10天相比变化甚微,为3.69±0.27。
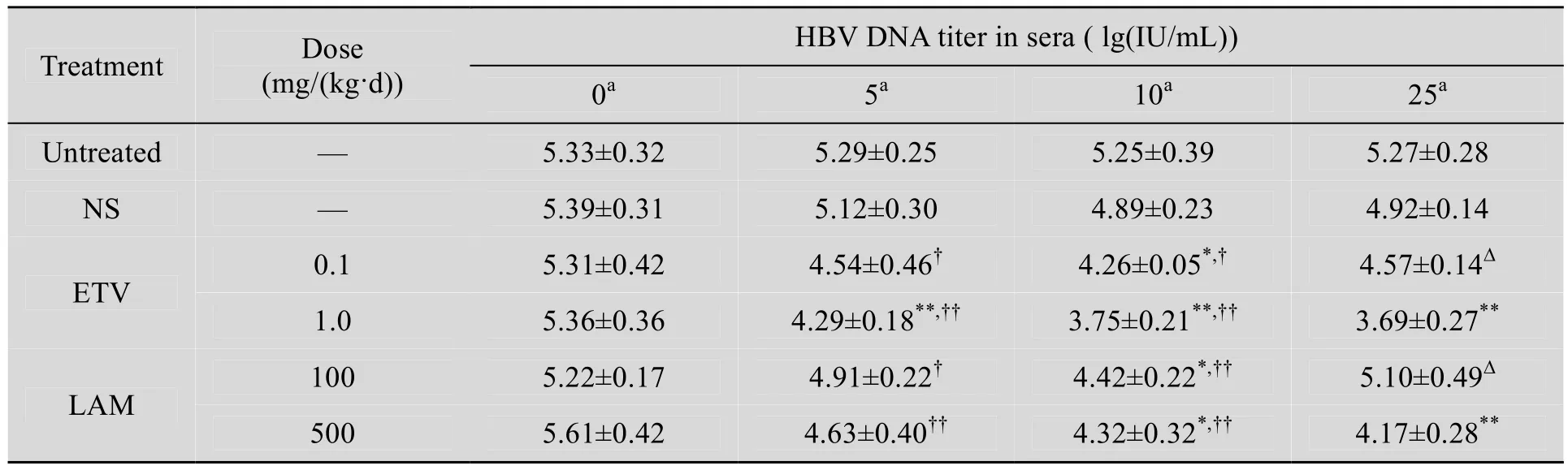
表1 ETV和LAM分别作用于rAAV8-1.3HBV介导的HBV持续感染小鼠模型后不同时间点血清HBV DNA情况Table 1 HBV DNA titer in sera of HBV chronic infection mouse model mediated by rAAV8-1.3HBV at different time points treated with ETV or LAM
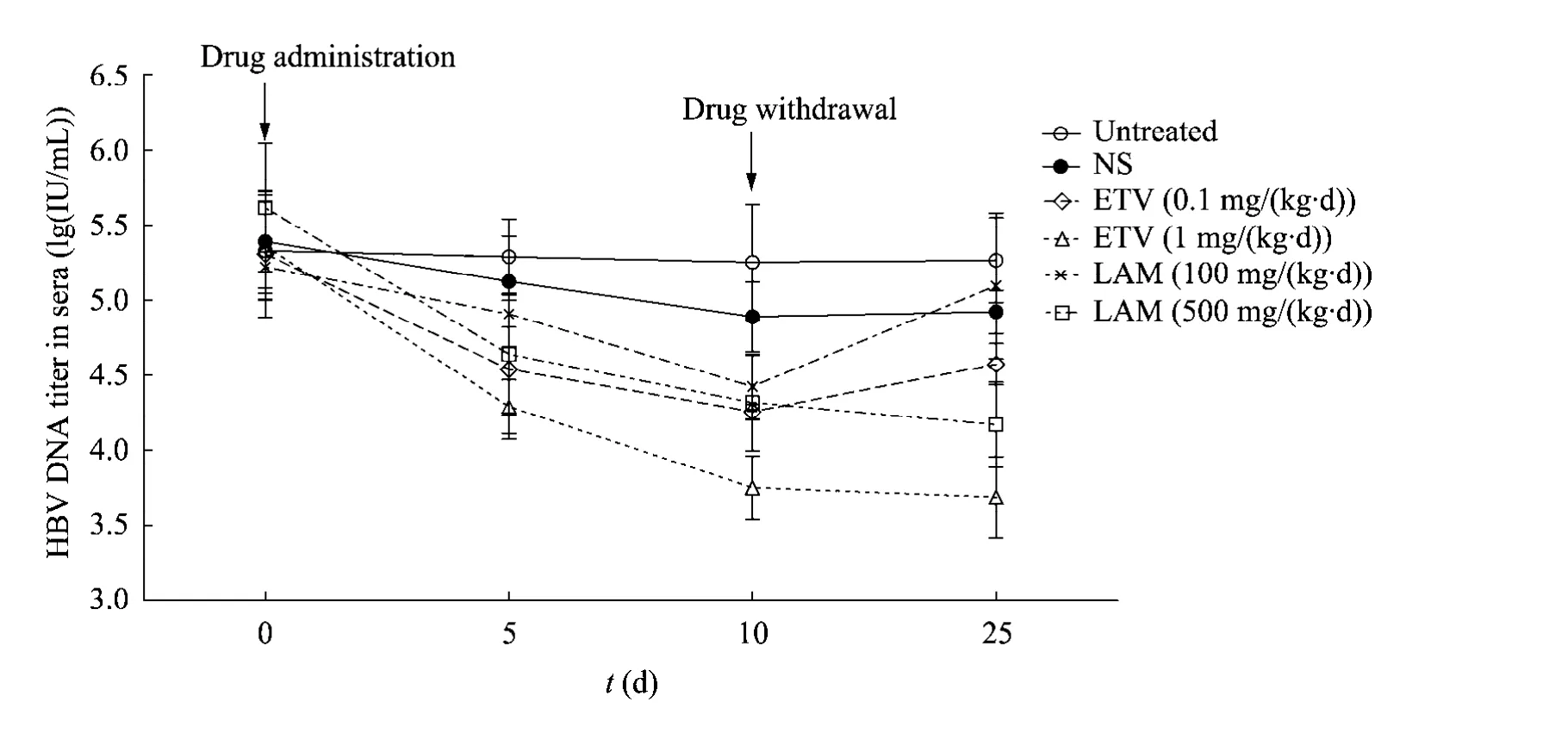
图3 rAAV8-1.3HBV介导的HBV持续感染小鼠模型血清中HBV DNA表达随时间的变化情况Fig. 3 HBV DNA titer in sera of the HBV chronic infectious mice models mediated by rAAV8-1.3HBV at different time points. Mice models of HBV chronic infection were continuously treated by drugs day by day for 10 days. Then drugs were withdrew and lasted for fifteen days. At different time points in the process, HBV DNA titer in sera was tested.
rAAV8-1.3HBV介导的HBV持续感染小鼠模型成功建立后,按照LAM高、低剂量分别给药10 d后停药15 d,尾静脉取血检测血清学HBV DNA变化情况,结果如表 1所示。相同时间点LAM 低剂量组与生理盐水组对比分析,发现给药10 d后相比于生理盐水组,LAM低剂量组血清学HBV DNA表达水平也显著下降,差异存在统计学意义 (P<0.05)。而不同时间点LAM低剂量组组内对比分析,给药5 d与0 d相比,血清学 HBV DNA表达水平 (lg (IU/mL))由5.22±0.17下降到 4.91±0.22,差异具有统计学意义 (P<0.05);给药 10 d与 0 d相比,下降到4.42±0.22,差异具有统计学意义 (P<0.01);停药15 d后与给药第10天对比,HBV DNA表达水平反弹,上升到 5.10±0.49,差异具有统计学意义 (P<0.05)。
同理,相同时间点血清HBV DNA表达水平LAM 高剂量组与生理盐水组对比分析 (表 1),相比于生理盐水组,LAM高剂量组给药10 d出现显著下降,差异存在统计学意义 (P<0.05);停药15 d差异仍具有统计学意义 (P<0.01)。不同时间点LAM高剂量组组内对比分析 (图3),给药5 d与0 d相比,血清学HBV DNA表达水平 (lg (IU/mL))由 5.61±0.42 下降到 4.63±0.40,差异具有统计学意义 (P<0.01);给药10 d与0 d相比,下降至 4.32±0.32,差异具有统计学意义(P<0.01);停药第15天与给药第10天相比变化甚微,为 4.17±0.28。此外,实验全程中生理盐水组略有下降,但各时间点均无统计学意义,未处理组血清学HBV DNA表达水平平稳,无明显变化,且相同时间点生理盐水组和未处理空白组间HBV DNA表达水平无统计学差异。
2.3 药物处理对小鼠血清中 HBeAg、HBsAg水平的影响
检测ETV给药前后和停药前后血清中HBeAg表达水平,即第 0天、第 10天、第 25天时的HBeAg表达水平,结果如图4A所示,所有结果均为血清40倍稀释后的测定值。ETV低剂量组第0天时HBeAg表达水平为13.49±1.72 S/CO,给药10 d后为13.28±1.87 S/CO,停药15 d后为13.26±1.60 S/CO,实验全程中HBeAg表达无明显变化,未见统计学差异。ETV高剂量组第 0天表达为 12.44±1.93 S/CO,给药 10 d为13.05±1.74 S/CO,停药 15 d为 12.55±1.64 S/CO,全程HBeAg表达无明显变化,差异无统计学意义。同时,空白对照组、生理盐水组全程血清HBeAg表达水平无明显变化,差异无统计学意义。
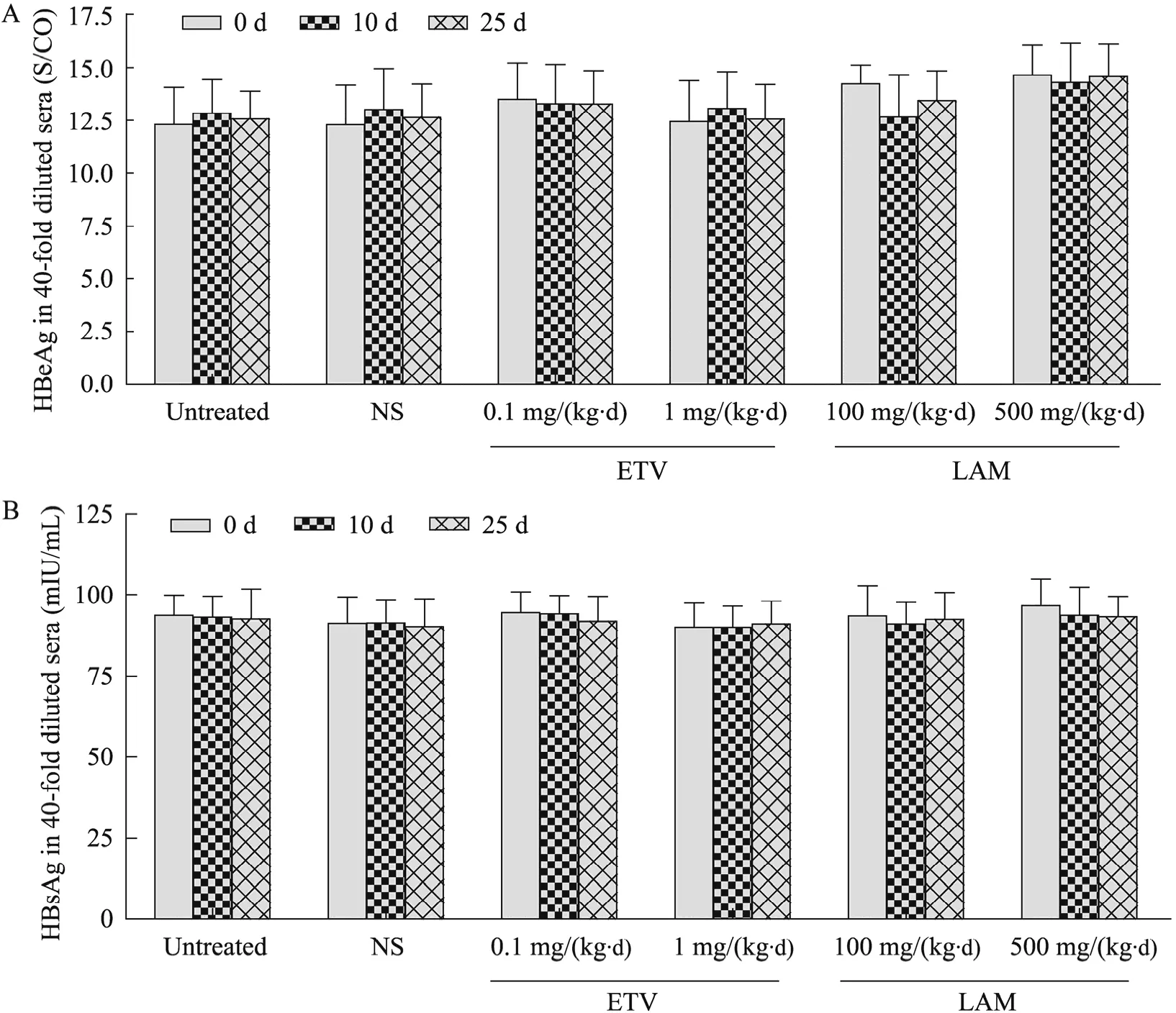
图4 rAAV8-1.3HBV介导的HBV持续感染小鼠模型血清中HBeAg、HBsAg表达随时间的变化情况Fig. 4 HBeAg and HBsAg titer in the HBV chronic infectious mice models mediated by rAAV8-1.3HBV at different time points. (A)The HBeAg titer. (B)The HBsAg titer.
检测 ETV给药前后血清中 HBsAg表达水平,即第0天、第10天、第25天时的HBeAg表达水平,结果如图4B所示,所有结果均为血清40倍稀释后的测定值。ETV低剂量组第0天时HBsAg表达水平为94.43±6.48 mIU/mL,给药 10 d为 94.10±5.67 mIU/mL,停药 15 d为91.76±7.71 mIU/mL,实验全程中HBsAg表达无明显变化,差异无统计学意义。ETV高剂量组第0天时HBsAg表达水平为90.02±7.42 mIU/mL,给药10 d为90.01±6.47 mIU/mL,停药15 d为91.01±6.94 mIU/mL,实验全程中HBsAg表达也无明显变化,差异无统计学意义。空白对照组、生理盐水组全程血清 HBsAg表达水平无明显变化,差异无统计学意义。
检测 LAM给药前后血清中 HBeAg表达水平,即第0天、第10天、第25天时的HBeAg表达水平,结果如图4A所示,所有结果均为血清40倍稀释后的测定值。LAM低剂量组第0天时HBeAg表达为14.22±0.91 S/CO,给药10 d为12.65±2.00 S/CO,停药 15 d为 13.43±1.41 S/CO,实验全程HBeAg表达无明显变化,差异无统计学意义。LAM高剂量组在第0天时HBeAg表达为14.65±1.38 S/CO,给药 10 d为 14.29±1.82 S/CO,停药15 d为14.57±1.50 S/CO,实验全程HBeAg表达无明显变化,差异无统计学意义。
检测 LAM给药前后血清中 HBsAg表达水平,即第0天、第10天、第25天时的HBeAg表达水平,结果如图4B所示,所有结果均为血清 40倍稀释后的测定值。LAM 低剂量组第 0天时 HBsAg表达为 93.42±9.41 mIU/mL,给药10 d为 90.99±6.77 mIU/mL,停药 15 d为92.33±8.35 mIU/mL,实验全程HBsAg表达无明显变化,差异无统计学意义。LAM高剂量组第0天时 HBsAg表达为 96.61±8.23 mIU/mL,给药10 d为 93.62±8.73 mIU/mL,停药 15 d为93.16±6.30 mIU/mL,实验全程HBsAg表达也无明显变化,差异无统计学意义。
3 讨论
小鼠由于缺乏HBV病毒进入及脱壳所需的特异性受体和某些因子,无法直接应用感染性乙型肝炎病毒接种的方法制备模型[9]。现有的小鼠模型是借助其他手段将HBV基因组导入到肝脏或者直接利用转基因方法制备的。近来本课题组用携带1.3拷贝HBV基因组的重组8型腺相关病毒 (rAAV8-1.3HBV)成功在具有正常免疫力的 C57BL/6小鼠体内建立了 HBV持续感染模型,该模型在小鼠肝细胞中自发回复形成染色体外环状闭合HBV基因组DNA,在血清中持续检测到HBeAg及HBsAg表达,在肝脏及血清均持续检测到HBV DNA。
本实验应用的rAAV8-1.3HBV介导的HBV持续感染小鼠模型与现有小鼠模型相比,主要存在以下几个优点。与转基因小鼠相比,该模型应用免疫功能正常的成体小鼠,没有转基因小鼠在胚胎发育过程中对HBV DNA形成的免疫耐受过程[10-11];模型制备操作过程简单可控;模型血清中HBV DNA水平一致性好,各组组内标准差小;初始建模病毒量高低、建模时间可控。更为重要的是以本研究所用的小鼠模型为基础,可以很方便地获得HBV耐药突变株的动物模型。这有利于研究目前临床应用核苷酸类似物后出现的耐药突变问题[12],为耐药株筛选抗HBV敏感的新药物。此外,本模型与应用水动力方法的建立的HBV小鼠模型[13-14]相比,具有HBV DNA表达稳定,水平集中,时间长久,成功率高等优点。
基于上述一系列优点,对rAAV8-1.3HBV介导的HBV持续感染小鼠模型应用已上市最常用的两种核苷酸类似物 (ETV和LAM),观察两药在该模型中的抗HBV作用效果。ETV是鸟嘌呤核苷类似物,LAM 是胞嘧啶核苷类似物,两种药物均通过形成三磷酸盐形式而表现活性[15-16],主要作用于病毒逆转录酶位点[17-18]。HBV复制需要利用逆转录酶以病毒 pg RNA (Pregenomic RNA)为模板逆转录生成负链 DNA (Minusstrand DNA),然后合成RC DNA (Relaxed circular DNA)和 DSL DNA (Double-stranded linear DNA)[19]。这一步是核苷酸类似物药物阻断HBV复制、产生抗HBV效果的关键环节。本实验观察了用药前后模型小鼠血清HBV DNA、HBeAg、HBsAg的变化情况。
首先初步评估了 rAAV8-1.3HBV介导的小鼠成模情况。在第 14天、第 28天进行血清学HBeAg及HBsAg定性检测。在30只小鼠中初步选择前后两次检测两项指标均为阳性的小鼠用于后续实验。同时,由第 42天小鼠血清 HBV DNA表达水平 (lg (IU/mL))观察可见,30只小鼠中27只大于5.0。本实验中,我们将小鼠血清HBV DNA表达水平 (lg (IU/mL))大于5.0定为阳性模型筛选标准。在 30只小鼠中进一步筛选出 27只作为构建成功的小鼠模型。结合小鼠血清 HBeAg、HBsAg两项指标表达情况分析,被剔除的3只小鼠血清HBeAg、HBsAg的表达水平,明显低于其余27只小鼠血清HBeAg表达水平的平均值 (13.22±1.78 S/CO)和 HBsAg表达水平的平均值 (93.24±7.24 mIU/mL)。因此,在30只小鼠中最终挑选出27只用于后续实验。本次实验,rAAV8-1.3HBV介导的 HBV持续感染小鼠模型通过尾静脉注射的方法构建成功,成模率达90%,反映了该模型制备简单、成模率高的特点。
对已建立的rAAV8-1.3HBV介导的HBV持续感染小鼠模型应用核苷酸类似物后发现,ETV及 LAM 两药高、低剂量组均对小鼠血清 HBV DNA产生明显抑制效果。其中,两种药物高剂量组对小鼠血清HBV DNA的抑制作用明显强于低剂量组。给药过程中随着给药时间延长,所有给药组小鼠模型血清HBV DNA表达水平逐渐下降。给药停止前,即给药10 d后,所有给药组小鼠血清HBV DNA水平下降至给药全程最低值。整个实验过程中,未处理组血清HBV DNA水平未观察到改变。而生理盐水组血清HBV DNA水平有所下降,但差异无统计学意义,这可能由反复灌胃刺激引起。此外,无论给药5 d或10 d后ETV高、低剂量组对小鼠血清HBV DNA抑制效果均强于LAM高、低剂量组,这一现象与两种药物在临床实际应用中的情况相符[20-21]。停药15 d与给药10 d相比,两种药物低剂量组小鼠血清HBV DNA水平出现明显上升,提示低剂量组出现停药反弹现象,这也与临床情况吻合[22]。
与小鼠血清HBV DNA表达水平出现明显变化形成鲜明对比的是血清ELISA结果。无论高、低剂量给药组或生理盐水组、空白对照组,小鼠血清 HBeAg、HBsAg给药前后、停药前后表达稳定,未出现明显改变。这可能是因为核苷酸类似物药物作用于逆转录酶位点,能够有效地抑制以pg RNA为模板的逆转录过程中DNA的合成,降低新合成的HBV DNA产量。但核苷酸类似物不能够清除细胞中原有的HBV DNA量,即转录时需要的模板,也不能够抑制转录过程,因此细胞中HBeAg和HBsAg表达过程可能不受核苷酸类似物影响,用药前后表达水平未见明显变化。该模型中的这一现象,也与转基因小鼠模型应用核苷酸类似物后,血清学HBV DNA明显下降,HBeAg、HBsAg无明显变化的现象相类似[23-26]。
对rAAV8-1.3HBV介导的HBV持续感染的小鼠模型应用核苷酸类似物后,小鼠血清 HBV DNA表达水平下降,而血清HBeAg、HBsAg表达水平未见明显改变。该模型能够客观真实地反映现有核苷酸类似物的抗HBV效果,同时具有制备简单、成模率高的特点,可以作为新的抗HBV核苷酸类似物筛选评价模型进行进一步推广应用。
[1]Jin Q. Medical Molecular Virology. Beijing:Science Press, 2001: 325−347 (in Chinese).金奇. 医学分子病毒学. 北京: 科学出版社,2001: 325−347.
[2]Zhuang H. Progress in epidemiology of hepatitis B virus. Chin J Fronti Med Sci, 2009, 1(2): 18−24 (in Chinese).庄辉. 乙型肝炎流行病学研究进展. 中国医学前沿杂志, 2009, 1(2): 18−24.
[3]Zhao H, Si CW. Current study on epidemiology of viral hepatitis Bin China. Chin J Front Med Sci,2008, 1(2): 1−3 (in Chinese).赵鸿, 斯崇文. 中国乙型病毒性肝炎的流行现状.中国医学前沿杂志, 2008, 1(2): 1−3.
[4]Ayoub WS, Keeffe EB. Review article: current antiviral therapy of chronic hepatitis B. Aliment Pharmacol Ther, 2011, 34(10): 1145−1158.
[5]Fung J, Lai CL, Seto WK, et al. Nucleoside/nucleotide analogues in the treatment of chronic hepatitis B. J Antimicrob Chemother, 2011, 66(12):2715−2725.
[6]Zoulim F. Hepatitis B virus resistance to antiviral drugs: where are we going? Liver Int, 2011,31(Suppl 1): 111−116.
[7]Dong XY, Yuchi J, Wang G, et al. Establishment of hepatitis B virus (HBV)chronic infection mouse model by in vivo transduction with a recombinant adeno-associated virus 8 carrying 1.3 copies of HBV genome(rAAV8-1.3HBV). Chin J Virol,2010, 26(6): 425−431 (in Chinese).董小岩, 尉迟捷, 王刚, 等. 高嗜肝性8型重组腺相关病毒体内转导法制备乙型肝炎病毒持续感染小鼠模型. 病毒学报, 2010, 26(6): 425−431.
[8]Wu XB, Dong XY, Wu ZJ, et al. A novel method for purification of recombinant adeno-associated virus vectors on a large scale. Chin Sci Bull, 2001,46(6): 485−489.
[9]Li P, Yu YZ. The mouse model of HBV infection.Inter J Epidemiol Infect Dis, 2006, 33(6): 392−395(in Chinese).李平, 于益芝. 乙型肝炎病毒感染的小鼠模型.国际流行病学传染病学杂志, 2006, 33(6):392−395.
[10]Takashima H, Araki K, Miyazaki J, et al.Characterization of T-cell tolerance to hepatitis B virus (HBV)antigen in transgenic mice.Immunology, 1992, 75(3): 398−405.
[11]Akbar SK, Onji M. Hepatitis B virus(HBV)-transgenic mice as an investigative tool to study immunopathology during HBV infection. Int J Exp Pathol, 1998, 79(5): 279−291.
[12]Lok AS, Zoulim F, Locarnini S, et al. Antiviral drug-resisitant HBV: standardization of nomenclature and assays and recommendations for management. Hepatology, 2007, 46(1): 254−265.
[13]Yang PL, Althage A, Chung J, et al. Hydrodynamic injection of viral DNA: a mouse model of acute hepatitis B virus infection. Proc Natl Acad Sci USA, 2002, 99(21): 13825−13830.
[14]Huang LR, Wu HL, Chen PJ, et al. An immunocompetent mouse model for the tolerance of human chronic hepatitis B virus infection. Proc Natl Acad Sci USA, 2006, 103(47): 17862−17867.
[15]Yamanaka G, Wilson T, Innaimo S, et al.Metabolic studies on BMS-200475, a new antiviral compound active against hepatitis B virus.Antimicrob Agents Chemother, 1999, 43(1):190−193.
[16]Lai CL, Yuen MF. Profound suppression of hepatitis B virus replication with lamivudine. J Med Virol, 2000, 61(3): 367−373.
[17]Seifer M, Hamatake RK, Colonno RJ, et al. In vitro inhibition of hepadnavirus polymerases by the triphosphates of BMS-200475 and lobucavir.Antimicrob Agents Chemother, 1998, 42(12):3200−3208.
[18]Doong SL, Tsai CH, Schinazi RF, et al. Inhibition of the replication of hepatitis B virus in vitro by 2',3'-dideoxy-3'-thiacytidine and related analogues.Proc Natl Acad Sci USA, 1991, 88(19):8495−8499.
[19]Fields BN, Knipe DM, Howley PM, et al. Fields virology. 3rd ed. Philadelphia: Lippincott-Raven Publisher, 1996: 2703−2737.
[20]Lai CL, Rosmawati M, Lao J, et al. Entecavir is superior to lamivudine in reducing hepatitis B virus DNA in patients with chronic hepatitis B infection.Gastroenterology, 2002, 123(6): 1831−1838.
[21]Shepherd J, Gospodarevskaya E, Frampton G, et al.Entecavir for the treatment of chronic hepatitis B infection. Health Technol Assess, 2009, 13(Suppl.3): 31−36.
[22]Hong JH, Choi Y, Chun BK, et al. Current status of anti-HBV chemotherapy. Arch Pharm Res, 1998,21(2): 89−105.
[23]Nagahata T, Araki K, Yamamura K, et al.Inhibition of intrahepatic hepatitis B virus replication by antiviral drugs in a novel transgenic mouse model. Antimicrob Agents Chemother,1992, 36(9): 2042−2045.
[24]Morrey JD, Bailey KW, Korba BE, et al.Utilization of transgenic mice replicating high levels of hepatitis B virus for antiviral evaluation of lamivudine. Antiviral Res, 1999, 42(2): 97−108.
[25]Julander JG, Sidwell RW, Morrey JD.Characterizing antiviral activity of adefovir dipivoxil in transgenic mice expressing hepatitis B virus. Antiviral Res, 2002, 55(1): 27−40.
[26]Julander JG, Colonno RJ, Sidwell RW, et al.Characterization of antiviral activity of entecavir in transgenic mice expressing hepatitis B virus.Antiviral Res, 2003, 59(3): 155−161.
