美洲型与欧洲型猪繁殖与呼吸综合征病毒Nsp7蛋白的截短表达和鉴定
2013-11-12邱鹏宁昆蔡林刘奇汪葆玥翟新验遇秀玲倪建强田克恭
邱鹏,宁昆,蔡林,刘奇,汪葆玥,翟新验,遇秀玲,倪建强,田克恭
中国动物疫病预防控制中心 OIE猪繁殖与呼吸综合征参考实验室/农业部兽医诊断中心,北京 100125
猪繁殖与呼吸综合征 (Porcine reproductive and respiratory syndrome,PRRS) 是由猪繁殖与呼吸综合征病毒 (Porcine reproductive and respiratory syndrome virus,PRRSV)引起的,以母猪繁殖障碍、早产、流产、死胎、木乃伊胎及仔猪呼吸综合征为特征的高度接触性传染病,是威胁全球养猪业的重要疫病[1-2]。PRRSV分离株根据抗原性和核酸序列上的差异[3-4],可以分为欧洲型 (EU)和美洲型 (NA)毒株,虽然两种毒株引起的临床症状相似,但抗原性差异较大,诊断技术和防控疫苗等均有不同,快速、准确的分型诊断技术是防控该病的重要基础[5]。
1995年,我国首次暴发PRRS,其病原为美洲型 PRRSV,随后该病蔓延至全国各地,成为影响我国养猪业的重要疫病[6]。2006年我国暴发了由美洲型 PRRSV变异毒株引起的高致病性PRRS,以高度接触性传播、全身出血、发病率高、死亡率高为主要临床特征,给我国养猪业造成了沉重打击[7-9]。近年来,欧洲型PRRSV在我国猪场的发生也屡有报道,学者们相继从浙江、福建、内蒙古和北京等地分离到多株欧洲型PRRSV[10-11]。美洲型和欧洲型PRRSV在我国猪群中的广泛流行预示我国急需建立可用于分型检测的诊断技术,以满足该病防控的需要。
美洲型和欧洲型PRRSV毒株基因组核苷酸序列同源性为 55%~80%,ORF1a编码的 Nsp7蛋白在型间免疫原性差异显著,可用于研制PRRSV的血清学分型诊断技术[12-14]。本研究通过体外基因重组表达技术,获得了缺失相似抗原表位的美洲型和欧洲型PRRSV Nsp7截短蛋白,为PRRSV感染的血清学分型检测技术的研制奠定了基础。
1 材料与方法
1.1 材料
1.1.1 载体、菌株、病毒、血清和细胞
表达载体pET-32a由本实验室保存;表达菌株 Transetta (DE3)购自北京全式金生物技术有限公司。美洲型PRRSV JXA1株 (EF112445)、欧洲型 PRRSV BJEU06-1株 (GU047344)以及美洲型和欧洲型PRRSV参考阳性血清、PRRSV阴性血清各 3份均由本实验室制备保存。Marc-145传代细胞和原代猪肺泡巨嗜细胞(PAM)由本实验室保存。
1.1.2 酶和主要试剂
AMV反转录酶、Rnase抑制剂、Go Taq DNA聚合酶均购自 Promega公司。限制性内切酶BamHⅠ、EcoRⅠ、Hind Ⅲ购自TaKaRa公司。RNA 提取试剂盒 (RNeasy® Mini Kit)购自QIAGEN 公司。胶回收试剂盒 (E.Z.N.A.® Gel Extraction Kit)、质粒回收试剂盒 (E.Z.N.A.®Plasmid Mini Kit)购自OMEGA公司。蛋白纯化试剂 (Ni-NTA His•Bind 树脂柱)为 Invitrogen 公司产品。IPTG、HRP标记兔抗猪IgG及其他化学试剂购自Sigma公司。
1.2 引物设计与合成
根据GenBank公布的PRRSV美洲型和欧洲型毒株基因组序列 (登录号分别为 EF112445和GU047344),利用Oligo 6软件设计PCR及融合PCR所用引物,用于扩增获得完整 Nsp7基因(NA-Nsp7和 EU-Nsp7)和相似抗原表位编码序列缺失的基因片段(NA-∆Nsp7 和 EU-∆Nsp7)。引物序列和PCR 扩增产物大小见表1。
1.3 病毒的增殖及基因组的提取
将已长成单层的Marc-145细胞和PAM细胞弃去生长液,按 1% (V/V)分别接种美洲型PRRSV JXA1株和欧洲型PRRSV BJEU06-1株,加入含2%牛血清的DMEM或RPMI 1640细胞培养液,37 ℃培养观察3~5 d,当70%以上细胞出现病变时收获,置-40 ℃下冻融2次,-70 ℃保存,备用。使用RNA提取试剂盒提取病毒基因组。
1.4 美洲型和欧洲型PRRSV Nsp7基因的克隆和表达
以提取的病毒基因组为模板进行 RT-PCR,扩增体系为:5×Buffer 5 µL,上游引物 1 µL,下游引物 1 µL,2.5 mmol/L dNTPs 2 µL,Go Taq酶1 µL,基因组RNA模板1 µL,AMV反转录酶 0.3 µL,RNase 抑制剂 0.2 µL,RNase free dH2O 13.5 µL。反应条件为:42 ℃ 45 min ;94 ℃5 min;94 ℃ 1 min ,52 ℃ 1 min,72 ℃ 2 min,34个循环;72 ℃ 1 0 min。PCR产物胶回收纯化后,经限制性内切酶消化,回收目的片段定向克隆于pET-32a表达载体中,转化Transetta (DE3)感受态细胞,经PCR鉴定筛选获得阳性菌落。

表1 基因克隆所用的引物和PCR预期产物大小Table 1 Primers used for gene cloning and expected PCR products
将阳性菌落接种到含卡那霉素 (50 mg/L)LB液体培养基中,37 ℃、200 r/min培养至OD600为0.6时加入IPTG至终浓度1 mmol/ L,诱导3 h,同时设诱导的空载体作对照,收集菌体采用超声波裂解处理 (200 W,间隔10 s,共超声作用30次),12 000 r/min离心20 min,分别收集上清液及沉淀进行SDS-PAGE。
1.5 表达产物的纯化和鉴定
表达菌体经超声波裂解后收集上清液,用Ni-NTA His•Bind树脂柱按说明书推荐的可溶性蛋白纯化方法纯化蛋白,用紫外分光光度计测定蛋白含量后进行 SDS-PAGE检测和 Western blotting鉴定。具体过程为:取纯化的重组蛋白经 SDS-PAGE后,电转移到 PVDF膜上,用0.01 mol/L PBS (pH 7.4)配制的3%脱脂乳封闭液 37 ℃作用 1 h,经 PBST (加入0.1% Tween 20的PBS)漂洗3次,每次3 min,之后加入1∶500稀释的PRRSV阳性血清,37 ℃作用1 h,用PBST同样方法漂洗3次,每次3 min,加入HRP酶标兔抗猪IgG 抗体 (1:30 000),37 ℃作用1 h,洗涤后加入底物 TMB与过氧化物酶溶液,显色15 min,蒸馏水终止反应。
1.6 美洲型和欧洲型PRRSV Nsp7的相似抗原表位分析
运用DNAstar软件,分析PRRSV Nsp7的抗原性 (Antigenicity)、Hopp-Woods亲水性(Hydrophilicity)、可接近性 (Accessibility)、主键活动性 (Flexibility)和抗原决定簇(Determinant),研究美洲型与欧洲型PRRSV Nsp7的相似抗原表位。
1.7 美洲型和欧洲型PRRSV Nsp7的截短表达和鉴定
以克隆获得的含欧洲型或美洲型Nsp7基因的pET-32a载体为模板,采用PCR分段扩增Nsp7基因片段,NA-Nsp7基因片段分别为103 bp (引物 NA-Nsp7F 和 NA-Nsp7R1)和 636 bp (引物NA-Nsp7F2和 NA-Nsp7R);EU-Nsp7基因片段分别为 103 bp (引物 EU-Nsp7F和 EU-Nsp7R3)和668 bp (引物EU-Nsp7F4和EU-Nsp7R)。回收上述片段,分别用 NA-Nsp7F/NA-Nsp7R和EU-Nsp7F/EU-Nsp7R进行融合PCR扩增,获得相似抗原表位编码序列缺失的基因片段 (缺失24~58aa的编码序列)。
回收目的片段定向克隆于pET-32a载体中,转化大肠杆菌,经 PCR鉴定获得阳性转化菌落。利用Ni-NTA His•Bind树脂柱纯化获得重组蛋白 NA-∆Nsp7和 EU-∆Nsp7,测定纯化蛋白含量,进行 SDS-PAGE检测和 Western blotting鉴定。
2 结果
2.1 美洲型和欧洲型PRRSV Nsp7基因的克隆和表达
以Marc-145细胞和PAM细胞培养的美洲型PRRSV JXA1株和欧洲型PRRSV BJEU06-1株为模板,扩增获得NA-Nsp7和EU-Nsp7编码基因,PCR产物进行1%琼脂糖凝胶电泳,紫外灯下可见794 bp和825 bp的目的条带 (图1),目的片段定向克隆于表达载体pET 32a中,诱导表达后经SDS-PAGE分析表明,NA-Nsp7和EU-Nsp7在大肠杆菌中均获得了高效表达,所表达的蛋白大小约为47 kDa,与预期大小相符,超声波处理后所表达蛋白主要集中在上清液中,蛋白为可溶性表达 (图2)。
2.2 表达产物的纯化和鉴定
将NA-Nsp7和EU-Nsp7表达菌株经诱导、收集、超声波裂解,之后收集上清液,用亲和层析法纯化,重组蛋白的浓度测定分别为0.8 mg/mL和1.5 mg/mL。取纯化产物 (上样量均为5 µL)进行SDS-PAGE检测,结果表明蛋白纯度高,无明显的非特异性条带 (图 3)。取重组NA-Nsp7 和 EU-Nsp7 各 2 µg、1 µg 分别与美洲型或欧洲型PRRSV阳性血清、阴性血清各3份进行Western blotting反应,结果均显示,纯化的NA-Nsp7和 EU-Nsp7分别与美洲型和欧洲型PRRSV阳性血清发生较强的特异性反应;同时,NA-Nsp7与欧洲型PRRSV阳性血清,EU-Nsp7与美洲型PRRSV阳性血清有微弱的免疫反应,所纯化的重组蛋白不能有效用于美洲型和欧洲型PRRSV血清抗体的分型检测 (图3),重组蛋白与阴性血清之间无特异性杂交条带 (数据未显示)。
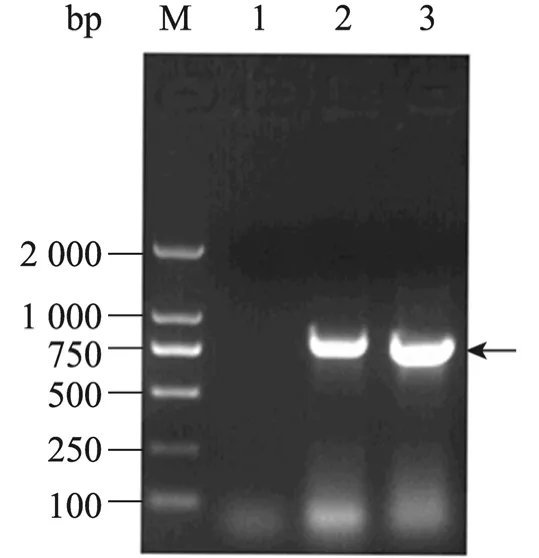
图1 NA-Nsp7和EU-Nsp7的RT-PCR扩增产物Fig. 1 RT-PCR products of NA-Nsp7 and EU-Nsp7.M: DL2000 DNA marker; 1: negative control; 2:EU-Nsp7; 3: NA-Nsp7.
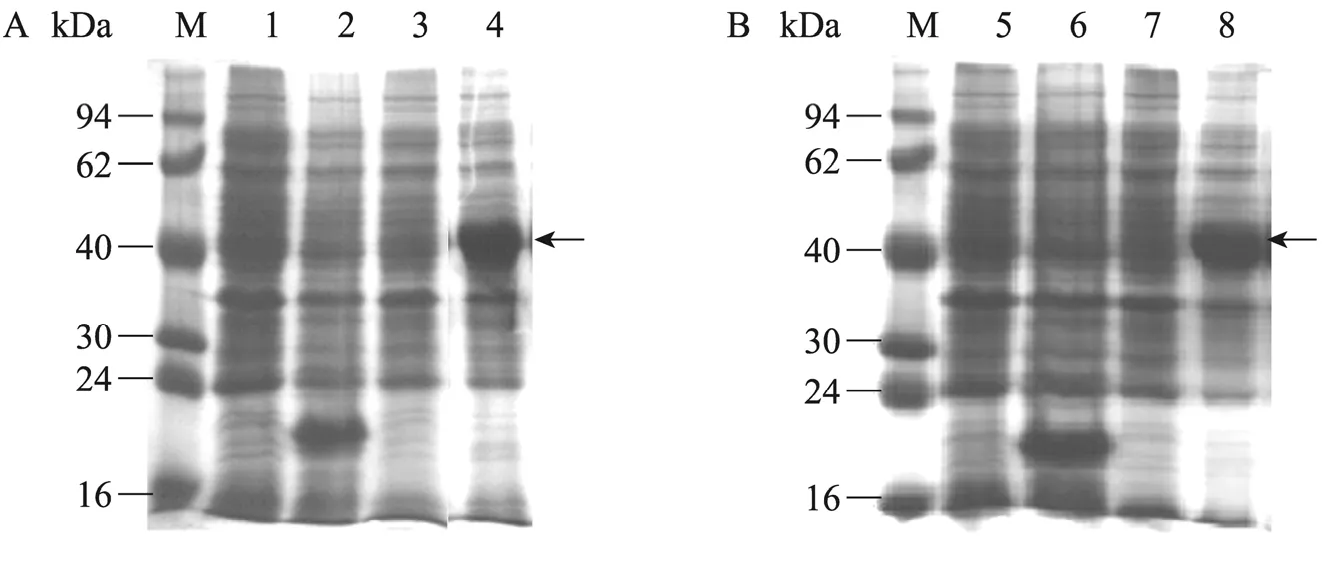
图2 NA-Nsp7和EU-Nsp7表达产物的SDS-PAGE电泳图谱Fig. 2 Over-expression of NA-Nsp7 and EU-Nsp7 in E. coli analyzed by SDS-PAGE. (A)Protein of pET 32a-NA-Nsp7. (B)Protein of pET 32a-EU-Nsp7. M: protein marker; 1, 5: un-induced control; 2, 6: pET 32a vector control;3: sediment protein of pET 32a-NA-Nsp7 after inducing; 4: soluble protein of pET 32a-NA-Nsp7 after inducing; 7:sediment protein of pET 32a-EU-Nsp7 after inducing; 8: soluble protein of pET 32a-EU-Nsp7 after inducing.

图3 纯化NA-Nsp7和EU-Nsp7的SDS-PAGE和Western blotting鉴定结果Fig. 3 Identification of purified NA-Nsp7 and EU-Nsp7 by SDS-PAGE and Western blotting. (A)SDS-PAGE of purified NA-Nsp7and EU-Nsp7 expressed in E. coli. (B−E)Western blotting of NA-Nsp7and EU-Nsp7protein expressed in E. coli interacting with antibodies against NA-PRRSV or EU-PRRSV. M: protein marker; 1: NA-Nsp7 protein; 2: EU-Nsp7 protein; 3−4: NA-Nsp7 interacting with antibodies against NA-PRRSV (2 µg and 1 µg loading respectively); 5−6: NA-Nsp7 protein interacting with antibodies against EU-PRRSV (2 µg and 1 µg loading respectively); 7−8: EU-Nsp7 protein interacting with antibodies against EU-PRRSV (2 µg and 1 µg loading respectively); 9−10: EU-Nsp7 interacting with antibodies against NA-PRRSV (2 µg and 1 µg loading respectively).
2.3 美洲型和欧洲型PRRSV Nsp7相似抗原表位的分析
经 DNAstar软件分析,预测 NA-Nsp7和EU-Nsp7分别包含有10个和11个抗原表位,其中 NA-Nsp7的第 1个和第 2个表位分别与EU-Nsp7的第2个和第3个表位在氨基酸序列、疏水图谱上较为相似 (24~58aa),推测是抗原抗体交叉免疫反应的主要表位 (表2)。
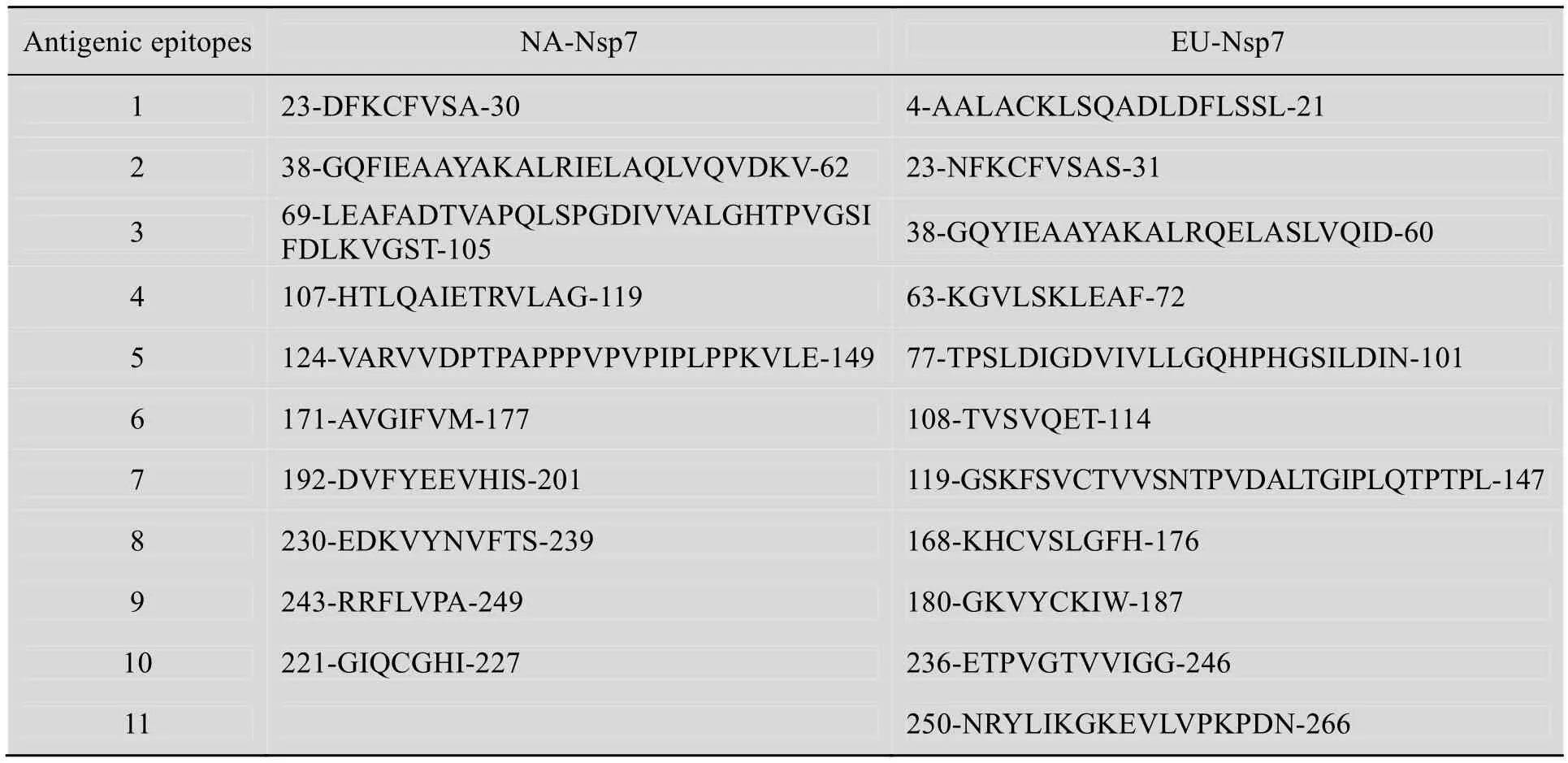
表2 美洲型和欧洲型PRRSV Nsp7的抗原表位预测Table 2 Prediction of antigenic epitopes of Nsp7 of NA and EU-PRRSV
2.4 美洲型和欧洲型PRRSV Nsp7的截短表达和鉴定
缺失相似抗原表位 (24~58aa)的编码序列,美洲型和欧洲型PRRSV Nsp7的基因片段大小分别为672 bp和702 bp (图4)。将目的片段定向克隆于pET-32a载体中,转化大肠杆菌,经表达和纯化获得重组蛋白 NA-∆Nsp7和 EU-∆Nsp7,重组蛋白浓度分别为 1.3 mg/mL和 1.0 mg/mL。SDS-PAGE检测 (上样量均为5 µL)表明蛋白纯度高,无明显的非特异性条带 (图5)。取重组蛋白 NA-∆Nsp7 和 EU-∆Nsp7 各 4 µg、2 µg、1 µg分别与美洲型或欧洲型PRRSV阳性血清、阴性血清各3份进行Western blotting反应,结果均显示,纯化蛋白NA-∆Nsp7和EU-∆Nsp7分别与美洲型和欧洲型PRRSV阳性血清发生较强的特异性反应;蛋白NA-∆Nsp7与欧洲型PRRSV阳性血清,蛋白EU-∆Nsp7与美洲型PRRSV阳性血清无交叉免疫反应 (图5),且重组蛋白与阴性血清之间无特异性杂交条带 (数据未显示),所纯化的重组蛋白可用于美洲型和欧洲型PRRSV血清抗体的分型检测。
图4 NA-∆Nsp7和EU-∆Nsp7基因片段的融合PCR扩增产物Fig. 4 Fusion PCR products of NA-∆Nsp7 and EU-∆Nsp7. M: DL2000 DNA marker; 1: negative control; 2: EU-∆Nsp7; 3: NA-∆Nsp7.
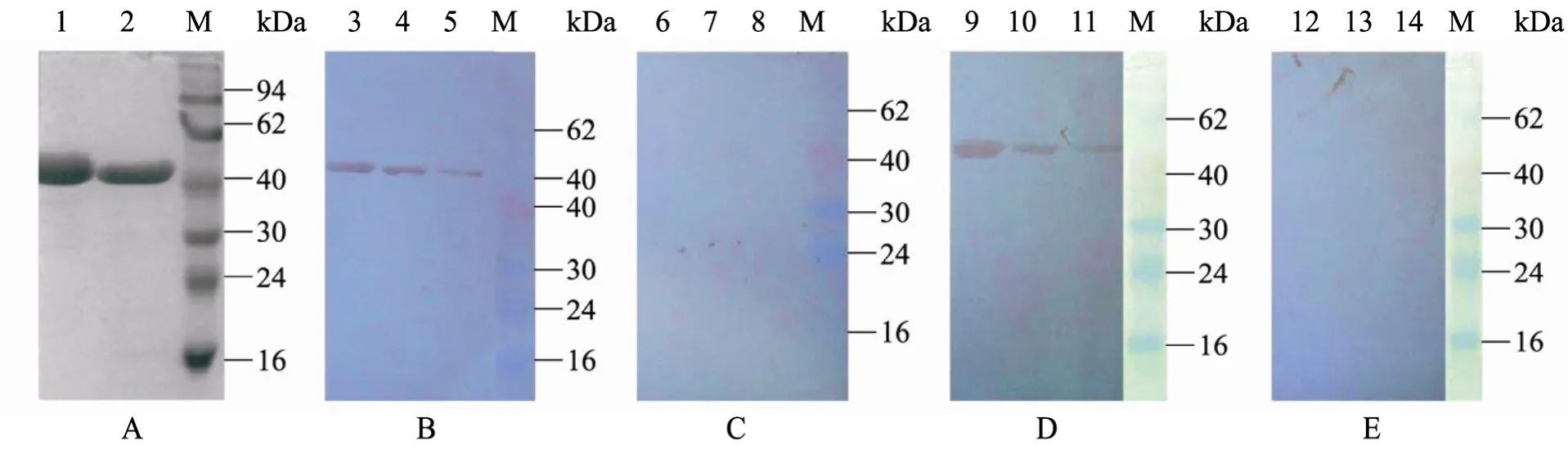
图5 纯化NA-∆Nsp7和EU-∆Nsp7的SDS-PAGE和Western blotting鉴定Fig. 5 Analysis and identification of NA-∆Nsp7 and EU-∆Nsp7 by SDS-PAGE and Western blotting. (A)SDS-PAGE of purified NA-∆Nsp7 and EU-∆Nsp7 protein expressed in E. coli. (B−E)Western blotting of NA-∆Nsp7 and EU-∆Nsp7 protein expressed in E. coli, interacting with antibodies against NA-PRRSV or EU-PRRSV. M: protein marker; 1: NA-∆Nsp7 protein; 2: EU-∆Nsp7 protein; 3−5: NA-∆Nsp7 interacting with antibodies against NA-PRRSV(4 µg, 2 µg and 1 µg loading respectively); 6−8: NA-∆Nsp7 protein interacting with antibodies against EU-PRRSV(4 µg, 2 µg and 1 µg loading respectively); 9−11: EU-∆Nsp7 protein interacting with antibodies against EU-PRRSV(4 µg, 2 µg and 1 µg loading respectively); 12−14: EU-∆Nsp7 interacting with antibodies against NA-PRRSV (4 µg,2 µg and 1 µg loading respectively).
3 讨论
猪繁殖与呼吸综合征病毒基因组为单股正链不分节段RNA分子,约15 kb,含有9个开放阅读框架,依次为5¢-NCR-ORF1a/1b-ORF2-GP3-GP4-GP5-M-N-NCR-3¢[15-16]。ORFla 编码的寡聚蛋白pp1a经加工后合成9个非结构蛋白,依次为 Nsp1α、Nsplβ、Nsp2~8[17]。其中,Nsp7 的氨基酸序列在型内保守,同源性约90%,型间差异较大,同源性约50%[18-20]。同时,Nsp7具有较强的免疫原性,是PRRSV的血清学分型诊断技术研制的理想靶蛋白[21-23]。
国外研究学者通过体外重组表达全长的Nsp7蛋白,尝试建立了美洲型和欧洲型PRRSV抗体分型检测技术,但尚无临床使用效果的评价[24-27]。本研究最初同样选择全长Nsp7编码基因进行了原核表达、纯化和免疫印迹鉴定,结果表明,虽然重组Nsp7蛋白与同型的血清抗体具有较强的反应活性,但与不同型的抗体也呈微弱的交叉免疫反应,预示两种蛋白存在有交叉抗原表位,难以实现两种抗体的分型检测。
生物学软件分析Nsp7氨基酸序列,并对预测的抗原表位比对分析,表明 NA-Nsp7和EU-Nsp7两种蛋白之间存在有两个相似抗原表位。通过融合PCR,将相似抗原表位的编码序列缺失后,利用原核表达系统表达和纯化,获得截短蛋白 NA-∆Nsp7 和 EU-∆Nsp7。NA-∆Nsp7 和EU-∆Nsp7分别与美洲型和欧洲型 PRRSV阳性血清有较强的特异性反应,且无交叉免疫反应,表明缺失相似抗原表位后不仅不会影响重组蛋白的免疫反应性,而且显著提高了反应的特异性。在本研究中,重组蛋白 NA-∆Nsp7和EU-∆Nsp7两种截短蛋白在大肠杆菌中均获得了可溶性高效表达,蛋白易于纯化,免疫反应性强,适合大规模制备,为进一步开发美洲型和欧洲型PRRSV分型诊断试剂奠定了基础,对我国PRRS的防控具有重要意义。
[1]Goyal SM. Porcine reproductive and respiratory syndrome. J Vet Diagn Invest, 1993, 5(4):656−664.
[2]Baron T, Albina E, Leforban Y, et al. Report on the first outbreaks of the porcine reproductive and respiratory syndrome (PRRS)in France. Diagnosis and viral isolation. Ann Recb, 1992, 23: 161−166.
[3]Allende R, Lewis TL, Lu Z, et al. North American and European porcine reproductive and respiratory syndrome virus differ in nonstructural protein coding regions. J Gen Virol, 1999, 80: 307−315.
[4]Meulenberg JJ, Petersen-den Besten A, de Kluyver EP, et al. Characterization of structural proteins of Lelystad virus. Adv Exp Med Biol, 1995, 380:271−276.
[5]Murtaugh MP, Xiao Z, Zuckermann F.Immunological responses of swine to porcine reproductive and respiratory syndrome virus infection. Viral Immunol , 2002, 15(4): 533−547.
[6]Guo BQ, Chen ZW, Liu WX, et al. Aborted fetuses suspected of PRRS separation PRRSV. Chin J Prev Vet Med, 1996, 2: 1−5 (in Chinese).郭宝清, 陈章水, 刘文兴, 等. 从疑似PRRS流产胎儿分离 PRRSV的研究. 中国畜禽传染病,1996, 2: 1−5.
[7]Tian K, Yu X, Zhao T, et al. Emergence of fatal PRRSV variants: unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark. PLoS ONE, 2007, 2(6): e526.
[8]Li Y, Wang X, Bo K, et al. Emergence of a highly pathogenic porcine reproductive and respiratory syndrome virus in the Mid-Eastern region of China.Vet J, 2007, 174(3): 577−584.
[9]Tong GZ, Zhou YJ, Hao XF, et al. Highly pathogenic porcine reproductive and respiratory syndrome, China. Emerg Infect Dis, 2007, 13(9):1434−1436.
[10]Chen N, Cao Z, Yu X, et al. Emergence of novel European genotype porcine reproductive and respiratory syndrome virus in mainland China. J Gen Virol, 2011, 92(Pt 4): 880−892.
[11]Huang MQ. European Porcine reproductive and respiratory syndrome virus FJ0602 Isolation ORF7 sequence analysis. Chin J Prev Vet Med, 2008,30(3): 174−178 (in Chinese).黄梅清. 猪繁殖与呼吸综合征病毒欧洲型FJ0602株的分离及其ORF7的序列分析. 中国预防兽医学报, 2008, 30(3): 174−178.
[12]Egli C, Thür B, Liu L, et al. Quantitative TaqMan RT-PCR for the detection and differentiation of European and North American strains of porcine reproductive and respiratory syndrome virus. J Virol Methods, 2001, 98(1): 63−75.
[13]Oleksiewicz MB, Bftner A, Madsen KG, et al.Sensitive detection and typing of porcine reproductive and respiratory syndrome virus by RT-PCR amplification of whole viral genes. Vet Microbiol, 1998, 64(1): 7−22.
[14]Nelson EA, Christopher-Hennings J, Drew T, et al.Differentiation of United states and European isolates of porcine reproductive and respiratory syndrome virus by monoclonal antibodies. J Clin Microbiol, 1993, 31: 3184−3189.
[15]Yuan S, Mickelson D, Murtaugh MP, et al.Complete genome comparison of porcine reproductive and respiratory syndrome virus parental and attenuated strains. Virus Res, 2001, 79(1/2): 189−200.
[16]Brown E, Lawson S, Welbon C, et al. Antibody response to porcine reproductive and respiratory syndrome virus (PRRSV)nonstructural proteins and implications for diagnostic detection and differentiation of PRRSV types I and II. Clin Vaccine Immunol, 2009, 16(5): 628−635.
[17]Mardassi MD. Identification of major differences in the nucleocapsid protein genes of a Quebec strain and European strains of Porcine reproductive and respiratory syndrome virus. J Gen Virol, 1994, 75:681−683.
[18]Dea S, Gagnon CA, Mardassi H, et al. Current knowledge on the structural Proteins of Porcine reproductive and respiratory syndrome(PRRS)virus: comparison of the North American and European isolate. Arch Virol, 2000, 145: 659−688.
[19]Gao ZQ, Guo X, Yang HC. Genomic characterization of two Chinese isolates of porcine respiratory and reproductive syndrome virus. Arch Virol, 2004, 149(7): 1341−1351.
[20]Hanada K, Suzuki Y, Nakane T, et al. The origin and evolution of Porcine reproductive and respiratory syndrome viruses. Mol Biol Evol, 2005,22(4): 1024−1031
[21]De Lima M, Pattnaik AK, Flores EF, et al.Serologic marker candidates identified among B-cell linear epitopes of Nsp2 and structural proteins of a North American strain of porcine reproductive and respiratory syndrome virus.Virology, 2006, 353 (2): 410−421.
[22]Johnson CR, Yu W, Murtaugh MP. Cross-reactive antibody responses to nsp1 and nsp2 of Porcine reproductive and respiratory syndrome virus. J Gen Virol, 2007, 88(Pt 4): 1184−1195.
[23]Oleksiewicz MB, Botner A, Toft P, et al. Epitope mapping porcine reproductive and respiratory syndrome virus by phage display: the nsp2 fragment of the replicase polyprotein contains a cluster of B-cell epitopes. J Virol, 2007, 75(7):3277−3290.
[24]Chung HK, Choi C, Kim J, et al. Detection and differentiation of North American and European genotypes of porcine reproductive and respiratory syndrome virus in formalin-fixed, paraffin-embedded tissues by multiplex reverse transcription-nested polymerase chain reaction. J Vet Diagn Invest,2002, 14(1): 56−60.
[25]Dea S, Wilson L, Therrien D, et al. Competitive ELISA for detection of antibodies to porcine reproductive and respiratory syndrome virus using recombinant E. coli-expressed nucleocapsid protein as antigen. J Virol Meth, 2000, 87: 109−122.
[26]Joo HS, Park BK, Dee SA, et al. Indirect fluorescent IgM antibody response of pigs infected with porcine reproductive and respiratory syndrome syndrome virus. Vet Microbiol 1997, 55(1/4):303−307.
[27]Larochelle MR. Differentiation of North American and European porcine reproductive and respiratory syndrome virus genotypes by in situ hybridization.J Virol Methods, 1997, 68(2): 161−168.
