保守的第52位色氨酸突变引起的胰高血糖素样肽1受体N端片段活性丧失
2013-11-12高蔚丰王娟
高蔚丰,王娟
宁夏大学生命科学学院,宁夏 银川 750021
胰高血糖素样肽 1受体 (Glucogan-like peptide 1 receptor,GLP-1R)是 Drucher等于1987年在大鼠胰岛瘤细胞RIN1046-38中发现,属于G蛋白耦联受体B家族中的胰高血糖素样受体亚家族[1]。该亚家族最明显的特征是具有相对较长的胞外N端序列,通过3对二硫键形成一个球状结构域,该区域在配体结合过程中起着关键作用[1-2]。胰高血糖素样肽 1受体 N端片段(nGLP-1R)中形成3对二硫键的6个半胱氨酸是高度保守的。Aruna Bazarsuren等发现,3对二硫键分别是由 C46与 C71、C62与 C104、以及 C85与C126形成[3]。还有文献报道,nGLP-1R的6个色氨酸中,W72和 W110在 G蛋白耦联受体家族中是高度保守的[4],将 W39、W72、W91、W110、W120分别突变为丙氨酸 (A)后,这些突变体都失去了与GLP-1结合的能力。但相反的是,将受体上的 W87突变为丙氨酸后,该突变体具有和野生型相同的亲和能力,其介导的信号转导也很相似[5-6]。
肠促胰岛素类似物 (Exendin-4)的结构与功能与胰高血糖素样肽1 (Glucogan-like peptide 1,GLP-1)相似[7-12](与GLP-1有53%的氨基酸序列一致性),都是通过其中心域和 C末端与GLP-1R上的N末端域之间的相互作用实现其与GLP-1R的结合[13-14]。GLP-1与胰岛素分泌和糖代谢调节密切相关[15],对 GLP-1R结构和信号传导机制的研究有助于了解其在糖尿病病理进程中的作用,可望为糖尿病的治疗提供新的方向[16-21]。目前,很多研究集中在配体[22-24]及受体片段与 GLP-1结合位点的研究[25]及受体胞内跨膜结构的研究上[26]。Exendin-4与nGLP-1R的结合能力比GLP-1更强[13],其结合位点存在差异。考虑到对nGLP-1R与Exendin-4的结合位点的不可知性,采用易错PCR (Error-prone PCR, epPCR)方法建立了一个鼠肺的不同长度nGLP-1R (从受体N端的第21个氨基酸开始到第145个氨基酸)的噬菌体随机突变展示肽库,然后利用Exendin-4筛选,以此来判断是否某一段基因或两段基因的缺失会影响到nGLP-1R与Exendin-4结合的活性。
1 材料与方法
1.1 材料
菌株大肠杆菌E. coli XL1-Blue、辅助噬菌体VSCM13和噬菌粒 Pfuse5为西部特色生物资源保护与利用教育部重点实验室保存;质粒pET-28a(+)-GLP-1R为华东理工大学生物反应器工程国家重点实验室自行构建;Exendin-4为华东理工大学生物反应器工程国家重点实验室自行纯化。pMD-18T载体试剂盒购自TaKaRa公司;小鼠抗 M13噬菌体酶联单抗 Anti-M13-HRP monoclonal conjugate购自Amersham Pharmacia公司;限制性内切酶和T4 DNA连接酶为 MBI公司产品;TMB显色底物购自天根公司;胰化蛋白胨和酵母提取物购自OXOID公司;其他试剂均为国产或进口的分析纯。
1.2 构建 nGLP-1R的不同长度的易错 PCR突变库
考虑到对nGLP-1R与Exendin-4的结合位点的不可知性,我们在以前工作的基础上[27]根据nGLP-1R的基因序列设计了 2对引物,primer 11f-SfiⅠ从基因序列的第30个碱基开始,primer 21f-SfiⅠ从基因序列的第60个碱基开始,primer 11r-SfiⅠ则是到基因序列的第345位截止,primer 21r-SfiⅠ则是到基因序列的第 315位截止 (引物序列如表1所示)。以此来判断是否某一段基因或两段基因的缺失会影响到nGLP-1R与Exendin-4结合的活性。以pET-28a(+)-GLP-1R为模板,用引物 primer 1f-SfiⅠ作为上游引物,primer 1r-SfiⅠ、primer 11r-SfiⅠ、primer 21r-SfiⅠ分别作为下游引物;primer 11f-SfiⅠ作为上游引物,primer 1r-SfiⅠ、primer 11r-SfiⅠ、primer 21r-SfiⅠ分别作为下游引物;primer 21f-SfiⅠ作为上游引物,primer 1r-SfiⅠ、primer 11r-SfiⅠ、primer 21r-SfiⅠ分别作为下游引物,通过两轮易错PCR扩增9段长度不同的片段。
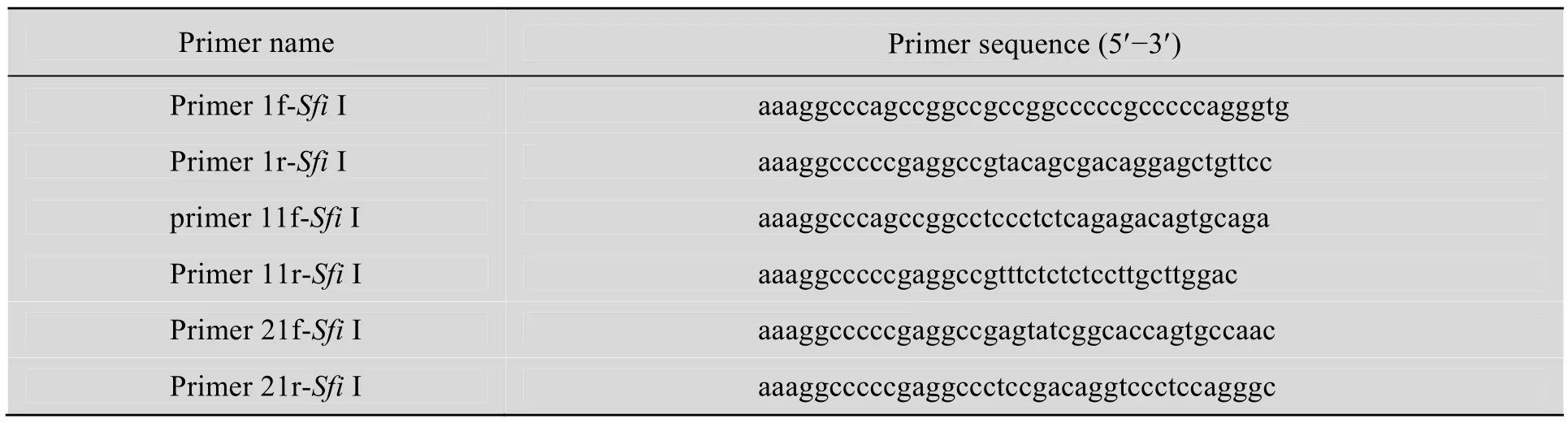
表1 本研究中所用引物Table 1 Primers used in this study
1.3 GLP-1受体N端片段噬菌体突变库的扩增、富集和滴度测定
噬菌体的扩增、富集及滴度测定参考文献[28]进行。以固定于 96孔板孔中的 50 μg/mL的Exendin-4对nGLP-1R的随机突变库进行了3轮亲和筛选。
1.4 单克隆噬菌体的制备
从富集过程中用于计数的平板上随机挑取20个单菌落,分别接种于10 mL SB (30 g/L 胰化蛋白胨,20 g/L 酵母提取物,10 g/L MOPS,40 μg/mL四环素,100 μg/mL氨苄青霉素,pH 7.0)中进行扩增,将扩增后的噬菌体滴度调至1.0×1012PFU/mL。
1.5 噬菌体的ELISA检测
在 96孔板的每孔中加入 50 μL Exendin-4(50 μg/mL),4 ℃包被过夜;清洗后,加入含脱脂奶粉的 TBST溶液 (50 mol/L Tris,150 mmol/L NaCl,40 g/L脱脂奶粉,pH 7.5),37 ℃封闭1 h后双蒸水洗5次;加入50 μL单克隆噬菌体上清 (1.0×1012PFU/mL),37 ℃孵育2 h,充分洗涤;加入用含40 g/L脱脂奶粉的TBST按1∶1 000的比例稀释的小鼠抗M13噬菌体酶联单抗50 μL,37 ℃反应1 h,充分洗涤;TMB显色15 min后,以2 mol/L H2SO4终止反应,测OD455值。
2 结果与分析
2.1 nGLP-1R的不同长度突变体库的构建
通过两轮易错PCR扩增9段长度不同的片段 (图 1),构建 nGLP-1R随机突变体库,经平板计数测得的库容量约为 9.6×107。对随机挑选的30个突变体的测序结果表明,11个产生了移码突变,5个存在颠换 (AT-TA),而每个突变体中至少有 2个碱基发生了突变,最多的则有 13个碱基产生了突变,这与文献中报道的突变率大于2%的突变率范围是相符合的[29]。
2.2 nGLP-1R突变库的亲和筛选
从对nGLP-1R的随机突变库的亲和筛选结果(表2)看,第1轮筛选的产率大于(1.0×10−7)%,表明筛选过程中筛选方法、菌的生长状态、感染过程或溶液均符合要求。随着淘洗的进行,产率逐渐升高,说明具有特异性结合能力的噬菌体通过筛选得到了较好的富集。
2.3 nGLP-1R突变体结合Exendin-4活性的鉴定
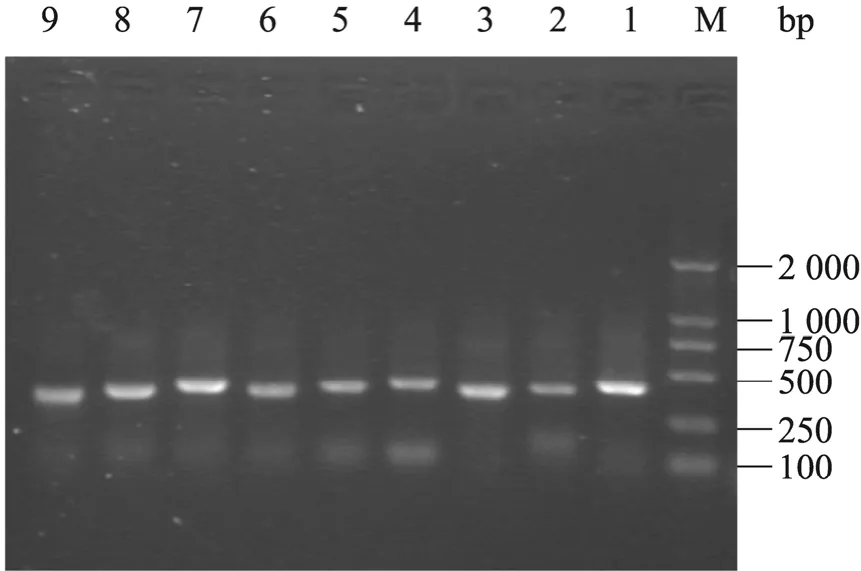
图1 九段长度不同的nGLP-1R片段的PCR扩增结果Fig. 1 PCR products of nine nGLP-1R gene segments with different length. M: DNA marker; 1: 345 bp; 2:315 bp; 3: 285 bp; 4: 315 bp; 5: 285 bp; 6: 255 bp; 7:375 bp; 8: 345 bp; 9: 315 bp.

表2 nGLP-1R噬菌体随机突变肽库的筛选Table 2 Enrichment of nGLP-1R phage randomly mutated library by biopanning
从生物富集时用于计数的平板上随机挑选了30个单菌落,用ELISA法测定了噬菌体上清与Exendin-4的结合活性。结果显示,大部分噬菌体都具有一定的与Exendin-4结合的活性。但其中有一株 EP16与野生型 nGLP-1R (wt nGLP-1R)相比没有活性,通过测序发现,EP16长度为95个氨基酸,缺失了前面的20个和后面的10个氨基酸,并且第52位色氨酸突变为了精氨酸。为了更好地确定EP16与Exendin-4无结合活性,使用引物primer 21f-SfiⅠ和primer 11r-SfiⅠ构建了野生型EP16 (wtEP16),使用重叠PCR法构建第 52位色氨酸突变为精氨酸的全长nGLP-1R (nGLP-1RW52R),以质粒 pET-28a(+)-GLP-1R为模板,以primer 1f-SfiⅠ为上游引物,E52 reverse (5¢-catctggccagcaggcgtagtca-3¢)为下游引物扩增出 nGLP-1R的前半段基因序列;以引物 E52 forward (5¢-tgactacgcctgctggccagat-3¢)为上游引物,primer 1r-SfiⅠ为下游引物扩增出nGLP-1R的后半段基因序列;以这两段基因序列为模板,primer 1f-SfiⅠ和 primer 1r-SfiⅠ为引物,通过重叠延伸PCR法,改变wtnGLP-1R中的第52位氨基酸序列。以辅助噬菌体VSCM13作为阴性对照,利用3次独立的ELISA试验对其结合活性进行验证 (表3)。结果显示,wtEP16结合 Exendin-4的活性与 wtnGLP-1R相当,nGLP-1RW52R没有结合Exendin-4的活性。
2.4 EP16突变体氨基酸序列分析
对筛选得到的EP16突变体的氨基酸序列分析 (图2)显示,EP16中有1个氨基酸发生突变:第52位色氨酸 (W)突变为精氨酸 (R),且缺失了前20个和后10个氨基酸。
由于EP16既有缺失又有突变,所以在无法确定其活性的丧失是由于突变造成还是由于缺失部分氨基酸造成的情况下,构建了wtEP16及nGLP-1RW52R来进行对比。结果发现 wtEP16是有结合 Exendin-4活性的,nGLP-1RW52R没有结合Exendin-4的活性 (表3)。由此说明,突变体EP16无活性是由于其第52位色氨酸突变为精氨酸而引起的。EP16失去结合Exendin-4的活性可能是由于以下原因:1)色氨酸是非极性氨基酸,在突变为极性带正电的精氨酸后,可能会对nGLP-1R的整个肽链的极性产生影响,从而影响到受体的折叠构象使得受体与配体Exendin-4间的交联反应发生变化。2)色氨酸是杂环族氨基酸,其环上带有咪唑环,而精氨酸是脂肪族氨基酸。根据文献报道,W39突变为丙氨酸(A)后,nGLP-1R失去了结合 GLP-1的能力[5]。由此可以推断,氨基酸残基上有无咪唑基团可能也会在很大程度上影响整个肽链结合 Exendin-4的活性。
由于Exendin-4与N端片段的结合活性要比GLP-1与N端片段的结合活性强,那么可以猜测其结合位点也是有所差别的,在wtEP16中,W39的缺失没有影响exendin-4与受体N端片段的结合。但 EP16则由于其第 52位 (文献[6]中的第72位氨基酸)氨基酸由W突变成了R而丧失了活性,那么可以推测,对于nGLP-1R来说,其与GLP-1的结合需要除W87外5个W的参与,但在nGLP-1R与Exendin-4作用时,W39的存在与否并不会影响到nGLP-1R与Exendin-4的结合,而W72(在本文中为第52位氨基酸)的突变则会影响到它们的结合。这个结果显示,W72对受体N端片段与Exendin-4的结合的影响要大于W39。

表3 ELISA方法检测噬菌体突变体EP16和野生型EP16结合Exendin-4的活性Table 3 Binding activity of the mutant EP16 and wtEP16 to Exendin-4 analyzed by ELISA

图2 突变体EP16、野生型EP16、nGLP-1RW52R与野生型nGLP-1R的氨基酸序列的比较Fig. 2 Comparison of amino acid sequence between mutant EP16, wtEP16, nGLP-1RW52R and wtnGLP-1R.
3 结论
胰高血糖素样肽1受体N端片段在缺失了前20个和后10个氨基酸仍具有生物学活性,但第52位保守氨基酸色氨酸的突变引起了活性的丧失。因此证明了氨基酸残基的极性改变及有无咪唑基因都有可能会影响整个肽链结合 Exendin-4的活性。而关键位点单个氨基酸残基的突变可以改变 nGLP-1R整个蛋白质的生物学活性。GLP-1R因在胰岛素分泌和血糖调节方面有重要作用,基于对GLP-1R结构功能及其信号传导通路的认识,建立相应的药物筛选模型,寻找非肽类GLP-1R小分子激动剂,具有良好的科学价值和潜在的市场前景。本研究所建立的 nGLP-1R噬菌体随机突变体库能够很好地应用于受体-配体的结合研究,稍加改造即可成为一个高能量筛选非肽类GLP-1R小分子激动剂的方法。
[1]Thorens B. Expression cloning of the pancreatic beta cell receptor for the gluco-incretin hormone glucagons-like peptide 1. Proc Natl Acad Sci USA,1992, 89(8): 8641−8645.
[2]Tibaduiza EC,Chen C, Beinborn M. A small molecule ligand of the glucagons-like peptide 1 receptor targets its amino-terminal hormone binding domain. J Biol Chem, 2001, 276(41):37787−37793.
[3]Vilardaga JP, De Neef P, Di Paolo E, et al.Properties of chimeric secretin and VIP receptor proteins indicate the importance of the N-terminal domain for ligand discrimination. Biochem Biophys Res Commun, 1995, 211: 885−891.
[4]Couvineau A, Gaudin P, Maoret JJ, et al. Highly conserved aspartate 68, tryptophan 73 and glycine 109 in the N-terminal extracellular domain of the human VIP receptor are essential for its ability to bind VIP. Biochem Biophy Res Commun, 1995,206: 246−252.
[5]B Van Eyll, Göke B, Wilmen A, et al. Exchange of W39 by A within the N-terninal extrcellular domain of the GLP-1 receptor results in a loss of receptor function. Peptides, 1996, 17: 565−570.
[6]Wilmen A, B Van Eyll, Göke B, et al. Five out of six tryptophan residues in the N-terminal extracellular domain of the rat GLP-1 receptor are essential for its ability to bind GLP-1. Peptides,1997, 18(2): 301−305.
[7]Neidigh JW, Fesinmeyer RM, Prickett KS, et al.Exendin-4 and glucagon-like-peptide-1: NMR structural comparisons in the solution and micelle-associated states. Biochemistry, 2001,40(44): 13188−13200.
[8]Parkes D, Jodka C, Smith PN, et al.Pharmacokinetic actions of exendin-4 in the rat:comparison with glucagon-like peptide-1. Drug Dev Res, 2001, 53: 260−267.
[9]Idris I, Patiag D, Gray S, Donnelly R. Exendin-4 increase insulin sensitivity via a PI-3-kinasedependent mechanism:contrasting effects of GLP-1.Biochem Pharmacol, 2002, 63(5): 993−996.
[10]Edwards CM, Stanley SA, Davis R, et al.Exendin-4 reduces fasting and postprandial glucose and decreases energy intake in healthy volunteers.Am J Physiol Endocrinol Metab, 2001, 281(1):E155−E161.
[11]Szayna M, Doyle ME, Betkey JA, et al. Exendin-4 decelerates food intake, weight gain, and fat deposition in Zucker rats. Endocrinology, 2000,141(6): 1936−1941.
[12]Neidigh JW, Fesinmeyer RM, Prickett KS, et al.Exendin-4 and glucagon-like-peptide-1:NMR structural comparisons in the solution and micelle-associated states. Biochemistry, 2001, 40(44): 13188−13200.
[13]Doyle ME, Theodorakis MJ, Holloway HW, et al.The importance of the nine-amino acid C-terminal sequence of exendin-4 for binding to the GLP-1 receptor and for biological activity. Regul Pept,2003, 114(2/3): 153−158.
[14]Lopez de Maturana R, Willshaw A, Kuntzsch A, et al. The isolated N-terminal domain of the glucagon-like peptide-1 (GLP-1)receptor binds exendin peptides with much higher affinity than GLP-1. J Biol Chem, 2003, 278(12): 10195−10200.
[15]Suleiman Al-Sabah, Dan Donnelly. The positive charge at Lys-288 of the glucagons-like peptide-1(GLP-1)receptor is important for binding the N-terminus of peptide agonists. FEBS Lett,2003, 553: 342−346.
[16]Zander M, Madsbad S, Madsen JL, et al. Effect of 6-week course of glucagons-like peptide 1 on glycaemic control, insulin sensitivity, and beta-cell function in type 2 diabetes: a parallel-group study.Lanct, 2002, 359: 824−830.
[17]Moller DE. New drug targets for type 2 diabetes and the metabolic syndrome. Nature, 2001, 414:821−827.
[18]Kieffer TJ, Habener JF. The Glucagon-like peptides. Endocr Rev, 1999, 20(6): 876−913.
[19]Nauck MA, Kleine N, Orskov C, et al.Normalization of fasting hyperglycaemia by exogenous glucagon-like peptide 1 (7-36 amide)in type 2 (non-insulin-dependent)diabetic patients.Diabetologia, 1993, 36(8): 741−744.
[20]Gutniak M, Orskov C, Holst JJ, et al.Antidiabetogenic effect of glucagon-like peptide-1(7-36)amide in normal subjects and patients with diabetes mellitus. N Engl J Med, 1992, 326(20):1316−1322.
[21]Meneilly GS, McIntosh CH, Pederson RA, et al.Effect of glucagon-like peptide 1 on non-insulinmediated glucose uptake in the elderly patient with diabetes. Diabetes Care, 2001, 24(11): 1951−1956.
[22]Meier JJ, Nauck MA, Kranz D, et al. Secretion,degradation, and elimination of glucagon-like peptide 1 and gastric inhibitory polypeptide in patients with chronic renal insufficiency and healthy control subjects. Diabetes, 2004, 53(3):654−662.
[23]Runge S, Wulff BS, Madsen H, et al. Different domains of the glucagons and glucagons-like peptide-1 receptors provide the critical determinants of ligand selectivity. Br J Pharmacol,2003, 138: 787−794.
[24]Chicchi GG, Cascieri MA, Graziano MP, et al.Fluorescein-Trp25-Exendin-4, a biologically active fluorescent probe for the human GLP-1 receptor.Peptides, 1997, 18(2): 319−321.
[25]López de Maturana R, Donnelly D. The glucagons like peptide-1 receptor binding site for the N-terminus of GLP-1 requires polarity at Asp198 rather than negative charge. FEBS Lett, 2002, 350:244−248.
[26]Mattias Hällbrink, Tomas Holmqvist, Magnus Olsson, et al. Different domains in the third intracellular loop of the GLP-1 receptor are responsible for Gαsand Gαi/Gαoactivation.Biochim Biophys Acta, 2001, 1546: 79−86.
[27]Gao WF, Liu MY, Ma YS. Analysis of the binding site of the N-terminal fragment of glucogan-Like peptide-1 receptor to exendin-4. J East China Univ Sci Technol, 2008, 34(1): 66−70 (in Chinese).高蔚丰, 刘美云, 马昱澍. 胰高血糖素样肽 1受体N端片段与Exendin-4的亲和位点分析. 华东理工大学学报, 2008, 34(1): 66−70.
[28]Kay BK, Winter J, McCafferty J. Phage Display of Peptides and Proteins: a Laboratory Manual. San Diego, CA: Academie Press, 1996.
[29]Chen XS, Wang BA, Wang Z. The condition for error-prone PCR induced mutation. Acad J Second Mil Med Univ, 2003, 24(3): 307−310 (in Chinese).陈晓穗, 汪保安, 王琰. 错配 PCR致突变的实验条件研究. 第二军医大学学报, 2003, 24(3):307−310.
