对乙酰氨基酚诱导的急性肝损伤大鼠血浆mi R-122表达的变化
2013-11-12汤纳平殷承胜季龙凤杨琛懋黄欢夏
王 雁,汤纳平,富 欣,殷承胜,季龙凤,杨琛懋,黄欢夏,马 璟
(中国医药工业研究总院国家上海新药安全评价研究中心,上海 201203)
药物诱导的肝损伤是终止药物研发和撤市的主要原因之一[1-2]。近60年以来,评价药物性肝损伤和区分不同类型肝损伤的指标主要是依据对血液中酶的检测,如广泛使用的丙氨酸氨基转移酶(gl uta mic pyr uric trans minase,GPT)和天冬氨酸氨基转移酶(gl utamic oxaloacetic trans minase,GOT)。但这些指标在肝外损伤如骨骼肌损伤、肠胃损伤中也能检测到升高[3-4],其结果并不总是与组织病理学检测结果一致[5]。随着高通量分子生物学技术发展,新的肝损伤生物标志物被报道,比如对 氧磷酶1,血清F蛋白等[6-7],但均因技术局限而不能被推广。微RNA(micro RNA,mi R)分子可以在体液循环中稳定存在[8],从而为mi R作为非侵袭性生物标志各种疾病的预防和诊断方面的应用奠定了基础。
mi R-122是较早被发现且研究较为详细的一种mi R。2002年,Lagos-Quintana等[9]通过对成年小鼠各种组织细胞中多种mi R系统克隆和测序以及进一步鉴定,发现mi R-122仅在肝组织细胞中表达且是肝细胞中表达量最高的mi R,进一步研究证明,循环mi R-122在药物诱导的肝损伤中要早于传统指标升高且能有效区分肝损伤与肝外损伤[10-11],并且其定量检测技术实时定量逆转录PCR(RT-qPCR)检测范围广、重复性好和灵敏度高,但是,目前一些文献报道循环mi R相对定量普遍使用的被认为表达恒定的管家基因会随着实验条件、样品类型等不同而表达不稳定[12-13],因此,使用适合不同实验条件的稳定内参基因对于RT-qPCR获得准确结果非常重要。
本实验使用前期工作筛选的在大鼠急性肝损伤血浆中稳定表达的内源性校正基因mi R-103[14],定量检测了血浆mi R-122在不同程度肝损伤发生、发展过程中不同时间点的表达,评价血浆mi R-122作为早期肝损伤灵敏生物标志物的可能性。
1 材料与方法
1.1 仪器和试剂
Hitachi 7060全自动生化分析仪(日本Hitachi集团);Excelsior ES组织脱水机、Histocentre 3型组织包埋机、Nano Dr op 1000分光光度仪和台式高速低温离心机(美国Ther mo公司);RM2135型旋转石蜡切片机和ST5020 HE染色仪(美国Leica公司),PHY-Ⅲ病理组织漂烘仪(常州市中威电子仪器有限公司);Axioscope.A1荧光显微镜(德国Zeiss公司),实时PCR仪(美国Applied Biosystems公司),对乙酰氨基酚,购自Sigma-Aldrich中国有限公司,羧甲基纤维素钠(CMC-Na),购自国药集团;焦碳酸二乙酯化学试剂;mir VanaTM小干扰mRNA(mi RNA)分离试剂盒,购自美国Ambion公司;miScript SYBR®Green PCR Kit PCR,miScript逆转录试剂盒,购自德国Qiagen公司;Trizol LS,购自美国Invitr ogen公司。
1.2 动物
雄性SD大鼠,6~7周龄,SPF级,90只,体质量160~180 g,由上海西普尔-必凯实验动物有限公司提供,动物许可证号:SCXK(沪)2008-0016。大鼠饲养温度20~26℃,相对湿度40%~70%,12/12 h明暗交替,SPF环境自由进食、饮水。动物适应1周后开始实验,实验前至少禁食12 h,不禁水,给药后正常进食和进水。
1.3 动物分组给药和样本的采集
大鼠ig给予对乙酰氨基酚625和1250 mg·kg-1(n=42),溶媒对照组(n=6)ig给予0.5%CMC-Na 10 ml·kg-1。其中溶媒对照组大鼠在单次ig给药后24 h解剖,对乙酰氨基酚组分别于给药后1.5,3,6,12,24,36和96 h时每组各取6只大鼠,腹主动脉采取足够的血清及血浆用于临床生化指标检测和总RNA的提取。
1.4 大鼠肝组织病理形态学观察
大鼠腹主动脉采血后放血处死,解剖大鼠摘取肝,取肝左外叶和右外叶,用生理盐水洗涤,在10%多聚甲醛中固定至少2 d,修样,脱水,石蜡包埋,切成5μm厚的肝组织切片,HE染色后光镜下观察。
1.5 血清GPT和GOT的检测
参照GPT和GOT生化试剂盒说明书使用Hitachi-7060型全自动生化分析仪检测所有大鼠血清中GPT和GOT的活性。
1.6 血浆总RNA的提取
血浆按照张毅等[11]方法,分别经过1600×g,4℃,10 min和16 000×g,4℃,10 min离心2次后,取500μl血浆置于无RNA/DNA酶的离心管中,并加入625μl的Trizol LS,混匀,室温静置5 min后于-80℃低温保存。取1.3中已加入Trizol LS的血浆,加入167μl的氯仿,混匀,置室温10 min,12 000×g,4℃离心15 min,使水相和有机相分离。小心取上层水相液体,移至新的Ep管中。之后参照mi RNA分离试剂盒说明书中的步骤提取总RNA,用分离光度计测定RNA在260 nm处的吸光 度 (absorbance,A),以 A260nm/A280nm及 A260nm/A230nm评估提取的总RNA的浓度和质量。只有A260nm/A280nm在1.7~2.0之间,A260nm/A230nm接近2.0的样品才被用于进一步的RT-qPCR定量分析。
1.7 逆转录及定量PCR检测mi R-122的表达
20μl逆转录体系包括5×逆转录缓冲液4μl,逆转录混合液1μl,DEPC水5μl,RNA模板10μl,混匀后置于37℃60 min,95℃5 min,得到的产物保存在-80℃条件下或立即进行下步反应。合成的c DNA用于实时定量PCR,20μl体系包括2×SYBR Green Mix 10μl,反向引物0.5μl(试剂盒中提供),正向引物1μl(由Invitrogen合成),焦碳酸二乙酯水7.5μl,c DNA模板1μl。反应条件为95℃,酶活化15 min;95℃变性15 s,60℃退火延伸1 min,共40个循环。采用前期实验确认的急性肝损伤稳定表达的内源性基因mi R-103为校正基因,按照文献方法[15]计算mi R-122相对表达量计算公式为2-ΔΔCt=2[(Ct mi R-122-Ct mi R-103)给药组 -(Ct mi R-122-Ct mi R-103)对照组]。
1.8 统计学分析
2 结果
2.1 对乙酰氨基酚对肝组织病理形态学的影响
给药后不同时间点肝组织病理形态学观察结果(图1)显示,对乙酰氨基酚625 mg·kg-1药后12 h肝腺泡 Ⅲ带 出现空泡样变性、肝窦充血(图1 A5),给药后24 h肝腺泡 Ⅲ带出现细胞坏死并且有大量的炎症细胞浸润(图1 A6),而给药后36 h基本恢复正常(图1 A7);对乙酰氨基酚1250 mg·kg-1给药后6h肝腺泡Ⅲ带出现空泡样变性、肝窦充血(图1B4),给药后12 h空泡样变性细胞增多,且Ⅲ带有明显的细胞坏死、炎症细胞浸润(图1B5),24 h后肝细胞坏死区域扩大,肝索紊乱且大量炎症细胞聚集(图1B6),36 h后仍观察到肝腺泡Ⅲ带炎症细胞浸润(图1B7)。由此可知,对乙酰氨基酚1250 mg·kg-1组肝损伤发生的时间早于625 mg·kg-1组,且损伤持续时间较长,肝损伤区域广泛。
2.2 对乙酰氨基酚对GPT和GOT活性的影响
与溶媒对照组相比,对乙酰氨基酚625和1250 mg·kg-1组大鼠血清GPT从12 h开始有显著性升高,一直持续到24 h达到最高值,36 h开始恢复正常水平,并且对乙酰氨基酚1250 mg·kg-1组GPT的活性均是对照组的2倍以上(图2 A)。如图2B所示,对乙酰氨基酚1250 mg·kg-1组大鼠血清GOT的活性6 h与对照组相比就有显著性升高(P<0.05),12~24 h GOT活性均高于对照组的2倍以上,对乙酰氨基酚625 mg·kg-1组大鼠血清GOT活性在对乙酰氨基酚暴露12 h有显著性升高,并且对乙酰氨基酚给药组大鼠血清GOT的活性在给药后96 h较对照组仍有显著性升高(P<0.05)。
2.3 对乙酰氨基酚诱导肝损伤大鼠血浆中mi R-122的动力学变化
由图3可见,与溶媒对照组相比,对乙酰氨基酚1250 mg·kg-1组大鼠血浆 mi R-122 1.5 h升高3.6倍,12 h升高200倍左右达到峰值,36 h仍然是对照组的8.8倍,36 h几乎恢复正常水平。对乙酰氨基酚625 mg·kg-1组血浆 mi R-122 6 h开始升高,12 h升高67倍左右达到峰值,36 h几乎恢复正常水平。由图3看出,血浆mi R-122在对乙酰氨基酚给药的含量变化呈现出剂量依赖性,且对乙酰氨基酚1250 mg·kg-1给药后1.5~12 h的变化呈现出明显的时间依赖性(r=0.952,P=0.048)。
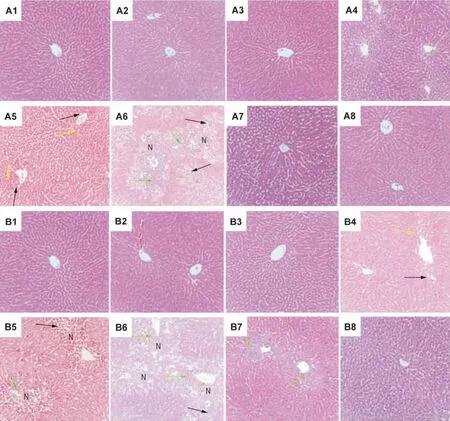
Fig.1 Liver histopathology of rats given acetaminophen(APAP)(HE×200).Rats were ig given APAP 0(nor mal control),625 and 1250 mg·kg-1,the liver samples were collected at 0,1.5,3,6,12,24,36 and 96 h after ad ministration.A1-A8:APAP 625 mg·kg-1 group at 0,1.5,3,6,12,24,36 and 96 h after ad ministration.B1-B8:APAP 1250 mg·kg-1 group at 0,1.5,3,6,12,24,36 and 96 h after ad ministration.Black arr ows:vacuolated hepatocytes;yellow arr ows:congestion in sinusoids;green arr ows:infla mmatory cells;N:centrilobular necr osis.
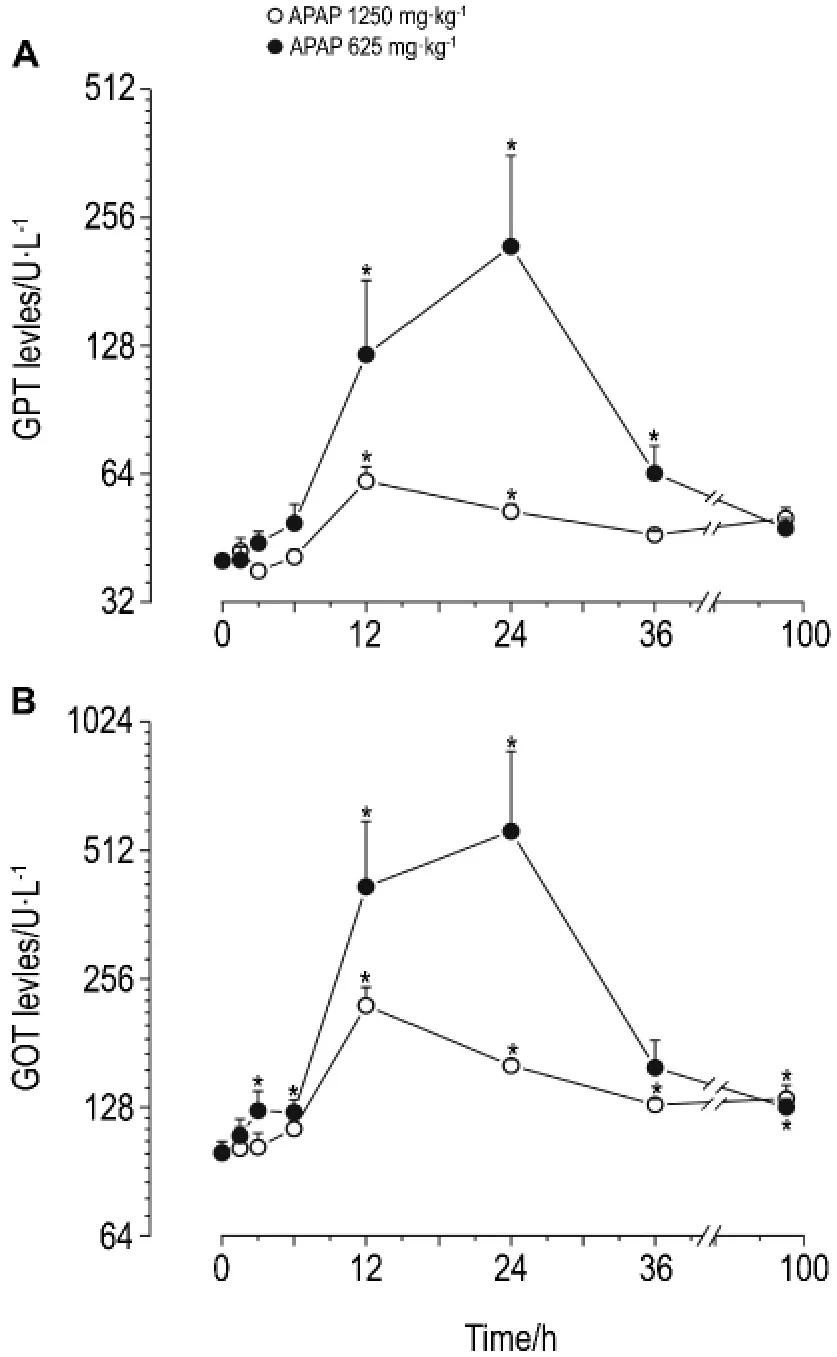
Fig.2 Changes in serum glutamic pyruric transminase(GPT)(A)and glutamic oxaloacetic tr nasminase(GOT)activities(B)of rats with acute liver injury induced by APAP.±s,n=6.*P<0.05,compared with 0 h(control).
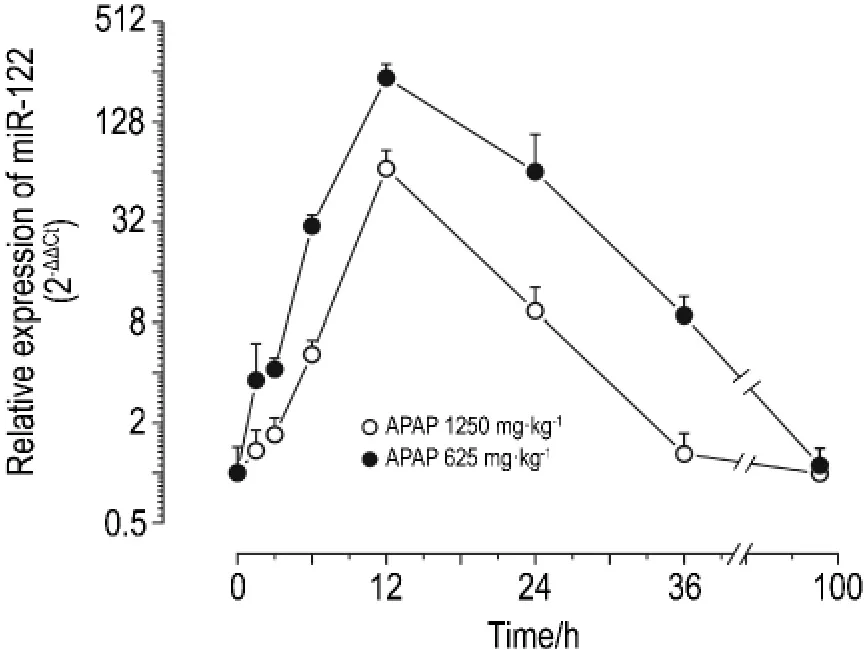
Fig.3 Changes in mi R-122 expression in plasma of rats with actue liver injury induced by APAP.Endogenous mi R-103 was used as the nor malizer[14].±s,n=6.
3 讨论
mi R是主要参与细胞的发育、分化、增殖和凋亡等重要的生理病理过程[16-17],可广泛存在于血液、尿液和脑脊液等各种生物体液中[18],而循环mi R据报道有望成为癌症、心血管疾病、自身免疫疾病等的诊断指标。研究循环mi R在组织损伤中的表达变化,有助于从分子水平了解药物性肝损伤的机制。
mi R-122是一个调节肝发育的“肝特异性mi R”[19]。研究表明,在生理状态下,mi R-122参与肝细胞发育、分化代谢,以及肝细胞应急应答等。应用反义寡聚核苷酸抑制肝mi R-122的表达,肝功能受损,胆固醇合成下降,说明mi R-122对维持肝正常功能起着重要作用[20]。综合mi R-122上述特性,使它成为了检测肝损伤潜在的理想生物标志物。
血浆中mi R-122的检测主要使用RT-q PCR技术,但是很多因素都将会影响mi R的最终定量结果[12]。因此,选择一个合适稳定的内参基因对于获得精确的RT-q PCR结果非常重要。因为循环mi R-122定量常用的内参基因在血液中的稳定性不同于mi R[21],因此,并不适合作为血浆mi R-122的内参校正基因。尽管有实验使用外源的基因(如线虫mi R-39)作为校正基因,但因mi R在血液循环中主要以膜性结构包裹或以蛋白结合的形式存在,如mi R-122主要以 Argonaute2-mi R-122的形式存在[22-23],而外源合成或纯化的校正基因加入血液后可能与内源mi R的提取效率、逆转录效率以及扩增效率不同,达不到内参基因校正的目的,因此,本实验使用了前期工作筛选的在急性肝损伤模型中稳定表达的内源性基因mi R-103对结果进行校正,保证了mi R-122定量检测结果的可靠性[14]。
对乙酰氨基酚诱导的大鼠肝损伤与临床肝损伤病理过程极为相似,因此本实验采用了常用的解热镇痛抗炎药对乙酰氨基酚制造大鼠急性肝损伤,并且使用在以往的研究中均未发现其对肝有影响的0.5%CMC-Na作为助溶剂[24]。本实验结果表明,mi R-122在对乙酰氨基酚1250 mg·kg-1给药后1.5 h就有显著性升高,对乙酰氨基酚625 mg·kg-1给药后6 h有显著性升高,均早于肝损伤评价“金标准”GPT升高,这与 Wang等[10]使用的小鼠急性肝损伤模型所得结论一致。另外,肝损伤大鼠血浆mi R-122的升高幅度较传统指标更大,因此,血浆mi R-122是肝损伤检测更灵敏的指标。本实验结果表明,血浆mi R-122与肝损伤传统指标血清转氨酶的变化趋势基本相似,但是血浆mi R-122达峰时间及开始下降时间均早于血清GPT和GOT的变化,这可能与血浆mi R-122与血清转氨酶的半衰期不同所致。与肝组织病理学结果的比较显示,出现病理改变时血浆中mi R-122的表达显著性升高,并且随着肝损伤的加重而持续升高;肝组织病理改变出现恢复时,血浆mi R-122的表达水平立即下降,与肝损伤的程度呈一致性。
因此,结合血清生化指标GPT,GOT及肝组织病理形态学变化,通过对血浆mi R-122在大鼠急性肝损伤血浆中动力变化趋势的分析,得知血浆mi R-122在对乙酰氨基酚给药后的含量变化呈剂量依赖性,且在对乙酰氨基酚给药后的12 h内含量变化呈现出明显的时间依赖性。较传统指标升高幅度大,能更早检测到肝损伤;与组织病理改变一致。因此,血浆mi R-122的变化与肝组织损伤密切相关,对肝损伤的发生、发展有良好的预测和预后能力。鉴于肝损伤的发病机制是一个复杂的过程,将血浆mi R-122与肝损伤的其他检测指标组合使用,有望显著提高诊断的灵敏性和准确性。
总之,相对于成分比较复杂,血液中易降解和检测技术局限的潜在的蛋白生物标志物,循环mi R-122在肝组织中高表达,在其他组织中表达很低甚至检测不到,种属间高度保守,血液中主要以Argonaute2-mi R-122形式存在从而抵制RNA酶的降解[22],可以使用特异性强、灵敏度高和定量准确的RT-qPCR检测技术,因此,循环mi R-122更有望成为药物性肝损伤评价的新指标。相信随着更广泛的临床前和临床实验的验证以及mi R核苷酸技术的发展和推广,循环mi R-122将会成为药物性肝损伤安全评价的一个新的理想的血液学检测指标。
[1]Wat kins PB.Dr ug safety sciences and t he bottleneck in dr ug develop ment[J].Clin Phar macol Ther,2011,89(6):788-790.
[2]Chen M,Vijay V,Shi Q,Liu Z,Fang H,Tong W.FDA-appr oved dr ug labeling f or t he st udy of dr ug-induced liver injury[J].Dr ug Discov Today,2011,16(15-16):697-703.
[3]Nat h wani RA,Pais S,Reynolds TB,Kaplowitz N.Ser u m alanine aminotransferase in skeletal muscle diseases[J].Hepat ology,2005,41(2):380-382.
[4]Bailey WJ,Holder D,Patel H,Devlin P,Gonzalez RJ,Hamilton V,et al.A perf or mance evaluation of three druginduced liver injur y bio mar kers in t he rat:al pha-glutat hione S-transferase,arginase 1,and 4-hydr oxyphenyl-pyr uvate dioxygenase[J].Toxicol Sci,2012,130(2):229-244.
[5]Ozer J,Rat ner M,Shaw M,Bailey W,Scho maker S.The current state of ser u m bio mar kers of hepatotoxicity[J].Toxicology,2008,245(3):194-205.
[6]FerréN,Marsillach J,Camps J,Mackness B,Mackness M,Riu F,et al.Paraoxonase-1 is associated with oxidative stress,fibr osis and FAS expression in chronic liver diseases[J].J Hepatol,2006,45(1):51-59.
[7]Asha miss F,Wierzbicki Z,Chrzanowska A,Scibior D,Pacholczyk M,Kosieradzki M,et al.Clinical significance of arginase after liver transplantation[J].Ann Transplant,2004,9(3):58-60.
[8]Mitchell PS,Parkin RK,Kroh EM,Fritz BR,Wy man SK,Pogosova-Agadjanyan EL,et al.Circulating micr o RNAs as stable blood-based mar kers f or cancer detection[J].Pr oc Natl Acad Sci USA,2008,105(30):10513-10518.
[9]Lagos-Quintana M,Rauhut R,Yalcin A,Meyer J,Lendeckel W,Tuschl T.Identification of tissue-specific micro RNAs fro m mouse[J].Curr Biol,2002,12(9):735-739.
[10]Wang K,Zhang S,Marzolf B,Troisch P,Bright man A,Hu Z,et al.Circulating micro RNAs,potential bio mar kers for dr ug-induced liver injury[J].Proc Natl Acad Sci USA,2009,106(11):4402-4407.
[11]Zhang Y,Jia Y, Zheng R, Guo Y,Wang Y,Guo H,et al.Plasma micro RNA-122 as a biomar ker f or viral-,alcohol-,and che mical-related hepatic diseases[J].Clin Chem,2010,56(12):1830-1838.
[12]Huggett J,Dheda K,Bustin S,Zu mla A.Real-ti me RT-PCR nor malisation;strategies and considerations[J].Genes Immun,2005,6(4):279-284.
[13]Brattelid T,Aar nes EK,Helgeland E,Guvaåg S,Eichele H,Jonassen AK.Nor malization strategy is critical f or the outco me of mi RNA expression analyses in t he rat heart[J].Physiol Geno mics,2011,43(10):604-610.
[14]Wang Y, Tang N, Hui T,Wang S,Zeng X,Li H,et al.Identification of endogenous reference genes f or RT-qPCR analysis of plasma micro RNAs levels in rats with acetaminophen-induced hepat otoxicity[J/OL].J Appl Toxicol,http:∥onlinelibrary.wiley.com/doi/10.1002/jat.2864./abstrat
[15]Livak KJ,Sch mittgen TD.Analysis of relative gene expression data using real-ti me quantitative PCR and t he 2-ΔΔCTmet hod[J].Met hods,2001,25(4):402-408.
[16]Lee RC,Feinbau m RL,Ambr os V.The C.elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J].Cell,1993,75(5):843-854.
[17]Krol J,Loedige I,Filipo wicz W.The widespread regulation of micro RNA biogenesis,f unction and decay[J].Nat Rev Genet,2010,11(9):597-610.
[18]Weber JA,Baxter DH,Zhang S,Huang DY,Huang KH,Lee MJ,et al.The micro RNA spectr u m in 12 body fl uids[J].Clin Chem,2010,56(11):1733-1741.
[19]Chang J,Nicolas E,Mar ks D,Sander C,Lerro A,Buendia MA,et al.mi R-122,a ma mmalian liver-specific micr o RNA,is processed fro m hcr mRNA and may do wnregulate t he highaffinity cationic amino acid transporter CAT-1[J].RNA Biol,2004,1(2):106-113.
[20]Krützfeldt J,Rajewsky N,Braich R,Rajeev KG,Tuschl T,Manoharan M,et al.Silencing of micro RNAs in vivo with″antago mirs″[J].Nat ure,2005,438(7068):685-689.
[21]Song J,Bai Z,Han W,Zhang J,Meng H,Bi J,et al.Identification of suitable reference genes f or qPCR analysis of ser u m micro RNA in gastric cancer patients[J].Dig Dis Sci,2012,57(4):897-904.
[22]Arroyo JD,Chevillet JR,Kroh EM,Ruf IK,Pritchard CC,Gibson DF,et al.Argonaute2 co mplexes carr y a population of circulating micr o RNAs independent of vesicles in hu man plas ma[J].Proc Natl Acad Sci USA,2011,108(12):5003-5008.
[23]Hunter MP,Ismail N,Zhang X,Aguda BD,Lee EJ,Yu L,et al.Detection of micr o RNA expression in hu man peripheral blood micr ovesicles[J].PLoS One,2008,3(11):e3694.
[24]Yang X, Greenhaw J, Shi Q, Su Z,Qian F,Davis K,et al.Identification of urinary micr o RNA profiles in rats t hat may diagnose hepatotoxicity[J].Toxicol Sci,2012,125(2):335-344.
