益气活血方对大鼠局灶性脑缺血再灌注损伤模型的干预作用
2013-11-12黄太权易春涛褚怡雯汤庆丰付如珍
黄太权 易春涛△ 褚怡雯 汤庆丰 付如珍 周 宁
(1.上海市徐汇区康健街道社区卫生服务中心,上海 200233;2.上海中医药大学附属普陀医院,上海 200062;3.上海市静安区曹家渡街道社区卫生服务中心,上海 200042)
益气活血方是根据气虚是中风致病的根源,血瘀是中风发生发展的核心的病理性质而拟定的治疗急性脑梗死的常用方[1-3],是经过多年临床总结筛选治疗急性脑梗死的有效处方,在临床运用过程中取得了良好的临床效果。本研究旨在通过神经功能缺损评分,脑组织形态学观察,含水量测定,ATP 酶、超氧化物歧化酶(SOD)、一氧化氮合酶活性,丙二醛(MDA)、一氧化氮(NO)含量测定,探索益气活血方对脑缺血再灌注损伤作用机制,为临床提供依据,从而为临床脑保护药物的研制和开发提供实验依据。
1 材料与方法
1.1 实验药物 益气活血汤药(党参15 g,黄芪30 g,赤芍10 g,川芎10 g,红花6 g,桃仁10 g,三棱10 g,莪术10 g,地龙3 g,全蝎6 g)由普陀区中心医院中药房制作。
1.2 实验动物 清洁级健康Sprague-Dawley 大鼠,雌雄各半,10 周左右,体质量(250±10)g,上海中医药大学实验动物中心提供。
1.3 分组与造模 观察大鼠共48 只,随机分为3 组,即假手术组,模型组,益气活血组。每组16 只。除假手术组不插线外,其余两组制备大鼠大脑中动脉阻断缺血再灌注模型(MACO)。前两组于术前7 d 和术后24 h按1 mL/100 g,每日2次灌喂0.9%氯化钠注射液,益气活血组按等剂量灌喂益气活血汤药(含生药1.1 g/mL)。参考杨氏改进的Zea longa 方法,制备大鼠大脑中动脉阻断缺血再灌注模型。用设计30 mm 长、直径为0.19 mm的Blue-Monofilament Nylon,(4-0 DERMALON由DG 公司生产),一端0.5 mm 处加热成球形(直径0.244 mm,0.9%氯化钠注射液冲洗),并于距线球18 mm 处作标记,置1%的肝素钠溶液内备用。用10%的水合氯醛腹腔麻醉(35 mg/100 g 体质量),仰卧于手术台上,颈正中切口,分离右侧颈总动脉(CCA),颈外动脉(ECA),颈内动脉(ICA),用电凝器烧灼ECA的分支,结扎并游离ECA 主干一段,沿ICA 向下分离翼颚动脉(PPA),并沿起点电凝,在ECA 剪一小口注入0.03 mL 浓度为2.4×106U/L的肝素钠溶液,将制备好的线插入ECA,经CCA 分叉通过ICA 入颅脑至大脑中动脉(ACA),插入深度为(18.0±0.5)mm,即可遇到轻微的阻力,表明尼龙线头端已到达(ACA)。再灌注时外拉线使球端回至ECA,拔除插线,结扎ECA 即可。假手术组不插线外,其余步骤同上。大鼠大脑中动脉栓塞后30 min 恢复血供,术后约1 h 大鼠苏醒,出现右前肢屈曲和前进时向右侧划圈,证明左侧大脑中动脉阻塞成功;用2%溴化三苯四氮唑(TTC)染色以证实脑缺血灶的存在。然后保温常规饲养,缺血再灌注不同时间点各组大鼠在规定的时间点取脑备用,假手术组缺血再灌注24 h 取材。实验过程中,因麻醉意外、MCAO 手术失败、造模不成功及24 h 内死亡的均弃去不用。
1.4 观察指标(1)神经功能缺损积分。参考Zea Longa的5 分制评分标准[4]。各组造模成功的大鼠分别于再灌注后1、3、6、24 h 进行评分。0 分为无神经损伤症状;1 分为不能完全伸展对侧前肢;2 分为向对侧转圈;3分为向对侧倾倒;4 分为不能自发行走,意识丧失。(2)脑组织形态学观察。运用透射电镜进行脑组织结构观察。(3)脑含水量测定。各组造模成功的大鼠,再灌注24 h 断头处死,取视交叉后厚约1 mm的组织,称重后,置95℃烘烤箱内烘烤24 h 称干重,按GOTOH 公式:脑含水量=(湿重-干重)/湿重×100%。(4)脑组织中SOD 活性、MDA、NO 含量测定。
1.5 统计学处理 应用SPSS13.0 统计软件。治疗前后比较用配对资料t 检验。组间比较用两样本的t 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠神经功能缺损程度积分比较 见表1。连续观察第1 h、3 h、6 h、24 h 大鼠神经功能评分。与假手术比较,模型组,益气活血组均在4个时间出现明显神经功能缺损(P<0.01)。与模型组相比,在缺血再灌注后3 h,6 h,益气活血组积分明显降低(P<0.05)。在24 h时益气活血组的积分较模型组为低,但差异无统计学意义(P>0.05)
表1 各组大鼠神经功能缺损程度积分比较(分,±s)
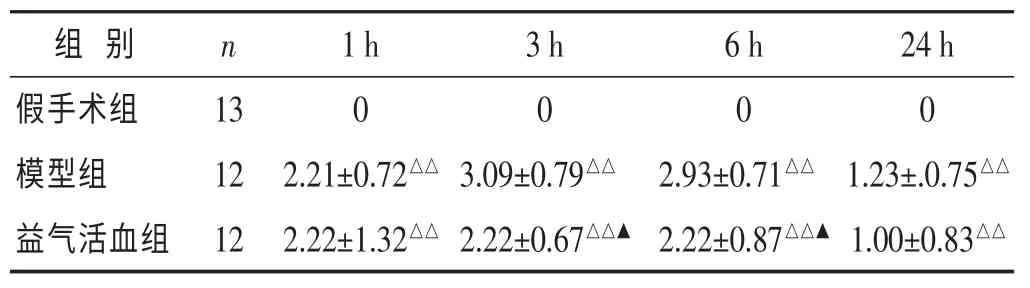
表1 各组大鼠神经功能缺损程度积分比较(分,±s)
与假手术组比较,△△P<0.01;与模型组比较,▲P<0.05。下同。
2.2 益气活血方对大鼠脑组织形态学结构的影响假手术组可见微血管切面呈椭圆,管腔无狭窄,基膜完整,内皮细胞无肿胀,表面光滑,管周无水肿,海马神经元未见明显改变。益气活血组管腔形态基本正常,神经元细胞,胶质细胞核仁形态基本正常,核膜少有切迹、扭曲,偶有线粒体扩张,嵴断裂。少有内质网肿胀扭曲,排列比较整齐。模型组管腔变形,内皮细胞部分肿胀,基膜欠完整,管周有水肿、空泡现象。
2.3 益气活血方对大鼠脑含水量的影响 见表2。与假手术相比,模型组患侧脑含水量明显升高(P<0.05)。与模型组相比益气活血组脑含水量明显下降(P<0.05)。
2.4 各组大鼠脑组织中SOD 活性、MDA 含量比较见表3。与假手术相比,模型组的SOD 活性明显下降,MDA 含量明显升高(P<0.05)。与模型组相比,益气活血组SOD 活力有所升高(P<0.05),MDA 含量有所下降,两组之间差异有统计学意义(P<0.05)。
表2 各组大鼠脑含水量变化的影响(%,±s)

表2 各组大鼠脑含水量变化的影响(%,±s)
与假手术组比较,△P<0.05。下同。
表3 各组大鼠脑组织中SOD 活性、丙二醛MDA 含量比较(±s)
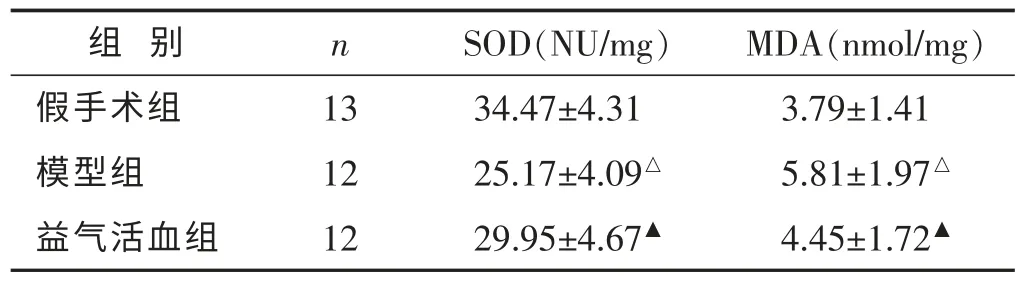
表3 各组大鼠脑组织中SOD 活性、丙二醛MDA 含量比较(±s)
2.5 各组大鼠脑组织中NOS 活性、NO 含量比较 见表4。与假手术相比,模型组的NOS 活性无明显变化(P>0.05),NO 含量明显升高(P<0.05)。与模型组相比,益气活血组NOS 活性明显降低(P<0.05),NO 含量有所下降,两组之间差异有统计学意义(P<0.05)。
表4 各组大鼠脑组织中NOS 活性、NO 含量比较(μmol/g,±s)
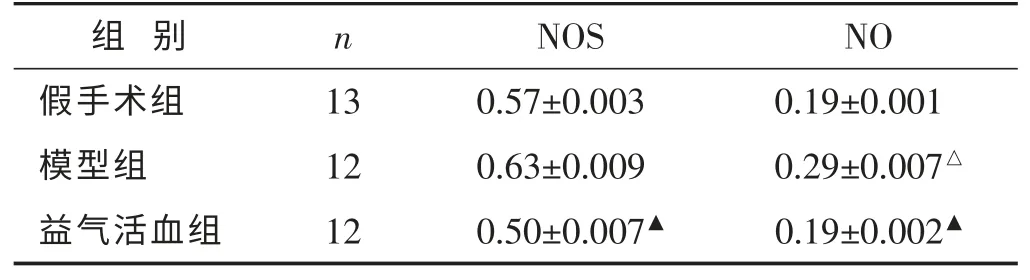
表4 各组大鼠脑组织中NOS 活性、NO 含量比较(μmol/g,±s)
3 讨论
益气活血方能够明显改善大鼠脑缺血再灌注后的神经功能损伤。其涉及的机制可能是多方面的。根据本实验研究可能有以下几个方面。脑含水量是反映脑水肿的一个常用指标[5]。缺血再灌注后的脑水肿是临床引起死亡的常见原因之一。脑水肿不但引起脑组织体积增大,颜色苍白,脑沟变浅等大体形态学的改变,而且镜下也能够见到细胞肿胀,间隙减少。这些细微结构的变化可影响脑的微循环,使得内皮细胞,能量代谢,离子代谢等失去平衡,最终导致神经细胞的死亡而影响神经功能。脑缺血再灌注后的病理生理是一个多环节多因素、多途径损伤的级联反应。其中自由基参与的缺血再灌注损伤,既是神经元损伤的致命因素,又是损伤级联反应的关键环节。目前认为氧自由基介导的连锁反应是神经功能损伤的主要原因,也是缺血再灌注损伤的主要机制[6-8]。自由基主要攻击脂质膜中的不饱和脂肪酸的多个不饱和链,使之发生过氧化反应,导致质膜损伤,通透性增加,各种细胞器解体,加重细胞毒性水肿[9];MDA 作为氧自由基与生物膜不饱和脂肪酸发生脂质过氧化反应的代谢产物,其含量的变化间接地反应了脑组织中氧自由基含量的变化;SOD 是一种带负电荷的金属蛋白酶,可通过歧化的方式清除超氧阴离子自由基,脑缺血及再灌时产生过多的自由基,消耗了大量的SOD,导致脑组织中含量下降[10-11]。因此可以通过测定MDA、SOD 变化,间接的反应脑组织中自由基含量及脑组织损伤程度[12]。益气活血组SOD 活力有所升高,MDA 含量有所下降两组之间有显著差异。
NO 是一种自由性质的气体,为较小的生物活性分子,可自由穿过细胞膜,作用于细胞内的靶分子。在生物体内,NO 生成后很快被氧化,以硝酸根和亚硝酸根的形式存在于细胞的内外液中,使NO 失去生物学活性。低浓度的NO 能使血管扩张,抑制血小板集聚与黏附,使谷氨酸调控的离子通道下调,防止细胞内钙超载,因而对细胞有保护作用;但在高浓度下,NO 可与超氧阴离子反应生成超氧亚硝酸根离子,超氧亚硝酸根离子可以降解为OH-和NO2-自由基,使细胞膜发生脂质过氧化作用,在细胞的膜水平造成强烈的神经毒性,甚至导致神经元死亡等。研究表明NO 在脑缺血性损伤的发病中起重要作用,缺血后数分钟NO 含量明显增高,之后缓慢下降,于再灌注期NO 再次升高[13]。与模型组相比,益气活血组NOS 活性明显降低,NO 含量有所下降两组之间有显著差异。
因此认为,益气活血方保护脑缺血再灌注损伤作用可能与其能对抗自由基毒性,减轻自由基对内皮细胞的直接损伤密切相关。其可能的机制笔者将在今后的研究中将作进一步深入探讨。
[1]陶根鱼,杜晓泉.益气活血法在缺血性中风病中的地位[J].陕西中医学院学报,1998,21(3):1.
[2]郭改会,傅仁杰.170 中老年脑梗死症候特点分析[J].安徽中医学院学报,2002,21(6):14-16.
[3]胡建鹏.《内经》相关中风病病因病机浅析[J].中医药学刊,2004,22(1):113-115.
[4]Longa E Z,Weinstein PR,Carlson S,et al.Rcversible middle cerebral artery occusion without craniotomy in rat[J].Stroke,1989,20:84-91.
[5]杨世珍,闵宝珍.大鼠局灶性脑缺血再灌注模型的研究[J].中风与神经疾病杂志,1996,13(1):15-16.
[6]White BC,Sullivan JM,Degracia DJ,et al.Brain isschemia and reperfusion:molecular mechanisms of neuronal injury[J].J Neurol Sco,2000,179:1.
[7]Jiang MZ,Tsukahara H,Ohihima Y,et al.Effects of antioxidants and nitricoxide on FNF -alpha -induced anhesion molecule expression and NF-dappa B activation in human dermal microvascular endothelial cells[J].Life Sci,2004,75(10):1159-1170.
[8]姜德华,金男革,玄云汉,等.大鼠急性局灶脑缺血再灌注脑组织MDA 含量和NOS 活性的变化[J].临床神经病学杂志,2000,13(4):201.
[9]Simonian NA,Coyle JT.Oxidative Stress in neurodegenerative disease[J].Annu Rev Pharmacol Toxicol,1996,36:83-106.
[10]徐忠信,杨宏,钱桂利,等.急性脑缺血在灌注损伤钙离子与氧自由基作用研究[J].中风与神经疾病杂志,1995,12(6):331-333.
[11]杨军,马传庚.赤芍总苷质量缺血性脑血管病作用及其机制[J].安徽医科大学学报,2002,36(2):164-165.
[12]王嗣欣,周丽红,王中云,等.大剂量甲基强的松龙对缺血再灌注大鼠闹保护作用研究[J].中风与神经疾病杂志,2001,18(3):146-148.
[13]马玉羡.脑缺血再灌注损伤病理生理机制研究进展[J].河南医学研究,1998,7(4):375.
