苏云金芽胞杆菌还原Cr(VI)的转座子突变体库构建和分析*
2013-11-10黄天培苏新华
黄天培,张 君,苏新华,关 雄
(福建农林大学生物农药与化学生物学教育部重点实验室,福建福州 350002)
金属污染物广泛存在于环境之中,其中铬是主要的金属污染物之一[1,2]。寻求高效环保的含铬废水处理方案成为迫切需要解决的问题之一。废水中的铬存在形式主要有Cr(III)和Cr(VI)两种,其中,以Cr(VI)的毒性最大,约是 Cr(III)的1000倍[3]。把Cr(VI)还原成Cr(III)是工业上处理含铬废水最常用的方法之一[4]。其中,微生物法处理含铬废水具有投资小、运行费用低、无二次污染等优点[5]。目前,已经发现对Cr(VI)具有较强解毒能力的微生物主要有假单胞菌(Pseudmonadaceae)、大肠杆菌(Escherichia coli)、阴沟肠杆菌(Enterobacter cloacae)和硫酸盐还原菌(Sulfate-reducing bacteria)等[6-7]。微生物可以通过直接还原Cr(VI)、生成代谢产物来处理Cr(VI)和微生物吸附等方式达到解毒Cr(VI)的目的[8-12]。但是,微生物还原Cr(VI)在实际操作中仍然存在很多问题,如已报道能还原Cr(VI)微生物往往在造福人类的过程中对人类的健康产生威胁[13]。
苏云金芽胞杆菌(Bacillus thuringiensis,简称Bt)是应用广泛的一种微生物农药,对环境安全、对人无致病性[13-14]。2005年 Sahin等人研究了 Bt对 Cr(VI)的动力学吸附过程[11]。2010年,本实验室研究了不同来源(水样、土壤、植物、动物、食品、昆虫和饲料)Bt菌株还原铬(VI)的情况,证明Bt菌株普遍具有将铬(VI)还原为铬(III)的能力,从中筛选出具有较强还原铬(VI)能力的 Bt菌株[13]。因此,Bt是治理Cr(VI)污染的安全、高效候选材料之一。有鉴于此,以全基因组测序菌Bt 407为研究载体,将转座子随机突变载体pIC333转化Bt 407,构建转座子随机突变体库,从中筛选出Cr(VI)还原突变株,确定了其中一株突变株的转座子插入位点,并对突变株的作用机理进行了初步探讨,确认了突变株主要通过增强还原能力来提高解毒Cr(VI)能力。
1 材料与方法
1.1 材料
1.1.1 菌种 Bt菌株407(法国农科院Didier Lereclus教授实验室惠赠)和大肠杆菌TG1(商业化菌株,本室保存)。
1.1.2 培养基 Luria-Bertani(LB)培养基:蛋白胨10 g,酵母粉 5 g,氯化钠 10 g,蒸馏水 1 L,pH 7.0 ~7.2。
1.1.3 主要试剂 90 mg/L壮观霉素水溶液、5 mg/mL红霉素水溶液、4 mol/L氢氧化钠、10000 mg/L Cr(VI)、1∶1 硫酸溶液、1∶1 磷酸溶液、2 mg/mL二苯碳酰二肼。
1.2 方法
1.2.1 Bt 407电击感受态细胞的制备 参考Lecadet等人方法制备Bt 407电击感受态细胞[15]。
1.2.2 转座子随机突变载体pIC333转化Bt 407参考Lecadet等人方法电击转化pIC333(法国农科院Didier Lereclus教授实验室惠赠)至Bt 407[15]。参考孙长坡方法利用菌落PCR验证转化子:以M1(5'-GCATTAATGAATCGGCCAACG-3')和M2(5'-GTGGGTAAACCGTGAATATCG-3')为引物扩增mini-Tn10转座子壮观霉素抗性基因;以ermF(5'-ATGAACGAGAAAAATATAAAACAC-3')和ermR(5'-TTACTTATTAAATAATTTATAGCTATT-3')为引物扩增pIC333载体上的红霉素抗性基因[16]。
1.2.3 Bt 407转座子随机插入突变体库的构建
参考孙长坡和Kamoun等人方法构建Bt 407转座子随机插入突变体库[16-17]。
1.2.4 Cr(VI)还原能力具有显著差异的突变株筛选 通过Cr(VI)的测定检测菌株对铬的还原能力。以1%的接种量将菌液转接于Cr(VI)浓度为50 mg/L的LB液体培养基中,以野生菌株Bt 407为对照,30℃培养24 h后测量菌液中剩余Cr(VI)的溶度。六价铬的测定采用二苯碳酰二肼分光光度法[18]。
所有的实验重复三次,在Excel中求标准差与方差。实验结果经数据分析,计算SEM和LSD。
1.2.5 转座子插入位点侧翼序列的分析 参考QIAGEN公司Gentra Purgene Yeast/Bact.Kit试剂盒进行突变体的总DNA提取。利用Hind III完全酶切突变体总DNA。将酶切产物5μL纯化后取5μL加入5μL Kit Ligation Mix,于 PCR 仪中16 ℃ 自连,转化大肠杆菌感受态细胞TG1。利用引物e1(5'-CGTTGGCCGATTCATTAATGC-3')和 e3(5'-CGATATTCACGGTTTACCCAC-3')进行mini-Tn10侧翼序列的扩增,并测序。通过BLAST分析序列同源性,确定转座子插入位点。
1.2.6 Bt 407及其突变子的表型分析
1.2.6.1 生长曲线测定 将Bt 407及其14株突变子的甘油菌活化过夜,1%接种至100mL的LB中,30℃ 230 r/min震荡培养,每隔1 h测定OD600,直至12 h。
1.2.6.2 Bt 407及其突变子对反应液总铬浓度的影响 以1%的接种量将菌液转接于Cr(VI)浓度为50 mg/L的LB液体培养基中,以野生菌株Bt 407为对照,30℃培养24 h后测量反应液中总铬溶度。总铬浓度采用高锰酸钾高温氧化及二苯碳酰二肼分光光度法于540 nm波长处测定[18-19]。所有的实验重复三次,在Excel中求标准差与方差。实验结果经数据分析,计算SEM和LSD。
2 结果与分析
2.1 突变体库的构建
利用含有mini-Tn10转座子的突变载体pIC333,构建了Bt 407 Cry-随机插入突变体库,获得了容量为1500个克隆的突变体库,并通过抗性检测和PCR分析对该库进行了鉴定。
2.1.1 抗性鉴定
构建并优化转座子随机突变技术平台,将经过高温诱导突变的菌液涂布含有壮观霉素和红霉素LB平板,然后置于40℃培养。从该平板上挑取单克隆分别复制在相互对应位置的壮观霉素抗性平板和红霉素抗性平板上,然后40℃培养,从抗性上鉴定突变株。其中不能在红霉素平板上生长(图1A)但能在壮观霉素平板生长(图1B)的克隆即有可能为突变株。
2.1.2 PCR 鉴定
随机挑取数个突变子,以M1和M2为引物扩增壮观霉素抗性基因,以ermF和ermR为引物扩增红霉素抗性基因。含有载体pIC333的Bt 407转化子可以扩增到mini-Tn10转座子和红霉素抗性基因,而突变株可以扩增到壮观霉素,但扩增不到红霉素抗性基因(图2),从而构建了一个容量为1500的Bt 407转座子随机突变体库。

图1 Bt 407突变体库抗生素抗性检验Fig.1 Assay of Bt 407 mutant library by antibiotics
2.2 具有显著Cr(VI)还原能力差异的突变株的筛选
在Bt 407转座子随机突变体库中筛选具有Cr(VI)还原能力具有显著差异的突变株,利用国家标准的六价铬的测定(二苯碳酰二肼分光光度法)测定这些突变株还原50 mg/L Cr(VI)24 h后剩余的Cr(VI)浓度,重复三次,通过方差分析从中筛选出Cr(VI)还原能力与Bt 407野生株相比具有极显著差异(P<0.01)的突变株,共获得14株(图3)。野生株Bt 407在接种量为1%、温度为30℃、Cr(VI)初始浓度为50 mg/L的条件下培养24 h后,将Cr(VI)的浓度降解至约22 mg/L,而这14株突变株在相同条件下可降解至低于2.5 mg/L,还原Cr(VI)的能力提高了9倍左右。
2.3 突变体Bt 407-Cr244转座子插入位点侧翼序列的克隆和序列分析
Bt 407基因组中含有许多Hind III位点,而mini-Tn10中不含有该位点。提取Bt 407-Cr244总DNA,将其基因组经HindIII完全酶切为不同大小的片段(图4A)。将酶切产物纯化、自连、转化大肠杆菌TG1。提取大肠杆菌TG1转座子质粒,并以e1/e3为引物扩增得到mini-Tn10转座子的侧翼序列DNA片段,大小约为 2 kb(图 4B),说明 Bt 407-Cr244经HindIII完全酶切后的自连产物已成功导入大肠杆菌TG1。以 e1/e3为引物,获得 Bt 407-Cr244的 mini-Tn10侧翼片段的核苷酸序列。对其进行BLAST同源性比较,得出mini-Tn10转座子插入位点与细胞色素氧化酶亚单位Ⅰ的核苷酸序列高度同源(图5)。

图2 Bt 407突变体库PCR验证Fig.2 Identification of Bt 407mutant strains by PCR
2.4 Bt 407及其突变子的表型分析
通过测定Bt 407及其突变子的生长曲线以及Cr(VI)还原过程中总铬浓度来验证14株突变株能力提高的可能原因。结果表明,Bt 407及其14株突变子的生长曲线十分相近,排除了菌株繁殖能力提高的原因(图6)。在培养24小时后,Bt 407-Cr149和Bt 407-Cr285培养液中的总络浓度比Bt 407极显著降低(P<0.01),说明 Bt 407-Cr149和 Bt 407-Cr285在解毒Cr(VI)过程中除了还原作用,可能还具有生物吸附(图7)。因此,突变株处理Cr(VI)能力提高的作用机理主要是还原能力增强,同时,极少数突变株的生物吸附作用得到加强。
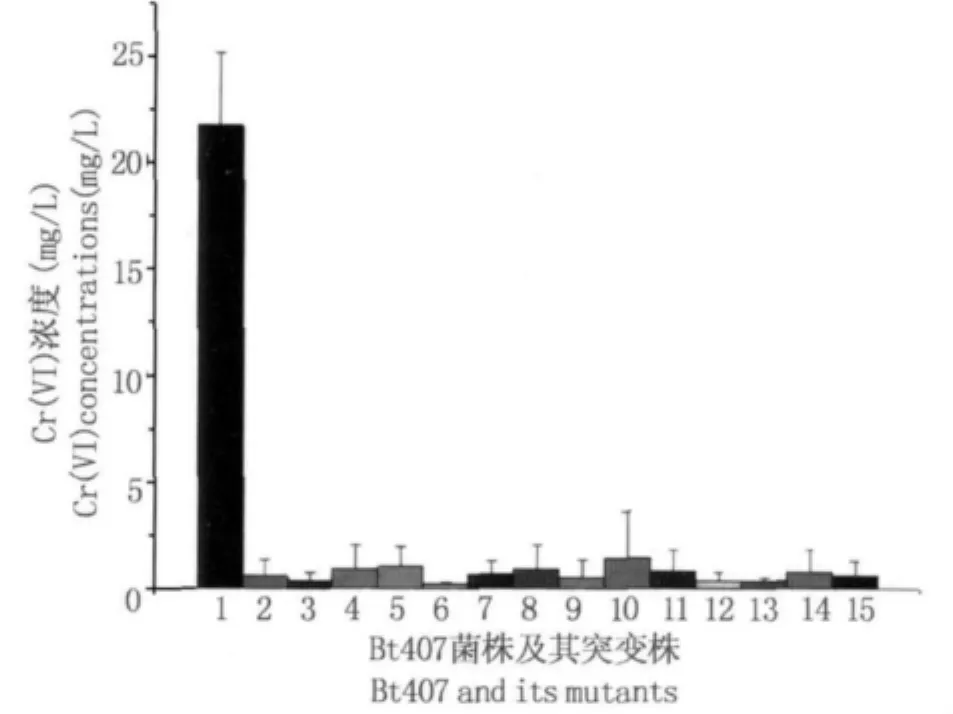
图3 具有显著Cr(VI)还原能力差异的Bt 407突变株筛选Fig.3 Bt 407 mutants which Cr(VI)-reduction capacity were significantly different(P <0.01)from Bt 407
3 讨论
自从1977年Romanenko等人首次报道脱色杆菌能够在厌氧的条件下还原Cr(VI)开始[20],越来越多的学者开始着手研究Cr(VI)还原菌。目前已发现多种不同的细菌能够在好氧或厌氧的条件下将Cr(VI)还原成Cr(III),包括苍白杆菌、蜡状芽孢杆菌、大肠杆菌、假单胞杆菌、脱硫弧菌、海藻希瓦氏菌和成团泛菌等[21-22]。然而,利用细菌处理含铬废水仍存在一些缺陷:首先是所采用的细菌存在安全性的问题,菌种自身对人类或动物具有毒性;其次,因对处理过程中的关键活性因子认识不足,以致在实际应用中细菌不能发挥其全部的还原Cr(VI)的能力[4]。而Bt对人类无致病性,不存在菌种安全性问题,并且可以高效还原Cr(VI),是治理Cr(VI)污染的理想材料之一[13-14]。

图4 突变体Bt 407-Cr244转座子插入位点侧翼序列的克隆Fig.4 Cloning flanking sequence of transposon insertion site in Bt 407-Cr244
国内外研究主要集中于Cr(VI)还原菌的筛选与鉴定以及治理条件的优化,对抗性和还原基因研究也较多。1983年,Lawrence等人从铬废水中分离出荧光假单胞菌LB300的质粒,发现质粒pLHB1具有与Cr(VI)的抗性相关的基因[23]。1990年,Cervantes等人证明铜绿假单胞菌(Pseudomonas aeruginosa)的铬抗性为 ChrA决定[24]。2002年,Juhnke等人通过pMOL编码的基因chrB1、chrC和chrI突变,验证了决定铬抗性的基因[25]。

图5 Bt 407-Cr244转座子插入位点分析Fig.5 Transposon insertion site in Bt 407-Cr244
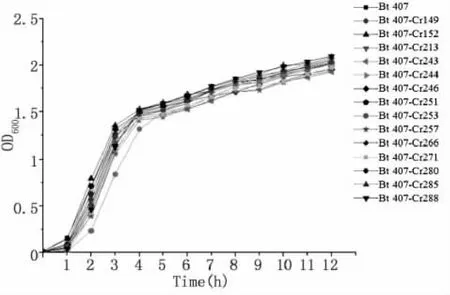
图6 Bt 407及其突变子的生长曲线Fig.6 Growth curves of Bt 407 and the mutants
目前,对Cr(VI)抗性或还原的调控基因研究还很少。2008年,Branco等人将Tn5转座子随机突变载体pSUP5011转化苍白杆菌5bvl1,鉴定了铬抗性基因的转座位点(TnOtChr),验证了其中的 chrB、chrA、chrC和chrF基因的功能,展示了一个关于铬抗性操纵子的遗传系统[26]。2009年,Henne等发现节杆菌FB24的基因组中包含着Cr(VI)抗性的决定因子(CRD),由8个基因组成,包括抗性基因chrA和chrB。研究发现节杆菌Cr(VI)的抗性主要取决于ChrA转运蛋白,新的基因在Cr(VI)的抗性中具有重要作用[27]。转座子随机插入突变技术作为转座子组学研究的一个重要手段,既可以研究已知基因的新功能,也可以用来钓取调控特定性状的新基因,是十分成熟的技术[28]。利用该技术得到还原Cr(VI)能力显著提高的Bt 407突变株,并得到一个可能与调控Cr(VI)还原的基因为细胞色素氧化酶亚单位Ⅰ。细胞色素氧化酶亚单位Ⅰ是细胞色素氧化酶复合体组成单位之一,作为分子标记在真核生物中广泛应用[29-30]。细胞色素氧化酶是线粒体和好氧性细菌的呼吸链终端酶,催化电子从细胞色素c分子氧的转移,使分子氧被还原生成水,而电子被耦合到质子转运过程中,穿过细胞膜,最后被F0F1-ATP酶利用来合成 ATP[31],其对 Bt还原 Cr(VI)的影响机制至今未知。此外,通过对Bt 407及其突变子部分表型的研究进一步确认了突变株主要通过增强还原能力来提高解毒Cr(VI)能力。
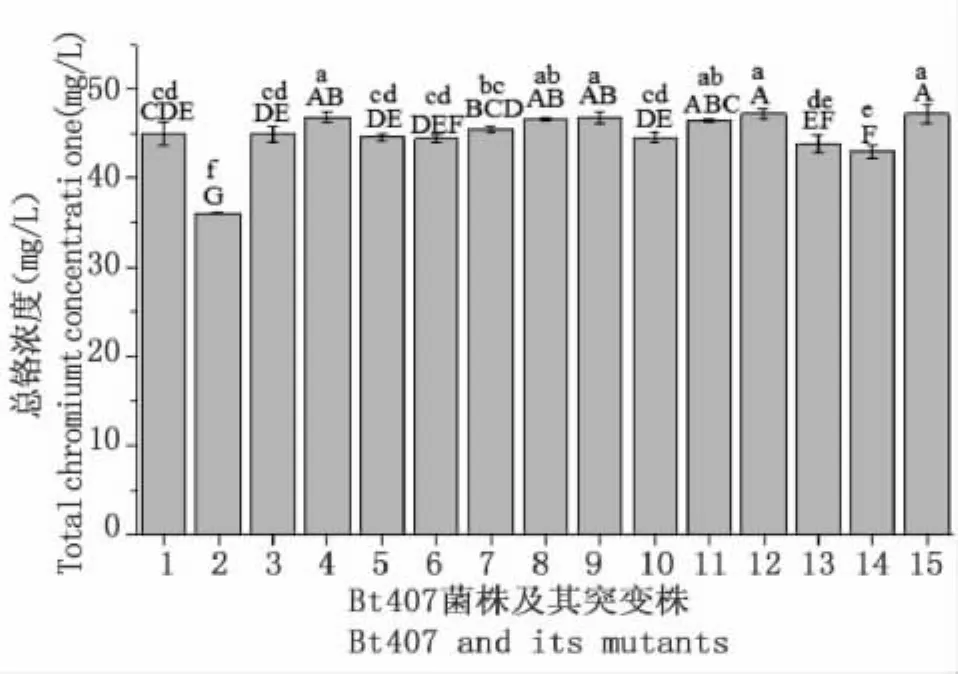
图7 在Bt 407及其突变子还原Cr(VI)过程中总铬的测定Fig.7 Determination of total chromium during the process of Cr(VI)reduction with Bt 407 and its mutants
[1]刘婉,李泽琴.水中铬污染治理的研究进展[J].广东微量元素科学,2007,14(9):5-9.LIU Wan,LI Zeqin.Progress on research of treating Cr containing wastewater [J].Guangdong Trace Elements Science,2007,14(9):5-9.
[2]肖伟,王磊,李倬锴,等.六价铬还原细菌Bacillus cereus S514还原机理及酶学性质研究[J].环境科学,2008,29(3):751-755.XIAO Wei,WANG Lei,LI Zhuokai,et al.Mechanisms and enzymatic characters of hexavalent chromium reduction by Bacillus cereus S514 [J].Environmental Science,2008,29(3):751-755.
[3]NKHALAMBAYAUSI-CHIRWA E M,WANG Y.Simultaneous chromium(Ⅵ)reduction and phenol degradation in a fixed-film coculture bioreactor:reactor performance[J].Water Research,2001,35(8):1921-1932.
[4]倪修龙,王毓芳,徐章法.含铬废水的生物治理[J].上海化工,2000,(23):4-6.NI Xiulong,WANG Yufang,XU Zhangfa.Treatment of chromium containing wastewater by microorganism[J].Shanghai Chemical Industry,2000,(23):4-6.
[5]马锦民,瞿建国,夏君,等.失活微生物和活体微生物处理含铬(VI)废水研究进展[J].环境科学与技术,2006,29(4):103-105.MA Jinmin,QU Jianguo,XIA Jun,et al.Progress on treating Cr(VI)-containing wastewater by inactive and alive microorganisms[J].Environmental Science& Technology,2006,29(4):103-105.
[6]汪频,李福德,刘大江.硫酸盐还原菌还原Cr(VI)的研究[J].环境科学,1993,14(6):1-4.WANG Pin,LI Defu,LIU Dajiang.Reduction of hexavalent chromium by sulfate-reducing bacteria[J].Environmental Science,1993,14(6):1-4.
[7]耿振香,孙颖.微生物法处理含铬废水[J].化学工程师,2003,95(2):6-7.GENG Zhenxiang,SUN Ying.Microbial treatment of waste water containing chromium(VI)[J].Chemical Engineer,2003,95(2):6-7.
[8]SHEN H,WANG Y T.Modeling hexavalent chromium reduction in Escherichia coli 33456[J].Biotechnol Bioeng,2004,43(4):293-300.
[9]瞿建国,申如香,徐伯兴,等.硫酸盐还原菌还原Cr(VI)的初步研究[J].华东师范大学学报(自然科学版),2005,(1):105-110.QU Jianguo,SHEN Ruxiang,XU Boxing,et al.Study on reduction of hexavalent chromium by sulfate-reducing bacteria[J].Journal of East China Normal University(Natural Science),2005,(1):105-110.
[10]FUDE L,HARRIS B,URRUTIA M M,et al.Reduction of Cr(VI)by a consortium of sulfate-reducing bacteria(SRBIII)[J].Appl Environ Microbiol,1994,60(5):1525-1531.
[11]SAHIN Y,ÖZTÜRK A.Biosorption of chromium(VI)ions from aqueous solution by the bacterium Bacillus thuringiensis[J].Process Biochem,2005,40(5):1895-1901.
[12]刘刚,李清彪.重金属生物吸附的基础和过程研究[J].水处理技术,2002,28(1):17-20.LIU Gang,LI Qingbiao.Advances in the researches on biosorption fundamentals and biosorption process[J].Technology of Water Treatment,2002,28(1):17-20.
[13]黄天培,张巧铃,潘洁茹,等.高效还原铬的苏云金芽胞杆菌菌株筛选[J].应用与环境生物学报,2010,16(6):879-882.HUANG Tianpei,ZHANG Qiaoling,PAN Jieru,et al.Screening of Bacillus thuringiensis with high chromium reducing capacity[J].Chinese Journal of Applied and Environmental Biology,2010,16(6):879-882.
[14]付祖姣,王立和,侯雁平,等.苏云金芽胞杆菌Bt 0601发酵条件的优化研究[J].激光生物学报,2008,17(6):819-823.FU Zujiao,WANG Lihe,HOU Yanping,et al.Optimization of fermentation conditions of Bacillus thuringiensis strain Bt 0601[J].Acta Laser Biology Sinica,2008,17(6):819-823.
[15]LECADET M M,CHAUFAUX J,RIBIER J,et al.Construction of novel Bacillus thuringiensis strains with different insecticidal activities by transduction and transformation[J].Appl Environ Microbiol,1992,58(3):840-849.
[16]孙长坡.苏云金芽胞杆菌G03的芽胞形成相关基因对cry基因表达的影响[D].北京:中国农业科学院,2007.SUN Changpo.Effect of sporulation genes on the expression of cry genes from Bacillus thuringiensis G03[D].Beijing:Chinese Academy of Agricultural Sciences,2007.
[17]KAMOUN F,FGUIRA I B,TOUNSI A,et al.Generation of mini-Tn10 transposon insertion mutantlibraryofBacillus thuringiensis for the investigation of genes required for its bacteriocin production[J].FEMS Microbiol Lett,2009,294(2):141-149.
[18]中华人民共和国环境保护部.GB 7467-87水质六价铬的测定.二苯碳酰二肼分光光度法[S].1987.Ministry of Environmental Protection of China.GB 7467-87 Water quality-determination of chromium(VI)-1,5 diphenylcarbohydrazide spectrotometric method[S].1987.
[19]中华人民共和国环境保护部.GB 7466-87水质总铬的测定[S].1987.Ministry of Environmental Protection of China.GB 7466-87 Water quality-determination of total chromium[S].1987.
[20]ROMANENKO V I,KORENKOV V N.A pure culture of bacterial cells assimilation chromates and bichromates as hydrogen acceptors when grown under anaerobic conditions[J].Mikrobiologiya,1977,46:414-417.
[21]CHEUNG K H,GU J D.Mechanism of hexavalent chromium detoxification by microorganisms and bioremediation application potential:A review[J].Int Biodeter Biodegr,2007,59(1):8-15.
[22]高小朋,张欠欠,许平,等.微生物还原Cr(VI)的研究进展[J].微生物学通报,2008,35(5):820-824.GAO Xiaopeng,ZHANG Qianqian,XU Ping,et al.Advances in microbial reduction of Cr(VI).Microbiology,2008,35(5):820-824.
[23]BOPP L H,CHAKRABARTY A M,EHRLICH,H L.Chromate resistance plasmid in Pseudomonas fluorescens[J].J Bacteriol,1983,155(3):1105-1109.
[24]CERVANTES C,OHTAKE H,CHU L,et al.Cloning,nucleotide sequence,and expression of the chromate resistance determinant of Pseudomonas aeruginosa plasmid pUM505[J].J Bacteriol,1990,172(1):287-291.
[25]JUHNKE S,PEITZSCH N,HÜBENER N,et al.New genes involved in chromate resistance in Ralstonia metalidurans strain CH34[J].Arch Microbiol,2002,179(1):15-25.
[26]BRANCO R,CHUNG A P,JOHNSTON T,et al.The chromate-inducible chrBACF operon from the transposable element TnOtChr confers resistance to chromium(VI)and superoxide[J].J Bacteriol,2008,190(21):6996-7003.
[27]HENNE K L,NAKATU C H T,HOMPSON D K,et al.Highlevel chromate resistance in Arthrobacter sp.strain FB24 requires previously uncharacterized accessory genes[J].BMC Microbiol,2009,9(1):199.
[28]BALAZSI G.Statistical evaluation of genetic footprinting data[J].Methods in Molecular Biology,2008,416:355-359.
[29]王晓梅,邢克智,戴伟,等.不同水系中华绒螯蟹线粒体COI基因片段的RFLP分析[J].华北农学报,2007,22(1):78-82.WANG Xiaomei,XING Kezhi,DAI Wei,et al.RFLP analysis on mitochondrial cytochrome oxidase I gene of chinese mitten crab(E.sinensis)[J].Acta Agriculturae Boreali-Sinica,2007,22(1):78-82.
[30]杨立,蔡继峰,文继舫,等.中国14省不同地区常见嗜尸性苍蝇mtDNA中COI基因序列检测[J].中南大学学报(医学版),2010,35(8):819-825.YANG Li,CAI Jifeng,WEN Jifang,et al.Sequencing of mitochondrial DNA cytochrome oxidase subunit I gene in sarcosaphagous flies from 14 provinces in China[J].J Cent.South Univ(Med.Sci.),2010,35(8):819-825.
[31]MICHEL H,BEHR J,HARRENGA A,et al.Cytochrome c oxidase:structure and spectroscopy[J].Annu Rev Biophys Biomol Struct,1998,27:329-356.
