嗜吞噬细胞无形体研究进展*
2013-11-10江佳富
江佳富
(军事医学科学院微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071)
1 病原学研究进展
嗜吞噬细胞无形体A.phagocytophilum属于立克次体目(Rickettsiales)、无形体科(Anaplasmataceae)、无形体属Anaplasma,是一种专性细胞内寄生的革兰氏阴性菌,主要寄生在粒细胞中(Dumleretal., 2001),引起反刍动物的蜱咬热(Tick-borne fever)(Niederetal., 2012)、马边虫病(Equine anaplasmosis)(Silaghietal., 2011)以及HGA(Bakkenetal., 2008)。 该病原体在欧洲、亚洲及美国分部广泛,能够感染多种哺乳动物的粒细胞,而且不同来源的病原体遗传变异较大,其生物学特性也具有很高的多样性。
1.1 病原体发现简史与分类地位
与嗜吞噬细胞无形体相关的最早记述为1932年苏格兰地区绵羊蜱咬热,但在1940年才从绵羊等体内找到其致病因子。随后,在英国、爱尔兰、斯堪的纳维亚和欧洲其他一些地方感染蜱咬热的牛、羊体内也发现了相同的致病因子。在美国也分别于1969、1982年发现了马和犬粒细胞无形体病(Woldehiwet, 2010)。长期以来,人们一直认为该病仅限于在家畜及野生动物中流行。然而,1994年,美国Chen等(1994)用PCR方法从病人身上首先发现了HGA的病原,紧接着在1996年,Goodman等(1996)利用人早幼粒细胞系在体外成功地分离出HGA的病原。2010年,我国也从东北吉林地区的羊及啮齿动物身上成功分离到了嗜吞噬细胞无形体(Zhanetal., 2010)。近些年来,随着对不同来源的、导致不同种哺乳动物HGA类似病原体的再认识,随着对该病原体独一无二的侵染能力以及在噬中性粒细胞中的复制能力的研究,再次激发了人们对其分子生物学、流行病学与病理学等方面的研究兴趣。
无形体科目前主要有3个属(无形体属Anaplasma、埃立克体属Ehrlichia、新立克次体Neorickettsia)14个种以及一个待定属(新埃立克体属CandidatusNeoehrlichia)2个种,可导致人类疾病的已知至少有6种(表1)(Woldehiwet, 2010),除了上述寄生在粒细胞中的嗜吞噬细胞无形体之外,主要还有寄生单核细胞的查菲埃立克体E.chaffeensis、侵染血小板的扁平无形体A.platys、寄生红细胞的边缘无形体A.marginales和中心无形体A.central等。其中对人致病的病原体主要包括无形体属的嗜吞噬细胞无形体、查菲埃立克体、埃文氏埃立克体E.ewingii、腺热新立克次体Neorickettsiasennetsu。近些年来,主要依据对16S rRNA基因和热休克蛋白groESL基因操纵子等序列的差异,并参考血清学交叉反应、主要免疫优势表面蛋白比较差异以及细胞嗜性,对该类病原体分类进行了新的厘定,将原埃立克体属中的E.phagocytophila、马埃立克体E.equi和人粒细胞无形体病病原因子合并成为一个单独的种——嗜吞噬细胞无形体A.phagocytophilum(Dumleretal., 2001)。但根据不同宿主来源,嗜吞噬细胞无形体可以分为很多变异株(Variant),不同变异株的抗原性存在一定差异,其区分可以依靠16S rRNA基因序列差异(Massungetal., 2006; Zhanetal., 2008; Silaghietal., 2011)。如从病人分离的嗜吞噬细胞无形体与从马和牛分离的嗜吞噬无形体的16S rRNA 基因差异仅 0.1%~ 0.2%(1~ 3 个碱基)。但这样的微小差异也可以用来鉴别来源于人类的两个HGA变异株,即AP-ha与AP-1变异株。前者致病,宿主是白足鼠Peromyscusleucopus,后者导致无症状感染,宿主是白尾鹿Odocoileusvirginianus(Massungetal., 2003; Massungetal., 2005)。
表1目前已知可导致人类疾病的无形体科的种类
Tab.1Anaplasmataceaespeciesrelatedwithhumandiseases
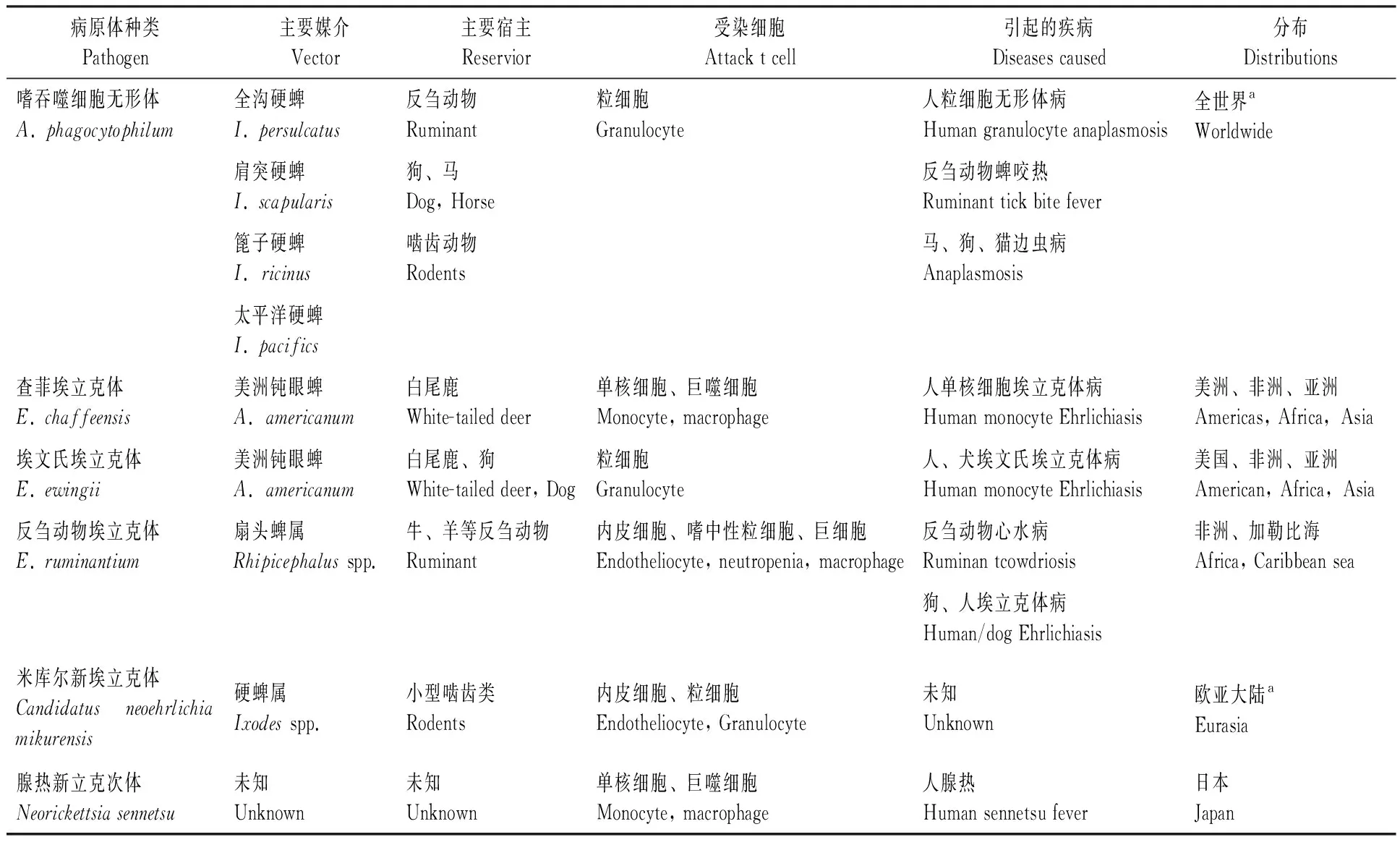
病原体种类Pathogen主要媒介Vector主要宿主Reservior受染细胞Attack t cell引起的疾病Diseases caused 分布Distributions嗜吞噬细胞无形体A. phagocytophilum全沟硬蜱I. persulcatus反刍动物Ruminant粒细胞Granulocyte人粒细胞无形体病Human granulocyte anaplasmosis全世界aWorldwide肩突硬蜱I. scapularis狗、马Dog, Horse反刍动物蜱咬热Ruminant tick bite fever篦子硬蜱I.ricinus啮齿动物Rodents马、狗、猫边虫病Anaplasmosis太平洋硬蜱I. pacifics查菲埃立克体E. chaffeensis美洲钝眼蜱A.americanum白尾鹿White-tailed deer单核细胞、巨噬细胞Monocyte, macrophage人单核细胞埃立克体病Human monocyte Ehrlichiasis美洲、非洲、亚洲Americas, Africa,Asia埃文氏埃立克体E. ewingii美洲钝眼蜱A.americanum白尾鹿、狗White-tailed deer, Dog粒细胞Granulocyte人、犬埃文氏埃立克体病Human monocyte Ehrlichiasis美国、非洲、亚洲American, Africa,Asia反刍动物埃立克体E. ruminantium扇头蜱属Rhipicephalus spp.牛、羊等反刍动物Ruminant内皮细胞、嗜中性粒细胞、巨细胞Endotheliocyte, neutropenia, macrophage反刍动物心水病Ruminan tcowdriosis非洲、加勒比海Africa, Caribbean sea狗、人埃立克体病Human/dog Ehrlichiasis米库尔新埃立克体Candidatus neoehrlichia mikurensis硬蜱属Ixodes spp.小型啮齿类Rodents内皮细胞、粒细胞Endotheliocyte, Granulocyte未知Unknown欧亚大陆aEurasia腺热新立克次体Neorickettsia sennetsu未知Unknown未知Unknown单核细胞、巨噬细胞Monocyte, macrophage人腺热Human sennetsu fever日本Japan
a我国有分布Occured in China.
1.2 病原体形态结构
嗜吞噬细胞无形体菌体呈球形、卵圆形、梭形等多种形态,直径为0.2~1.0 μm,主要寄生在粒细胞的胞质空泡内, 以膜包裹的包涵体形式繁殖,常多个菌体成串位于胞浆靠近细胞膜的部位,成簇聚集排列,每个包涵体含有数个到数十个菌体。用Giemsa法染色,包涵体在胞质内染成紫色,呈桑葚状(图1-A)。采用HL-60细胞进行分离培养时,病原体主要存在于HL-60 细胞内与膜结构相连的空泡内,生长繁殖迅速。其感染的空泡内无查菲埃立克体感染所形成的纤维样结构,早期的形态多为圆形、密度较大的网状体,后期菌体变小且密度增大,外膜比查菲埃立克体外膜有更多的皱折(图1-B)(Dumleretal., 2001)。
1.3 病原体理化特性与抗生素敏感性
由于嗜吞噬细胞无形体的专性细胞内寄生的特点,在活细胞外保存菌株唯一有效的方法是通过低温保存受感染细胞。很早的研究就证实,感染蜱咬热绵羊的血液在用甘油或者二甲基亚砜保存液中,在-79 ℃条件下,18个月后仍具有感染性。而通过梯度离心法分离的已脱离细胞的菌株在含10%的异亚丙基丙酮的蔗糖、磷酸酯盐、谷氨酸缓冲液中、-114 ℃条件下、6个月后仍有感染性(Woldehiwet, 2010)。
基于临床经验和一些实验动物的研究表明:嗜吞噬细胞无形体对土霉素和多西环素敏感,而对青霉素、氯霉素、链霉素及氨苄西林有抗性。采用HL-60细胞培养系统对从病人体内分离出的人粒细胞无形体的抗生素敏感性评估结果也确认:该病原菌对土霉素和利福平敏感(Brangeretal., 2004)。在体外实验中也发现荧光喹诺酮类药物可以抑制噬吞噬细胞无形体的繁殖。但在人体内的抑菌效果尚有争议,因为最近有报道有一粒细胞无形体病人采用左氧氟沙星治疗后病情恶化(Wormseretal., 2006)。
1.4 病原体抗原差异及其多样性
不同来源的嗜吞噬细胞无形体在致病性、宿主特异性与临床遗传学上有不同的生物学特征。早期针对不同来源嗜吞噬细胞无形体的交叉保护研究显示该病原体不同分离株之间存在高度的抗原差异,广泛的免疫异质性是其他微生物无法比拟的。人们在一项随机抽取不同来源变异株的实验中也观察到:已经感染过(或者免疫过)该病原体某变异株的动物对其他的异源变异株并不具有抵抗力。例如,感染过牛源变异株的实验动物对源于绵羊的变异株没有保护作用;甚至不同地方的同种动物来源的抗原也存在差异,例如,感染过源于芬兰牛的变异株对来源于苏格兰牛源变异株也没有保护作用,反之亦然。而采用HGA或马源EGA变异株感染牛的临床试验则未成功。根据最近一些来自周期性菌血症患者的嗜吞噬细胞无形体表面蛋白的连续变化证据,也证实了早期对感染过蜱咬热的反刍动物的观察真实地反映了嗜吞噬细胞无形体不同变异株之间的差异。感染山羊的嗜吞噬细胞无形体株系与其他的株系,尤其是引起人类疾病的Ap-ha变异株截然不同,其致病性也小于欧洲绵羊蜱咬热疾病的病原体(Woldehiwet, 2010)。
在欧洲第1例人感染的血清证据1995年在瑞士和英国被报道(Petrovecetal., 1997; Arnezetal., 2001),很快在欧洲其他地区也出现类似报道,最近几年欧洲不同地区出现HGA病例报道(Arnezetal., 2001),至目前可确立欧洲HGA病例与蜱咬热的病原体抗原性存在差异(Strle, 2004)。利用SDS-PAGE分析和蛋白质印记法也证明:来源于人血中用HL-60细胞分离出的HGA六个变异株的主要抗原蛋白同样存在差异(Inokumaetal., 2003)。在美国,以白尾鹿为野生动物宿主的、对人不致病的Ap-1变异株在实验室条件下可以感染山羊,但不能感染啮齿动物。相反,以白足鼠为野生动物宿主、对人致病的Ap-ha变异株可以感染小鼠,却不能感染白尾鹿(Massungetal., 2003; Massungetal., 2005)。不过,也有不同来源变异株抗原性相似的报道,例如有研究揭示感染过HGA变异株的马源变异株有抵抗力。实验室条件下,北美洲HGA病原体则会引起狗和马发病,但并没有使出现临床症状。但在自然条件下HGA变异株是否会引起家养反刍动物发病并不清楚。此外,在野生动物中同样存在大量抗原多样性的变异株系。棉鼠来源变异株的表面蛋白质msp2基因与美国病人、狗及黑熊等来源变异株的msp2基因不同(Rymaszewska, 2010)。
高职院校的专业结构的设置需要根据办学定位及时掌握区域产业的人才需求的变化,主动对接企业、服务区域经济发展,根据产业的人才需求、自身的办学条件和办学经验有目的的进行专业结构的设置,明确专业结构的设置。
不同来源的嗜吞噬细胞无形体病毒在致病性、宿主特异性与临床遗传学上有不同的生物学特征(Raretal., 2011)。早期针对不同来源嗜吞噬细胞无形体的交叉保护研究显示该病原体不同分离株之间存在高度的抗原差异,一般认为,这些所观察到的一些抗原的变异是由于编码主要外膜蛋白的共生同源基因的差异表达导致的。嗜吞噬细胞无形体的44 kDa 外膜蛋白基因全长1 333 bp, 编码439个氨基酸。但是,该病原体的染色体上有多个与44 kDa 外膜蛋白基因同源的基因, 存在一个44 kDa 外膜蛋白基因家族。采用嗜吞噬细胞无形体感染血清筛选该病原体的基因文库, 发现该病原体的160、130和100 kDa 等3个大分子抗原蛋白基因。另外, 生物素标记嗜吞噬细胞无形体的蛋白质组分析也发现Asp62、Asp55、P44、Omp85、Omp-1A 等5 个主要表面蛋白, 其中前两个能够与HGA 患者血清识别。这些蛋白均在一定程度上形成了嗜吞噬细胞无形体抗原的差异。
1.5 病原体基因组结构
嗜吞噬细胞无形体全基因组有一个环形的染色体,基因组为1 471 282 bp, G+ C含量为41.6%, 含有1 369个编码框(ORF),包含一个核糖体RNA的操纵子,很多基因编码一些未经证实的或者特征不明确的蛋白。该基因组经过多次减数进化已经丢失许多功能基因, 因此该病原体必须依赖宿主细胞生长、繁殖。但是,其仍具有核苷酸、维生素、辅因子生物合成基因以及、msp2特征性基因、AnkA 基因及编码外膜蛋白P44、HGE-14以及HGE-2 抗原蛋白的基因。此外,由于OMP-1基因家族数量的增加,负责细胞膜合成的基因片段显著降低。主要表面蛋白是与致病机制相关的重要蛋白,很多属于OMP-1/MSP2/P44 家族。由于相应蛋白的抗原变异,这些蛋白家族的丰度促进了病原体在脊椎动物宿主中的持续存在,并有效地将病原体传播给媒介蜱(Nelsonetal., 2008)。
2 嗜吞噬细胞无形体的生态学特征研究进展
2.1 宿主动物
嗜吞噬细胞无形体宿主动物种类较多,多种家畜、野生大型哺乳动物、啮齿动物以及鸟类均可作为嗜吞噬细胞无形体的宿主,并可在一定条件下造成对人的感染。
2.1.1家畜:在欧洲,嗜吞噬细胞无形体导致的蜱咬热是家畜中分布最广泛的蜱媒传染病。在挪威每年确认成百上千的绵羊被该病原体感染。在英国高地牧区,38%的成年绵羊中检测出感染嗜吞噬细胞无形体(Woldehiwet,2010)。该病原体通过在蜱—反刍动物的循环中得以长期保存,成为持续传播的重要宿主动物。在美国,牛羊等也是重要的宿主动物,且感染后可维持长达2年。马来源的嗜吞噬细胞无形体(之前称马埃立克体)最早在美国加州被发现(Von Loewenichetal., 2003),后来在佛罗里达、科罗拉多、新泽西和康涅狄格以及欧洲斯堪的纳维亚、瑞士和英国的马群中均有发现,同样是重要的宿主动物和传染源。1971年在美国发现狗也能被嗜吞噬细胞无形体感染致病(Ewingetal., 1971)。后来发现该病原体导致的狗粒细胞无形体病在斯堪的纳维亚和英国也一样分布广泛(Woldehiwet, 2010)。
在我国东北吉林、华中、西南等牧区的羊群同样也是嗜吞噬细胞无形体重要的宿主动物和传染源(Zhanetal., 2010; 李静等, 2011; 李娟等, 2011; Yangetal., 2012; Zhangetal., 2012)。犬中也检测到了吞噬细胞无形体(Xiaetal., 2012)。
家畜中的嗜吞噬细胞无形体与人源的虽然存在一定的抗原差异,但不管是在急性感染还是慢性感染阶段,这些家畜动物持续的菌血症对于嗜吞噬细胞无形体在自然情况下的存活是至关重要的。
2.1.2野生大型哺乳动物:在欧洲以及澳大利亚,多种鹿科动物,如狍Capreoluscapreolus、马鹿Cervuselaphus和岩羚羊Rupicaprarupicapra是重要的贮存宿主。在斯洛文尼亚,狍子中的嗜吞噬细胞无形体抗体和阳性率分别高达94.1%和85%,幼狍还可出现致死感染(Woldehiwet,2010)。在美国,浣熊Procyonlotor(Duganetal., 2005)、白尾鹿(Tateetal., 2005)也是重要的带菌者,感染后持续时间长,为重要传染源。在我国,野生大动物宿主还未见报道。
2.1.3啮齿动物:虽然与反刍动物相比,啮齿类动物的菌血症症状轻,生活史也较短,但啮齿类动物是该病原体公认最重要的贮存宿主,而且不同变异株的宿主倾向性非常明显。
2.1.3.1国外报道的主要啮齿动物宿主:在美国,HGA-ha变异株的主要啮齿类宿主均是肩突硬蜱I.scapularis分布区的脊椎动物宿主,包括白足鼠、灰松鼠Sciuruscarolinensis等。另外,刺须硬蜱I.spinipalpis的脊椎动物宿主,包括棉鼠Neotomaspp.、鹿鼠Peromyscusmaniculatus、草原田鼠Microtusochrogaster、花松鼠Tamiasspp.都可能是HGA-AP1变异株的贮存宿主(Woldehiwet, 2010)。而在美国西部,太平洋硬蜱I.pacificus分布区的暗足林鼠Neotomafuscipes,血清阳性率为17%~80%,是重要的宿主。同样,金花鼠Tamiasochrogenys也是重要的宿主,其能够被马来源的无形体MRK变异株感染并通过太平洋硬蜱传播给裸鼠。在欧亚大陆,堤岸田鼠Myodesglareolus、普通田鼠Microtusarvalis、黑田鼠M.agrestis与根田鼠M.oeconomus、小林姬鼠Apodemussylvaticus、黄喉姬鼠A.flavicollis和普通鼩鼱Sorexaraneus均可自然感染嗜吞噬细胞无形体。而田鼠的感染率高于姬鼠。如在瑞士,堤岸田鼠为19.2%,姬鼠仅为2.9%~4.2%;在德国两者分别为13.4%和0.5% (Woldehiwet, 2010)。
2.1.3.2我国主要啮齿动物宿主:在我国,目前已明确:吉林、浙江、云南与贵州等省区多种鼠类,如朝鲜姬鼠Apodemuspeninsulae、黑线姬鼠A.agrarius、西伯利亚花鼠Tamiassibiricu、棕背Clethrionomysrufocanus、大仓鼠Tscherskiatriton、社鼠Niviventerconfucianus、刺鼠N.coxingi、黄毛鼠Rattuslosea、褐家鼠R.norvegicus)及野兔中存在嗜吞噬细胞无形体的自然感染(Caoetal., 2006; Zhanetal., 2007;Zhanetal., 2008)。其中从大仓鼠中分离到了病原体(Zhanetal., 2010)。而在实验BALB/c小鼠中,观察到菌血症可以持续9至周,有的达到14个月,说明小鼠有能力充当宿主(Levinetal., 2004)。
2.1.4鸟类:有报道指出,在瑞典,吸食迁移鸟类血液的篦子硬蜱I.ricinus若虫也可以感染嗜吞噬细胞无形体。美国的两种鸟—知更鸟Turdusmigratorius和画眉鸟Catharusfuscescens可通过感染肩突硬蜱的吸血而携带嗜吞噬细胞无形体(Danielsetal., 2002)。但是鸟类是否是嗜吞噬细胞无形体的潜在贮存宿主尚不能确定,如果鸟类是贮存宿主,那么他们鸟类在感染蜱的传播方面将起着重要的作用。
不同地区嗜吞噬细胞无形体的宿主有一定的区别,感染率也往往也不同,而且具有严格的宿主倾向性,不过,具有宿主倾向性的不同分离株可以在同一个场所贮存传播。
2.2 蜱传播媒介
嗜吞噬细胞无形体主要通过蜱叮咬传播,但在特定条件下,密切接触患者的体液也可导致感染,通过围产期传给新生婴儿以及通过输血传播给受血者也是需要注意和警惕的传播途径。
当蜱叮咬携带病原体的宿主动物后(有的经期传递给下一代虫期),再叮咬人时,病原体可随之进入人体而引起发病。目前已证明嗜吞噬细胞无形体的传播媒介主要硬蜱属的种类,但世界不同地区的优势传播媒介种类有着差异。
2.2.1美国嗜吞噬细胞无形体的主要传播媒介蜱:在美国,媒介蜱主要包括东北部、中西部HGA主要流行区的肩突硬蜱I.scapularis、加利福尼亚等西部流行区的太平洋硬蜱I.pacificus、东部流行区的刺须硬蜱I.scapularis(Telfordetal., 1996)。寄生于白足鼠的肩突硬蜱活动期与HGA流行区高峰期变化相吻合, 且可以同时携带致病性的Ap-ha变异株和非致病的Ap-1变异株,并在实验室条件下被证明其是嗜吞噬细胞无形体的重要传播媒介。太平洋硬蜱主要传播导致马发病的嗜吞噬细胞无形体变异株,其若虫的媒介传播效能已被证实高于刺须硬蜱的传播能力(Barloughetal., 1997)。
2.2.2欧洲主要传播媒介蜱:在欧洲,蜱咬热无形体株主要传播媒介是蓖子硬蜱I.ricinus(Stuen, 2007)。爱丁堡Moredun研究所通过一系列的实验确定了其传播的方式,病原体在是蓖子硬蜱中经期传递(即从幼虫至若虫、从若虫至成虫),并在感染蜱中可以存活一年以上,一直持续到发现新的宿主。在不同的地理区域,蓖子硬蜱的感染率不同,相比于成虫和幼虫,若虫的感染率更高。在蓖子硬蜱没有分布的英国其他一些羊蜱咬热流行地区,刻点血蜱Haemophysalispunctata也有可能是媒介(Woldehiwet,2010)。最近也有研究指出,在英国的平原田鼠Microtusagrestis分布区,硬蜱I.trianguliceps在啮齿类动物嗜吞噬细胞无形体的传播过程中起着重要作用(Ogdenetal., 1998),在俄罗斯的波罗的海的一种硬蜱I.trianguliceps中也检测出嗜吞噬细胞无形体(Kolchanovaetal., 2011)。该蜱在不同地区、不同季节的感染率也存在差异,在挪威、意大利局部地区感染率分别达到17%和24%。在葡萄牙I.ventalloi蜱检测到嗜吞噬细胞无形体(Woldehiwet, 2010)。不过,该种蜱主要生活在鸟巢中,对于人类的传播意义可能不大。
2.2.3我国及亚洲其他地区的主要传播媒介蜱:在我国、俄罗斯远东地区、日本、韩国的主要媒介蜱是全沟硬蜱I.persulcatus(Woldehiwet, 2010)。在我国新疆、内蒙、黑龙江等地, 全沟硬蜱阳性率在0.8%~6.3%之间(Caoetal., 2000; Caoetal., 2006; Jiangetal., 2011)。另外,我国东北以及华北地区森林革蜱Dermacentorsilvarum、草原革蜱D.nuttalli、嗜群血蜱H.concinna、长角血蜱H.longicornis也可自然感染嗜吞噬细胞无形体(Caoetal., 2000; Jiangetal., 2011)。不过,我国目前全沟硬蜱分布的北方地区报道病例不多,大多数报告病例发生在中东部(程周祥等, 2009; 朱有等, 2010),这些地区大部分没有全沟硬蜱分布的报道,但由于目前我国病人中的HGA病原可参考基因序列的信息有限,追踪病人感染变异来源的信息也不多,哪种蜱在哪个地区是导致人群患HGA的重要媒介还需要进一步调查研究。
一般认为,硬蜱属Ixodes不能经卵传递嗜吞噬细胞无形体。但有研究发现,来源于明尼苏达州白尾鹿的白纹革蜱D.albipictus携带的另一个嗜吞噬细胞无形体变异株(不同于美国AP-1和AP-ha株)可以将病原体经卵传递给其子代幼虫,感染率达到 10%~40%。不过,该F1子代经继续饲养得到F2代幼虫时,未能观察到病原体继续经卵传递(Baldridgeetal., 2009)。这在一定程度上说明自然界中嗜吞噬细胞无形体循环不仅仅依靠平行传播。
2.3 其他传播方式
除了媒介蜱之外,直接接触危重病人或带菌动物的血液等体液,有可能会导致传播。据报道,在美国一个屠宰场有3名工人因接触鹿血经伤口感染了无形体病。我国某医院在2006年发生1 起因密切接触原发患者导致9例HGA聚集性暴发感染事件。其中5 例为原发病死患者的家属,4 例为参与抢救首发患者的医务人员。通过回顾性流行病学调查,9 例患者均无蜱咬史,均在首发患者大出血抢救时段接触过患者的血液及分泌物(Zhangetal., 2008)。提示含有人粒细胞无形体的血液可通过皮肤破口、黏膜直接在人与人之间进行传播,成为不容忽视的重要传播风险。但是,这种人与人传播机制是该病原体本身固有存在?还是在中国医疗及公共卫生特定背景下所发生的特殊案例?还是因不同地理环境分离株毒力变异所致的致病机制发生改变?均是需要进一步深入调查研究的领域。此外,美国对一家医院的6名患有HGA的孕妇的随访研究发现,一名新生婴儿通过围产期传播感染了无形体,说明了存在母婴垂直传播的可能性(Dhandetal., 2007)。目前全世界还报道了4例经输血传播HGA的患者,均发生在美国(Jerebetal., 2012)。
3 人群中嗜吞噬细胞无形体感染流行特征、临床特点和治疗要点
3.1 感染流行特征
人群对嗜吞噬细胞无形体普遍易感,各年龄组均可感染发病。嗜吞噬细胞无形体感染人群主要为成年人,但也有新生儿在围产期被感染的报道。美国HGA患者年龄43~60岁。我国的资料显示:该病发病年龄最大为78 岁,最小19 岁,发病最多的是50~59 岁人群。男女两性均可发生感染。在美国,HGA男性患者为女性的2倍(Dumleretal., 2007)。而在我国,目前不同地区男女HGA患者略有差异,总体女性高于男性2倍多,可能是由于暴露和感染机会不同所致。从事各种不同职业均可以感染,在我国,发病率以农民最高。占到90%以上。其次为其他接触蜱等传播媒介的林业工人、居民、劳动者、旅游者以及医护人员。研究也表明:虽然有的HGA患者感染后抗体持续可达3年,再感染的报道少见,但是,HGA患者对于重复感染仍然比较敏感,不过之前的感染可以降低再次感染时菌血症的水平和持续时间。目前,大多数HGA确诊病人发生在美国。已有21 个州发现HGA,从2003年至2010年,全美报告HGA病例4 545人。大多数病人分布在东北部,中西部和西海岸仅有零散病人。在欧洲,HGA感染率较低,首例病人1997年报道于斯洛文尼亚,目前遍及欧洲大多数国家,但确认病例仅60余人(Strle, 2004)。尽管嗜吞噬细胞无形体的变异株在英国蓖子硬蜱间广泛传播,但至今,人群中还没有这个变异株相关疾病的病例出现。加拿大与俄罗斯也只有零星的病人。在我国,2006年以来,报道的确诊病人100余人,主要集中在河南、湖北、安徽、山东、浙江等浅山区与丘陵地带。
但是,虽然确诊病例较少,但是人群中抗体阳性率较高。如在美国,主要的疫区之一的威斯康辛西北部有近期蜱咬史的健康人群中无形体抗体阳性率为14.9%。在康涅狄格州,一般人群中无形体抗体阳性率也达到15.9/百万,纽约州的为2.7/百万。在欧洲的一些流行地区,大约有2%~28%的人群有HGA 的抗体。我国一份针对天津地区从事畜牧业及农业生产的部分高危人群的研究显示,HGA的血清流行率为8.8%。而针对福建武夷山地区、山西的低山丘陵区的林业工人、羊倌、猎户等高暴露人群的调查,抗体阳性率高达20%(Kuriakoseetal., 2012)。不过,人群发病率却如此之低,很有可能是一些非致病性的变异株在这些人群中循环,也可能存在其他的一些病原体的交叉反应。
3.2 主要临床特征 (Bakken et al., 2008)
根据临床研究总结,大部分HGA患者感染后临床表现轻微或无症状,少量重症患者。常见临床表现为急性高热、头痛、肌痛、不适、萎靡不振、寒战,其次为厌食、恶心、关节痛、咳嗽,少数出现腹痛、腹泻、神志变化和皮疹。未经治疗者病程持续6~60 d,大多数患者1~2周内甚至在没用有效抗菌药物前就自行恢复。少数患者(5%~7%)可出现严重的并发症,包括脓毒休克样综合征、凝血功能异常、出血、肺部感染、急性呼吸窘迫综合征、横纹肌溶解、心肌炎、急性肾衰竭、臂丛神经病变、颅神经病变、脱髓鞘性多发性神经病及机会性感染等。部分患者可表现为非典型性肺炎,少数患者出现多脏器功能损害。继发HGA的机会性真菌或病毒感染及出血等可致HGA患者死亡,这些条件致病菌包括部隐球菌Cryptococcuspneumonia、食管念珠菌Candidaesophagitis、食道疱疹病毒Herpesesophagitis、入侵性肺部曲霉菌Pulmonaryaspergillosis。急性呼吸窘迫综合征或/和急性肾衰是HGA 患者死亡的主要原因, 死亡多见于有继发感染的老年患者。HGA在临床上很容易漏诊误诊,对有类似于感冒症状的发热病人, 特别是有血小板减少和白细胞减少, 并有蜱接触史者, 应当考虑到HGA。HGA需与其他的蜱媒病原体所致的发热性疾病相鉴别以及其他一些非蜱媒病相鉴别。
3.3 治疗要点
HGA 的治疗首选强力霉素, 其他四环素类药物也有效。临床上应及早使用抗生素,避免出现并发症。对疑似病例可进行经验性治疗。一般慎用激素类药物,以免加重病情。体外药物敏感试验嗜吞噬细胞无形体除对强力霉素敏感外, 利福平、环丙沙星、氧氟沙星等药物也有好的杀伤作用。一般治疗是,患者宜卧床休息,进食易消化的食物,补充能量并摄入适量的维生素和水分,保持液体出入量平衡,注意口腔卫生。高热时以物理降温为主,慎用退热药。病原治疗,强力霉素为首选药物,应早期、足量使用。一般病例口服即可,重症患者可考虑静脉给药。口服四环素有效,但四环素毒副作用较多,孕妇和儿童慎用。强力霉素或四环素治疗疗程不少于7 d。一般用至退热后至少3天,或白细胞及血小板计数回升,各种酶学指标基本正常,症状完全改善。早期使用强力霉素或四环素等药物,一般可在24~48 h内退热。因HGA临床表现无特异性,尚缺乏快速的实验室诊断方法,可对疑似病例进行经验性治疗,一般用药3~4 d仍不见效者,可考虑排除HGA的诊断。对强力霉素过敏或不宜使用四环素类抗生素者,选用利福平。氧氟沙星等虽然有一定抗菌活性,但目前临床尚无应用报道。此外,对症支持治疗、隔离及防护也非常重要。
4 嗜吞噬细胞无形体感染预防控制
粒细胞无形体病是新发的人兽共患传染病,发病率低,虽然容易误诊、漏诊,但在确诊后使用抗生素可以进行有效治疗。采取针对性的防控对策与措施至关重要。除了加强健康教育、做好个人物理、化学防护,避免蜱叮咬、提高医疗卫生员诊疗生水平之外,控制媒介传播与宿主动物、加强疫情监测尤为重要。针对新发散发病例/聚集性病例,组织专业人员,针对包括疑似、临床诊断、实验室确诊的散发病例,以及在同一村庄,或在同一山坡、树林、茶园、景区等地劳动或旅游的人员中,2周内出现2例及以上HGA(疑似)病例,或在病例的密切接触者中出现类似病例的聚集性病例,开展流行病学调查,追溯可能的感染来源,调查传播途径及相关影响因素,对于该病的深入研究,及时提出有针对性的预防控制措施至关重要。此外,有条件的地区疾病预防控制机构以及相关的科研机构,主动根据疫情特点,组织开展人群血清流行病学、宿主动物和传播媒介等方面的专题监测,了解HGA疫区人群感染状况及抗体水平,了解HGA主要的潜在传播媒介的种类、分布及带菌状况,了解HGA常见的动物宿主种类、分布及带菌状况,为该病的防制对策和措施提供依据,也尤为重要。
5 结语
总之,作为一种新发人兽共患病原体,嗜吞噬细胞无形体虽然已经被研究了70余年,但是也仅仅是在1994年发现首例HGA之后,才激起了人们对这种有极大吸引力的病原菌再一次的兴趣。对该病原体入侵粒细胞独一无二的能力的认识也吸引了科学家们把此作为研究通过嗜中性粒细胞杀灭病原菌的机制的手段。从而大大促进了人们对于该病原体分子生物学、流行病学以及致病机制方面的研究。但是,在这些有限的领域,仍然还有很多方面需要进一步的研究,例如,嗜吞噬细胞无形体是怎样从媒介蜱取食的地方侵染到其他的地方,然后在这个地方进行繁殖形成菌血症。另外,持续感染的机制、抗原的异质性也是目前的研究热点。嗜吞噬细胞无形体宿主动物如此广泛,某一种宿主来源的变异株能否感染另一种宿主仍然不清楚,它们之间的遗传差异尚需进一步研究。
在我国,目前还缺乏人源的分离株,成为检测、诊断、疫苗研制以及预防控制的一个瓶颈问题。虽然2008年卫生部颁发了《人粒细胞无形体病的临床诊断(HGA)指南(试行)》。但是,目前在临床上,HGA的诊断困难仍然较大,尤其是很多收治该病的一线医院大多在山区偏远的地方,在实验室检测技术力量方面匮乏,无形体病临床诊断还没有符合我国病人情况的关键鉴别特征,经常出现误诊和漏诊的情况,给广大HGA患者带来巨大的威胁。我国人感染无形体的诊断还需要推广应用有效的实验室诊断方法和试剂盒。另外,在较早发现宿主、媒介携带无形体的一些区域,例如东北地区,目前仍然很少有明确的无形体病例报道;在已经发现病例的地方,追踪病例的传染源等资料也很匮乏,尚需补充宿主和媒介等方面的调查,弄清其来源。全国本底方面的调查也需进一步展开,以掌握其疫源地典型特征。
