周剂量紫杉醇联合S-1治疗晚期胃癌的临床观察
2013-11-09马天江陈素华
马天江 赫 欣 陈素华
漯河市中心医院肿瘤科(漯河医学高等专科学校第一附属医院肿瘤科),河南漯河 462000
周剂量紫杉醇联合S-1治疗晚期胃癌的临床观察
马天江 赫 欣 陈素华
漯河市中心医院肿瘤科(漯河医学高等专科学校第一附属医院肿瘤科),河南漯河 462000
胃癌是我国最常见的消化系统恶性肿瘤,随着生活水平的提高和生活方式的改变,发病率和病死率有所下降,但仍居各种恶性肿瘤的首位,且临床确诊时多为晚期,其中Ⅳ期约占1/3,Ⅰ~Ⅲ期行根治切除术后约半数出现复发、转移,即胃癌患者约有80%以上为晚期患者,所以联合化疗在胃癌的治疗中占据重要地位。胃癌的化疗至今仍缺乏公认的金标准方案。随着一些新药的临床使用,临床疗效得到了提高,自2009年6月—2010年12月,本科使用周剂量紫杉醇联合替吉奥(S-1)治疗晚期胃癌取得良好近期疗效,现报告如下。
1 资料与方法
1.1 一般资料
搜集2009年6月—2010年12月本科收治的经组织病理学或细胞学检查确诊为晚期胃癌的患者26例,其中男18例,女8例,年龄37~72岁,低分化腺癌11例,中分化腺癌6例,黏液腺癌5例,印戒细胞癌3例,管状腺癌1例。所有患者均失去手术或再次手术治疗机会,其中初治11例,复治15例,复治患者都曾接受过5-Fu/LV、DDP等药物化疗。肝转移8例,腹腔淋巴结、腹膜转移13例,左锁骨上淋巴结转移7例,肺转移5例,局部复发4例,伴有少量胸腔和(或)腹腔积液者4例。所有患者均客观评价病灶,Karnofsky评分≥60分,血常规、肝肾功能及心电图基本正常,预计生存期≥3个月,复治时间距离末次治疗1个月以上。
1.2 治疗方法
紫杉醇75 mg/m2,静脉滴注3 h,第1、8天。用药前均给予地塞米松、西米替丁及苯海拉明。S-1胶囊 40 mg/m2,口服,2次/d,连用14 d。同时给予止吐及辅助治疗,每21 d为1个周期。所有病例均行2个周期以上化疗。
1.3 评定标准
疗效评定以影像学(MRI、CT、胸部X平片、B超等)资料作为依据,根据WHO实体瘤疗效评价标准进行疗效评估:完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD);有效率(RR)=(CR+PR)×100%;临床获益率CBR=CR+PR+SDgt;6个月。毒副作用按WHO抗癌药物不良反应评价标准评价。
1.4 统计学处理
采用SPSS 14.0统计软件,计数资料比较采用χ2检验,以Plt;0.05为差异有统计学意义。
2 结果
2.1 临床疗效
全组26例均可评价疗效,其中CR 3例(11.5%),PR 15例(57.7%),SD 6例(23.1%),SDgt;6个月4例(15.4%),PD 2例(7.7%);RR为69.2%,CBR为84.6%。初治11例中,CR 2例(18.2%),PR 7例(63.6%),SD 2例(18.2%),SDgt;6个月2例(18.2 %);RR为81.8%,CBR为100.0%。复治15例中,CR 1例(6.7%),PR 8例(53.3%),SD 4例(26.7%),SDgt;6个月2例(13.3%),PD 2例(13.3%);RR为60.0%,CBR为73.3%。
2.2 毒副作用
最常见的不良反应主要为骨髓抑制、消化道反应、脱发等。白细胞减少总发生率为76.9%,其中Ⅲ~Ⅳ度白细胞下降占15.4%;血小板减少发生率为19.2%,均为Ⅰ~Ⅱ度;经对症治疗后均能恢复正常,不影响化疗进程。消化道反应主要表现为恶心、呕吐、腹泻等,其中多为Ⅰ~Ⅱ度。肝功能损伤发生率为34.6%,均为轻度损伤;经保肝治疗后均能恢复正常,不影响化疗进程。脱发发生率为53.8%,主要为轻中度脱发。见表1。
3 讨论
胃癌是我国最常见的消化系统恶性肿瘤,随着生活水平的提高和生活方式的改变,发病率和死亡率有所下降,但仍居各种恶性肿瘤的首位。手术是胃癌首选治疗方法,但临床诊断确诊时多为晚期,其中Ⅳ期约占1/3,Ⅰ~Ⅲ期行根治切除术后2年内约半数出现复发、转移[1],即胃癌患者约有80%以上为晚期患者,所以联合化疗在胃癌的治疗中占据重要地位。胃癌的化疗至今仍缺乏公认的金标准方案。传统含5-Fu为主的化疗方案有效率在30%~50%之间[2]。近年来,随着一些新药的临床使用,对胃癌的治疗取得了一定的进展。
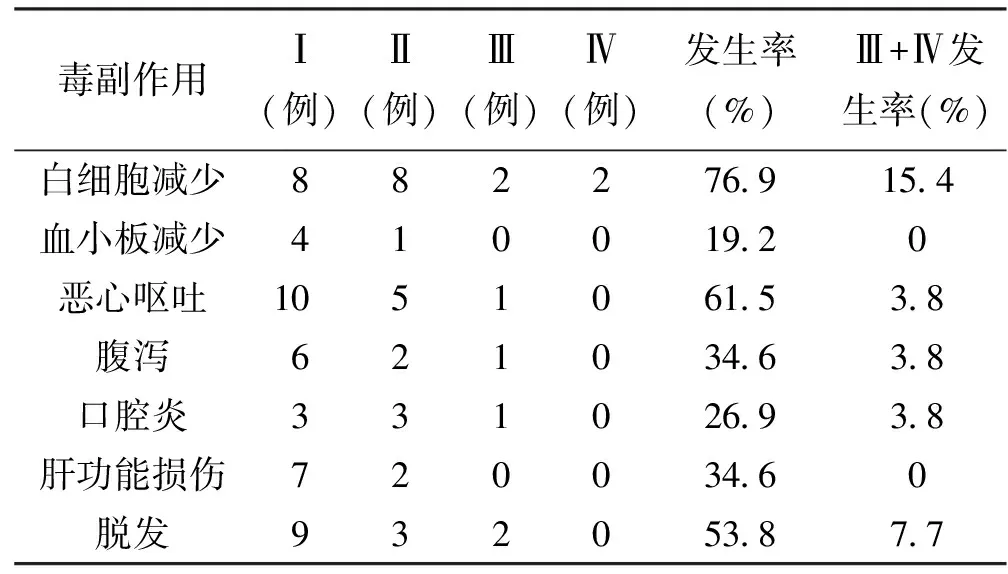
表1 周剂量紫杉醇联合S-1治疗晚期胃癌的毒副作用
紫杉醇是紫杉类抗癌新药,是从短叶紫杉中提取的有效成分。它能特异地结合到小管的β位上,导致微管聚合成团块或束状,并使其稳定,从而抑制微管网的正常重组。体外实验[3]显示,其对胃癌细胞具有诱导凋亡的作用。近年有些学者[4-7]已将其用于晚期胃癌的化疗,其对胃癌单药有效率为17.0%~22.2%;与5-Fu联合治疗胃癌有效率为32.0%~65.5%。
S-1最早在日本研发上市,1999年被批准用于晚期胃癌的治疗。S-1是一种新型氟尿嘧啶类口服复方胶囊制剂,该药主要由替加氟和两种生化调节剂吉美嘧啶、奥替拉西按1.0:0.4:1.0摩尔比组成,其中替加氟是5-Fu的前体药物,具有优良的口服生物利用度,能在体内转化为5-Fu而发挥抗肿瘤作用,其化疗指数为5-Fu的2倍,毒性仅为5-Fu的1/4~1/7;吉美嘧啶可抑制在二氢嘧啶脱氢酶(DPD)作用下从替加氟释放出来的5-Fu的分解代谢,使5-Fu在血浆和肿瘤组织中更长时间地保持稳定的血药浓度,从而取得与5-Fu持续静脉输注类似的疗效,增强抗肿瘤活性;奥替拉西能够阻断5-Fu的磷酸化,口服给药之后,奥替拉西在胃肠组织中具有很高的分布浓度,从而影响5-Fu在胃肠道的分布,进而降低5-Fu在胃肠道的毒性及不良反应,减少5-Fu对消化道黏膜的损害等毒副作用可达80%以上[8]。由这两种生化调节剂组成的替吉奥发挥作用使患者体内能够得到较高的5-Fu血药浓度,提高抗癌活性同时降低了药物的消化道毒性。
对于紫杉醇治疗消化道肿瘤的最佳给药方案,目前正在研究和探讨。有学者认为,紫杉醇每周给药的方案可延长该药与肿瘤的累积接触时间并提高剂量强度,同时其常见的严重毒副作用,如骨髓抑制及神经毒性明显降低。文献[9-11]也显示,紫杉醇类药物作用时间是决定其细胞毒作用的重要因素,延长低浓度紫杉醇类药物(0.01 μmol/L)持续时间同样能达到细胞内毒性作用,这样的浓度在人类通过持续灌注(96 h)或每周给药方式均可达到。
基于上述观点,笔者拟定周剂量紫杉醇联合S-1化疗方案用于晚期胃癌的化疗,其有效率高达69.2%,在曾经5-Fu加DDP或MMC或HCPT化疗失败的15例患者中有效率仍高达60%,同时其毒副作用轻微,白细胞减少总发生率为76.9%,其中Ⅲ~Ⅳ度白细胞下降仅占15.4%,经对症治疗后均能恢复正常,不影响化疗进程;消化道反应主要表现为恶心、呕吐、腹泻等,其中多为Ⅰ~Ⅱ度,Ⅲ度以上恶心、呕吐仅1例,腹泻亦仅1例;脱发发生率为53.8%,主要为轻中度脱发。因此,本方案为目前临床上胃癌化疗方案中疗效高、安全性好的方案之一。
综上所述,周剂量紫杉醇联合S-1化疗方案是晚期胃癌治疗的一种有效、安全的方案,尤其适用于一般情况较差者及老年患者,值得临床推广应用。
[1]周际昌.实用肿瘤内科学[M].2版.北京:人民卫生出版社,2003:591-592.
[2]汤钊猷.现代肿瘤学[M].2版.上海:上海医科大学出版社,2000:729-730.
[3]陈凌翔,陈嘉,黄富麟.紫杉醇诱导胃癌细胞凋亡及对端粒酶活性调节的关系[J].临床消化病杂志,2001,13(6):243-245.
[4]AJANI JA,FAIRWEATHER J,DUMAS P,et al.Phase Ⅱ study of Taxol in patients with advanced gastric carcinoma[J].Cancer J Sci Am,1998,4(4):269-274.
[5]CASCINU S,GRAZIANO F,CARDARELLI N,et al.Phase Ⅱstudy of paclitaxel in pretreated advanced gastric cancer[J].Anticancer Drugs,1998,9(4):307-310.
[6]BOKEMEYER C,LAMPE CS,CLEMENS MR,et al.A phase Ⅱ trial of paclitaxel and weekly 24h infusion of 5-fluorouracil/folinic acid in patients with advanced gastric cancer[J].Anticancer Drugs,1997,8(4):396-399.
[7]MURAD AM,PETROIANU A,GUIMARAES RC,et al.Phase Ⅱ trial of the combination of paclitaxel and 6-fluorouracil in the treatment of advanced gastric cancer:a novel,safe,and effective regimen[J].Am J Clin Oncol,1999,22(6):580-586.
[8]张煜,马力文.S-1在胃癌中的研究进展[J].癌症进展,2010,8(2):148.
[9]SEIDMAN AD,HUDIS CA,ALBANEL J,et al.Dose-dense therapy with weekly 1-hour paclitaxel infusions in the treatment of metastatic breast cancer[J].J Clin Oncol,1998,16(10):3353-3361.
[10]LOPES NM,ADAMS EF,PITTS TW,et al.Cell kinetics and cell cycles effects of Taxol on human and hamster ovarian cell lines[J].Cancer Chemother Pharmaco,1993,32(3):235-242.
[11]JORDAN MA,WENDELL K,GARDINER S,et al.Mitotic block induced in HeLa cells by low concentration of paclitaxel(Taxol)results in abnormal mitotic exit and apoptotic cell death[J].Cancer Res,1996,56(4):818-825.
10.3969/j.issn.1674-4616.2013.04.010
2013-05-02
