姜黄素协同阿霉素抑制乳腺癌细胞生长的作用及其机制
2013-11-08曾宪阳
杨 光,杨 宇,曾宪阳
乳腺癌是女性最常见的恶性肿瘤之一[1]。全世界每年约有120 万妇女患乳腺癌,50 万妇女死于乳腺癌,其发病率在世界范围内呈明显上升趋势。全球范围内,北美和欧洲地区是乳腺癌高发区,其总体趋势为发达国家明显高于发展中国家。我国属于乳腺癌低发国家,但近年来沿海大城市的发病率及病死率都有所升高。目前乳腺癌的治疗已从原始简单的手术切除发展到现代的综合全身治疗,患者生存率已显著提高。在现代乳腺癌临床治疗中,化疗起到重要作用[2]。以阿霉素(ADM)为代表的蒽环类抗生素,是乳腺癌的重要化疗药物。然而,近年来研究表明ADM 在乳腺癌治疗中的耐药现象经常出现,这严重束缚了ADM 在临床上的应用[3]。因此,寻找与ADM 有互补作用的药物和其联用,可以为治疗乳腺癌提供重要方法。姜黄素已被证明可以敏化多种化疗药物[4],然而姜黄素是否可以敏化ADM治疗乳腺癌还鲜有报道,本研究拟在观察姜黄素与ADM 联合对人乳腺癌细胞增殖和凋亡的影响,探讨两者之间的相互作用关系,以期为临床联合用药提供实验依据。
1 材料与方法
1.1 材料 人乳腺癌MCF-7 细胞及MDA-MB-231 细胞购于中国医学科学院肿瘤细胞库;RPMI1640 培养液和小牛血清购于GIBCO 公司;姜黄素,ADM 和噻唑蓝(MTT)购于美国Sigma 公司,其中姜黄素和ADM 用二甲基亚砜(DMSO)溶解,-20℃保存,临用前解冻,用RPMI1640 培养液稀释到所需浓度,使DMSO 的终浓度为<0.1%;多功能酶标仪(Molecular Devices)。
1.2 细胞培养及药物处理 人乳腺癌MCF-7 细胞及MDA-MB-231 细胞在含有10%的胎牛血清的RPMI1640 培养液中培养,并置于37℃、5% CO2饱和湿度的培养箱中培养备用。细胞按(2~5)×105接种于培养瓶中培养。姜黄素和ADM 以DMSO稀释为1 mmol/L 置4℃冰箱保存,用时稀释成工作浓度。工作浓度为0.1、1、10 和100 μmol/L。
1.3 方法
1.3.1 MTT 法检测细胞的增殖能力 用0.25%的胰蛋白酶消化对数生长期的MCF-7 细胞及MDA-MB-231 细胞,以适当密度接种于96 孔板内。细胞铺板24 h 后,加药处理,每张板设空白对照组。细胞加药后继续培养48 h,药物作用完毕,向各孔加入MTT 溶液,使细胞与0.25%(mg/ml)MTT在5% CO2的37℃培养箱中共同孵育3~4 h,吸除培养液,然后每孔加入100 μl 的DMSO 溶解5~10min,结晶振荡溶解后使用酶标仪于492 nm 处测其光密度值,计算IC50值。
1.3.2 药物合用研究及计算 根据1.3 得到的两药对MCF-7 细胞及MDA-MB-231 细胞抑制的IC50值,然后根据姜黄素:ADM(20∶1)浓度比例联合应用,药物共处理48 h 后,采用CalcuSyn(Biosoft,Oxford,UK)药物合用指数计算软件进行分析,计算联合指数(CI),CI 小于0.9 表示两药为协同作用;CI 在0.9~1.1 表示两药为相加作用;CI 大于1.1表示两药为拮抗作用。
1.3.3 Western blot 检测蛋白表达 收集经药物作用的细胞,加入100 μl 蛋白裂解液,-20℃放置20 min,13 000 r/min 离心5 min,收集上清,Bradford 法检测蛋白浓度。核蛋白和浆蛋白提取采用Thermo Scientific NE-PER 核蛋白和胞质蛋白提取试剂盒。随后SDS-PAGE 电泳,在250 mA、1 h 的条件下将蛋白转移至PVDF 膜上,以015 g/L 脱脂奶粉TBST液封闭后用PARP、Bcl-2、Bax、NF-κB(p65)和β-actin抗体(1∶400)4℃孵育过夜,洗涤后加入辣根过氧化物酶标记的二抗孵2 h,ECL 法显影。
2 结 果
2.1 对MCF-7 及MDA-MB-231 生长的影响实验结果表明,姜黄素和ADM 联合后,对MCF-7细胞和MDA-MB-231 细胞的生长抑制作用比两药单用明显。用CalcuSyn 软件分析得出,对MCF-7 细胞,合用组ED50CI=0.7(图1 A),对MDA-MB-231 细胞,合用组ED50CI=0.62(图1 B)。上述结果说明,姜黄素与ADM 两药合用具有协同抑制乳腺癌细胞MCF-7 和MDA-MB-231 生长的作用。
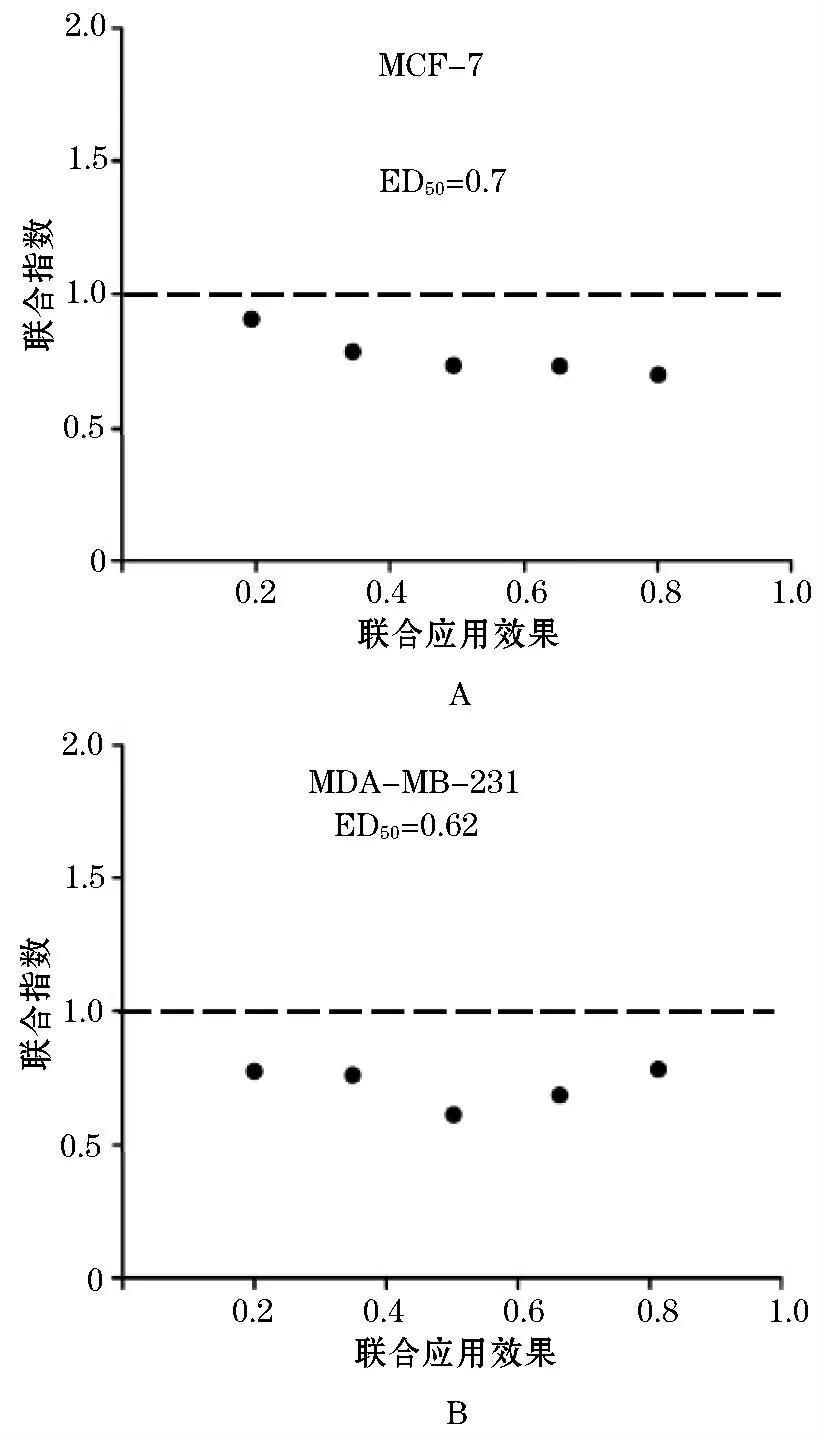
图1 姜黄素联合ADM 对乳腺癌细胞MCF-7和MDA-MB-231 生长的影响
2.2 对MCF-7 凋亡相关蛋白的影响 结果表明,姜黄素(10 μmol/L)单用及ADM 单用(0.5 μmol/L)48 h 后都可以增加MCF-7 细胞的PARP 蛋白裂解,而两药合用后PARP 蛋白裂解明显增强(图2),这提示其协同作用可能是通过诱导凋亡实现的。此外,笔者还检测了凋亡相关蛋白Bcl-2 和Bax,实验结果表明两药单用及合用对MCF-7 细胞Bax 蛋白表达无明显影响,但姜黄素单用及合用后可以明显抑制MCF-7 细胞Bcl-2 蛋白的表达(图2),这说明其协同作用可能与抑制Bcl-2 蛋白表达相关。

图2 姜黄素联合ADM 对乳腺癌细胞MCF-7 凋亡相关蛋白的影响
2.3 对MCF-7 的NF-κB 信号通路的影响ADM 单用可使MCF-7 细胞核内的p65 表达增多,胞浆内的p65 表达减少(图3),这说明ADM 单用可以促进NF-κB 信号激活。而姜黄素单用及与ADM 联合可使MCF-7 细胞核内的p65 表达减少,胞浆内的p65 表达相对增加(图3),这说明姜黄素能够抑制ADM 所引起的NF-κB 信号激活。
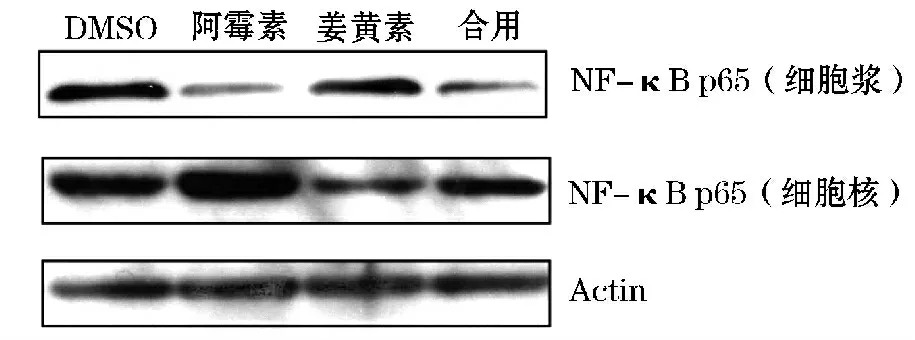
图3 姜黄素联合ADM 对乳腺癌MCF-7 细胞NF-κB 通路的影响
3 讨 论
以ADM为代表的蒽环类抗生素,是乳腺癌的重要化疗药物。ADM 可以嵌入DNA,抑制DNA 合成。拓扑异构酶Ⅱ在转录过程中使DNA 解旋,ADM可抑制拓扑异构酶Ⅱ的形成。破坏DNA 链后,ADM稳定拓扑异构酶Ⅱ的合成,防止DNA 双螺旋再次结合,从而停止复制。此外,ADM 还通过减少抗肿瘤蛋白的表达水平而促进肿瘤细胞凋亡。然而,有报道显示,近年来ADM 在肿瘤治疗中的耐药现象经常出现。肿瘤细胞对ADM 耐药的机制包括P-糖蛋白和Bcl-2 的向上调节和改变拓扑异构酶Ⅱ的活性。近期研究表明,NF-κB 可以抑制ADM 诱导的肿瘤细胞凋亡,并增加其耐药[5]。因此,寻找与ADM 有互补作用的药物和其联用,可以为治疗乳腺癌提供重要方法。姜黄素是从姜黄科自主的根茎姜黄中提取的一种自主多酚,具有抗炎、抗氧化、抗凝、抗动脉粥样硬化、抗肿瘤等药理作用,对多种肿瘤有抑制作用,且可以敏化多种化疗药物,是一种理想的抗肿瘤辅助药物。诱导凋亡,周期阻滞和阻断NFκB 信号通路被认为是姜黄素抗肿瘤的潜在机制[6]。本研究发现,姜黄素与ADM 两药合用对乳腺癌细胞MCF-7 和MDA-MB-231 生长抑制作用半数有效联合指数(EC50CI)分别为0.7 和0.6,这说明两药合用具有协同抑制,提示姜黄素有可能成为ADM 理想化疗辅助用药。
细胞凋亡是一种由基因控制的细胞自主死亡方式,而凋亡抵抗被认为是肿瘤细胞的一个重要特征。在众多凋亡标志物中,聚ADP 核糖聚合酶(poly-ADP-ribos polymerase,PARP)裂解一致被认为是一个重要的凋亡观测指标。本研究发现,姜黄素联合ADM 可以增强乳腺癌细胞MCF-7 的PARP 蛋白裂解,说明其协同抗肿瘤作用是通过诱导肿瘤细胞凋亡而实现的。Bcl-2 被认为是细胞凋亡蛋白家族中最重要的调控蛋白,和Bax、Bad、Bak 等共同组成了Bcl-2 蛋白家族,Bcl-2 的功能受其蛋白产物Bax 蛋白调节。Bcl-2 家族成员主要定位在核膜的胞质面、内质网及线粒体外膜上,与膜的结合对于其发挥功能是极其重要的。研究显示,Bcl-2 可以稳定细胞线粒体膜电位,从而抑制细胞凋亡,被认为是一个重要的抗肿瘤靶点,同时也是肿瘤耐药的一个重要机制[7]。本研究结果表明,姜黄素联合ADM可以明显抑制Bcl-2 蛋白的表达,这暗示两药合用可能通过诱导肿瘤细胞发生线粒体依赖途径的凋亡,说明Bcl-2 可能是姜黄素协同ADM 抑制乳腺癌细胞的作用靶点之一。
化学耐药是肿瘤治疗中的一种常见现象。经过一定时期的化学治疗后,肿瘤患者常常会复发。很多抗肿瘤药物,不仅是包括ADM 和柔红霉素在内的蒽环类抗生素,还有紫杉醇和长春碱类,均可以通过激活细胞内的NF-κB 诱导化学耐药产生。这些抗肿瘤药物可以使NF-κB 磷酸化,从而导致其蛋白降解,促进NF-κB 的两个亚基p65 和p50 从胞浆转移到胞核,激活它们的靶蛋白,此靶基因可诱导化学耐药。很多报道表明,抑制NF-κB 通路可以提高肿瘤化学治疗的效果[8]。本实验结果表明,姜黄素几乎完全抑制了ADM 诱导的NF-κB 激活。此外,NF-κB 的靶蛋白Bcl-2,在两药联用时这两种蛋白均被下调。因此,抑制NF-κB 通路,从而减少ADM 耐药是两药在体外协同作用的机制之一。综上所述,姜黄素与ADM 联合应用具有协同的抗乳腺癌生长作用,其作用机制与抑制ADM 诱导的NF-κB 激活继而促进肿瘤细胞凋亡有关。
[1]吕遐晟,杜哲明,曾 朋,等.GLI1 在乳腺癌各分子亚型中的表达及意义[J].武警医学.2012,23(10):862-865.
[2]蒋宇翔,陈 栋,王 玮,等.p38MAPK 抑制剂增强ADM 抑制乳腺癌细胞增殖的体外研究[J].浙江理工大学学报.2010,27(1):130-133.
[3]Von Minckwitz G.Docetaxel/anthracycline combinations for breast cancer treatment[J].Expert Opin Pharmacother.2007,8(4):485-495.
[4]Patel B B,Majumdar A P.Synergistic role of curcumin with current therapeutics in colorectal cancer:minireview[J].Nutr Cancer.2009,61(6):842-846.
[5]Moreno,Aspitia A,Perez E A.Anthracycline-and/or taxane-resistant breast cancer:results of a literature review to determine the clinical challenges and current treatment trends[J].Clin Ther.2009,31(8):1619-1640
[6]Esatbeyoglu T,Huebbe P,Ernst I M,et al.Curcumin--from molecule to biological function[J].Angew Chem Int Ed Engl.2012,51(22):5308-5332.
[7]Hardwick J M,Chen Y B,Jonas E A.Multipolar functions of BCL-2 proteins link energetics to apoptosis[J].Trends Cell Biol.2012,22(6):318-328.
[8]Li F,Sethi G.Targeting transcription factor NF-kappaB to overcome chemoresistance and radioresistance in cancer therapy[J].Biochim Biophys Acta.2010,1805(2):167-180.
