shRNA介导的hWAPL表达沉默对人宫颈癌CaSki细胞增殖与凋亡的影响*
2013-11-07潘巍巍曹利仙沈忠飞郭连军宋方洲
潘巍巍, 徐 营, 曹利仙, 沈忠飞, 郭连军, 宋方洲△
宫颈癌是妇科最常见的恶性肿瘤,发病率逐年升高,并且呈现年轻化的趋势。因此,研究预防治疗宫颈癌的方法已成为人们关注和研究的热点[1-2]。近年发现,人半翼(human wings apart-like,hWAPL)基因与宫颈癌及HPV关系密切[3],是果蝇体内半翼(wings apart-like,WAPL)基因在人体内的同源序列。WAPL基因是1977年在果蝇体内发现的一个基因[4-5],定位于果蝇的X染色体 2D4~2D5。在有丝分裂中,WAPL基因编码的蛋白质主要功能是控制染色质结构,维持染色单体的黏合[6-7]。hWAPL长约30 793 bp,定位于10q23.2,其编码一种聚合锚定蛋白,可以在有丝分裂前期使染色体臂的聚合适时解离[8-9]。研究证实hWAPL基因是一种宫颈癌特异性高表达基因[10-12],其蛋白在宫颈癌的发生发展中起极其重要的作用。为进一步探讨hWAPL在细胞增殖和凋亡中的作用及其作为分子靶点用于肿瘤治疗的潜在价值,本研究采用RNA干扰技术抑制hWAPL的表达,在体内和体外分别观察了其对人宫颈癌CaSki细胞增殖与凋亡的影响。
材料和方法
1 材料
1.1 主要试剂 质粒载体pGenesil(武汉晶赛生物公司);Hind III、EcoR I、BamH I、Sal I和 T4 DNA 连接酶(大连宝生物公司);Lipofectamine 2000转染试剂(Invitrogen);λDNA/Hind III DNA marker、DL2000 DNA marker、质粒提取试剂盒、PCR产物回收试剂盒、DNA小量胶回收纯化试剂盒和卡那霉素均为大连宝生物工程有限公司产品;G418(Amresco);胎牛血清(HyClone);DMEM/FI2细胞培养基(Invitrogen),青链霉素(Gibco),Hoechst 33258染色液和退火缓冲液购于碧云天生物技术研究所,DH5α由本实验室保存,β-actin和cleaved caspase-3抗体购于Cell Signaling,hWAPL、p21 和 p27 抗体购自 Santa Cruz,免疫组化Ⅱ抗购自Molecular Probes,Ⅲ抗ABC kit和DAB显色液购自Vector Laboratories,逆转录试剂盒购于Bio-Rad,Annexin V-PE试剂盒购自BD。
1.2 细胞培养 CaSki细胞(重庆医科大学提供)以含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的DMEM/F12培养基,在37℃、5%CO2条件下培养。0.25%EDTA胰酶消化细胞,2~3 d传代1次,取对数生长期细胞实验。
1.3 裸鼠 6~8周龄BALB/c裸鼠购自上海斯莱克。裸鼠饲养在重庆医科大学实验动物中心,SPF级。
2 方法
2.1 pGenesil-1-hWAPL-shRNA稳定表达的CaSki细胞系的筛选 hWAPL基因的shRNA序列设计及连接参照文献[13]。CaSki细胞培养于DMEM/F12培养基,含10%胎牛血清,37℃、5%CO2孵箱中过夜,待细胞汇合度约80%~90%时给细胞换成无血清培养液,使用Lipofectamine 2000将构建好的pGenesil空载体和pGenesil-hWAPL-shRNA质粒转染到CaSki细胞。转染8 h后给细胞换成正常培养液。24 h后给细胞加入G418(200 mg/L)筛选10~14 d,获得稳定表达的细胞系。
2.2 实时荧光定量PCR pGenesil空载体和pGenesil-hWAPL-shRNA转染CaSki细胞培养24 h后,Trizol提取细胞总RNA.将提取的总RNA(5 μg)按照说明逆转录成 cDNA。hWAPL上游引物5’-CCTTAGCCGTGACAGAAC-3’,下游引物 5’-GGAATCGGCACTGTCTTG-3’,产物片段为246 bp;β-actin上游引物 5’-GCTCTTTTCCAGCCTTCCTT-3’,下游引物5’-GTACTTGCGCTCAGGAGGAG-3’,产物片段为279 bp。定量PCR步骤:95℃变性5 min,95℃ 30 s,60℃ 30 s,72 ℃ 32 s,30 个循环,72 ℃延伸 10 min。数据使用Q-RT_Analysis分析软件处理,使用Graph-Pad Prism 5软件作图。
2.3 MTT检测细胞增殖 将3×103个稳定表达空载体和pGenesil-hWAPL-shRNA的CaSki细胞接种于96孔板中,同时设空白对照。细胞培养72 h后加入20 μL MTT(5 g/L),4 ~ 6 h 后加 DMSO(150 μL/well),振荡10 s,490 nm检测。每组设3个复孔,实验重复3次。
2.4 Annexin V-PE染色检测细胞凋亡 收集细胞106,预冷1×PBS洗涤2次,1× binding buffer重悬细胞,取105个细胞放置到5 mL离心管中,分别加入5 μL Annexin V-PE 和 5 μL 7-氨基放线菌素(7-aminoactinomycin,7-AAD)混悬细胞,混匀、室温避光放置15 min,加400 μL 1 ×binding buffer应用流式细胞术检测细胞凋亡。
2.5 Hoechst 33258荧光染色检测细胞凋亡 将CaSki细胞接种于24孔板过夜(细胞爬片生长),分别向 CaSki细胞转染 pGenesil-hWAPL-shRNA和pGenesil-shCON,24 h后PBS洗细胞3次,加入1 mL Hoechst 33258染色液,室温放置5 min,吸除Hoechst 33258染色液,用PBS洗3次,每次5 min。封片后荧光显微镜下观察。
2.6 裸鼠荷瘤模型 6~8周龄的雌性裸鼠5只SPF级饲养,无菌的条件下给每只裸鼠的两侧背部皮下分别注射1×106个作为对照的(shCON)CaSki细胞(左侧背部皮下)和稳定表达hWAPL-shRNA的CaSki细胞(右侧背部皮下),待30 d后裸鼠成瘤,取出肿瘤组织中性甲醛固定,脱水,石蜡包埋,切片(5 μm),行HE染色。
2.7 免疫组化 石蜡切片经二甲苯、乙醇脱蜡3次,每次 3 min,水化,3%H2O2避光10 min,0.02 mol/L枸橼酸钠抗原修复,95℃ 15 min,10%山羊血清封闭30 min,Ⅰ抗(1∶200)室温1 h,1×PBST洗3遍,每次3 min,Ⅱ抗室温30 min,1×PBST洗3次,每次3 min,Ⅲ抗室温30 min,1×PBST洗3次,每次3 min。DAB显色,终止,逐级脱水,中性树脂封片。
2.8 蛋白质印迹分析 吸去培养瓶中的培养基,1×PBS将细胞洗涤2次,收集细胞,提取细胞总蛋白,取100 μg总蛋白做 SDS-PAGE,转至 PVDF膜上,5%脱脂奶粉封闭过夜,1×TBST洗3次,每次8 min,分 别 与 内参 照 β-actin、cleaved caspase-3、hWAPL、p21和p27抗体(均1∶1 000)4℃孵育过夜,1×PBST洗膜3次,每次8 min。Ⅱ抗孵育,洗膜3次,每次8 min,杂交反应后应用ECL Western blotting化学发光试剂盒暗房显影。
3 统计学处理
数据用均数±标准差(mean±SD)表示,两组间比较采用t检验分析,以P<0.05为差异有统计学意义。
结 果
1 hWAPL-shRNA在CaSki细胞中干扰效率的检测
pGenesil载体带有EGFP,荧光显微镜下可看见绿色荧光蛋白表达。G418筛选转染pGenesil-hWAPL-shRNA和pGenesil-shCON的CaSki细胞10~14 d后获得稳定表达shCON和hWAPL-shRNA的细胞系,荧光显微镜下可见强的绿色荧光表达,见图1A。实时荧光定量PCR检测发现hWAPL mRNA表达量明显减少,与对照相比只有10%左右,见图1B。Western blotting检测发现干扰后hWAPL蛋白表达也明显减少,见图1C。
2 hWAPL基因沉默抑制CaSki细胞生长
RNA干扰hWAPL 72 h后,显微镜下观察可见RNA干扰组CaSki细胞的数目与对照组相比明显减少,见图2A。MTT结果同样显示hWAPL基因沉默组细胞增殖与对照组相比明显减少,差异具有统计学意义(P <0.05),见图2B。

Figure 1.Interference efficiency of hWAPL-shRNA in CaSki cells.A:EGFP expression observed by fluorescence microscopy(×200).B:hWAPL mRNA expression detected by real-time fluorescence quantitative PCR;C:hWAPL protein expression detected by Western blotting.Mean±SD.n=3.**P <0.01 vs shCON.图1 CaSki细胞中hWAPL shRNA干扰效率的检测

Figure 2.hWAPL silencing inhibited CaSki cell proliferation.A:numbers of the cells cultured in 6-well plates for 72 h were observed under contrast-phase microscope(×200).B:MTT assay results.Mean±SD.n=3.*P <0.05 vs shCON.图2 hWAPL沉默抑制CaSki细胞增殖
3 沉默hWAPL基因增加CaSki细胞凋亡
流式细胞术检测显示,对照组细胞凋亡率为1.4%,RNA干扰hWAPL后CaSki细胞凋亡率明显增加到17.8%,见图3A,这表明 hWAPL沉默增加了CaSki细胞凋亡。Hoechst 33258染色表明对照组(shCON)细胞发生染色质凝集、边缘化的细胞数目明显少于干扰组(hWAPL-shRNA),干扰组部分细胞细胞核出现染色质高度凝集、边缘化、核固缩等凋亡的特征,荧光显微镜下可见细胞核呈现强烈的蓝色荧光,见图3B。上述结果表明hWAPL沉默促进CaS-ki细胞发生凋亡。
4 沉默hWAPL基因降低CaSki细胞的成瘤能力
为了在体内进一步验证hWAPL基因的作用,我们分别给裸鼠背部皮下注射含有shCON和hWAPL-shRNA的CaSki细胞,30 d后待裸鼠成瘤取出肿瘤组织称重,对照组的肿瘤明显大于RNA干扰组,见图4A。肿瘤组织HE染色显微镜观察可见增殖旺盛的肿瘤细胞,见图4C。免疫组化检测RNA干扰组肿瘤组织中hWAPL表达明显减少,而对照组hWAPL表达较高,见图4C。RNA干扰组肿瘤组织中增殖细胞核抗原(proliferative cell nuclear antigaen,PCNA)明显少于对照组,这表明在裸鼠体内hWAPL沉默肿瘤细胞增殖减弱,见图4C。该实验在动物体内进一步验证了hWAPL沉默明显降低CaSki细胞的成瘤能力。
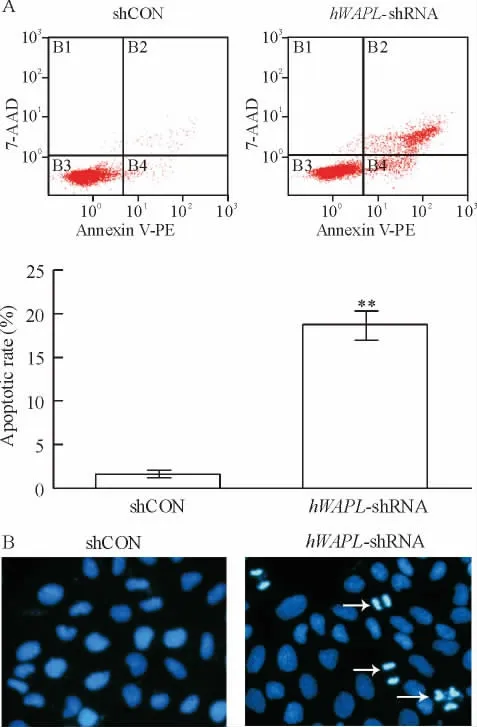
Figure 3.hWAPL silencing promoted CaSki cell apoptosis.A:flow cytometry results;B:Hoechst 33258 staining results(×400).Mean±SD.n=3.**P <0.01 vs shCON.图3 hWAPL沉默促进CaSki细胞凋亡
5 蛋白质印迹分析凋亡相关蛋白
hWAPL RNA干扰组细胞中,cleaved caspase-3和细胞周期相关蛋白p21、p27的表达均上调,见图5。这表明hWAPL沉默诱发的细胞凋亡与细胞周期抑制蛋白的高表达有关。
讨 论
细胞凋亡是由多种基因控制的自主性的程序化死亡过程[13]。凋亡在机体的生长发育、细胞分化、病理状态和细胞清除等方面具有十分重要的意义。而肿瘤细胞的发生多存在不同程度的细胞凋亡过程的异常,是细胞增殖和凋亡调控异常导致平衡失调的综合性结果,因此深入研究肿瘤的凋亡过程对肿瘤的治疗有着重要的意义。

Figure 4.Tumorigenic capacity of CaSki cells with hWAPL silencing in nude mice.CaSki cells transfected with shCON and hWAPL-shRNA(1×106cells for each)were subcutaneously implanted into the left and right flanks of nude mice,respectively.After 30 days,the tumors were removed.A:tumor size measurement;B:tumor weighing results;C:HE staining of tumor tissues and immunohistochemical staining for hWAPL and PCNA expression in tumor tissues(×200).Mean±SD.n=6.**P <0.01 vs shCON.图4 在裸鼠体内hWAPL影响细胞增殖

Figure 5.Western blotting analysis of the protein expression of cleaved caspase-3,p27 and p21 in CaSki cells.Mean±SD.n=3.**P <0.01 vs shCON.图5 Western blotting检测凋亡及细胞周期抑制相关蛋白
本实验采用RNA干扰技术,研究hWAPL基因沉默后对人宫颈癌CaSki细胞增殖和凋亡的影响。在前期研究中我们成功构建针对hWAPL基因的shRNA真核表达载体。经酶切和测序鉴定表明成功构建了 3 个 pGenesil-hWAPL-shRNA[14-15],采用脂质体法转染CaSki细胞后,在倒置荧光显微镜下观察到大量绿色荧光蛋白表达,表明装载到质粒上的基因片段通过脂质体的介导成功转染到细胞内并高表达EGFP,实时定量PCR和Western blotting检测结果表明,构建的pGenesil-hWAPL-shRNA能够有效抑制内源hWAPL表达。我们通过Annexin V-PE和Hoechst 33258染色方法检测发现shRNA介导的hWAPL表达沉默促进了CaSki细胞的凋亡,Western blotting检测发现cleaved caspase-3表达明显增加。Caspase-3是半胱氨酸蛋白酶家族中导致细胞凋亡的最强大的最终效应因子,受多种信号转导通路的调控,caspase-3被激活后,作用于细胞质成分,而使细胞发生凋亡[16]。
p27基因是一种调控细胞周期并抑制细胞分裂的重要基因,其蛋白可直接抑制cyclin-CDK复合物的生物学活性,使细胞停滞于G期,同时具有促进细胞分化、介导细胞间黏附及诱导凋亡等功能,其蛋白表达异常导致细胞增殖与凋亡失衡,促进肿瘤的发生和发展[17]。p21蛋白可以与cyclin和CDK结合,从而抑制cyclin-CDK复合物的激酶活性,抑制Rb蛋白磷酸化,使细胞停滞于G期,不能进入S期,起到细胞周期调控作用[18]。hWAPL基因沉默增加了细胞周期抑制蛋白p21和p27的表达,从而抑制CaSki细胞增殖导致细胞凋亡增加。因此,以hWAPL为靶点的治疗很可能同时具有抑制细胞增殖、诱发细胞凋亡和提高化疗药物敏感性的多重效应。
[1] Schmeler KM.Preventing cervical cancer globally[J].Cancer Prev Res(Phila),2012,5(11):1257-1259.
[2] Matsumoto K.Human papillomavirus and cervical cancer[J].Nippon Rinsho,2007,65(11):2113-2124.
[3] Oikawa K,Ohbayashi T,Kiyono T,et al.Expression of a novel human gene,human wings apart-like(hWAPL),is associated with cervical carcinogenesis and tumor progression[J].Cancer Res,2004,64(10):3545-3549.
[4] Lopez-Serra L,Lengronne A,Borges V,et al.Budding yeast Wapl controls sister chromatid cohesion maintenance and chromosome condensation[J].Curr Biol,2013,23(1):64-69.
[5] Wu N,Kong X,Ji Z,et al.Scc1 sumoylation by Mms21 promotes sister chromatid recombination through counteracting Wapl[J].Genes Dev,2012,26(13):1473-1485.
[6] Nishiyama T,Ladurner R,Schmitz J,et al.Sororin mediates sister chromatid cohesion by antagonizing Wapl[J].Cell,2010,143(5):737-749.
[7] Gause M,Misulovin Z,Bilyeu A,et al.Dosage-sensitive regulation of cohesin chromosome binding and dynamics by Nipped-B,Pds5,and Wapl[J].Mol Cell Biol,2010,30(20):4940-4951.
[8] Shintomi K,Hirano T.Releasing cohesin from chromosome arms in early mitosis:opposing actions of Wapl-Pds5 and Sgo1[J].Genes Dev,2009,23(18):2224-2236.
[9] Zhang J,Håkansson H,Kuroda M,et al.Wapl localization on the synaptonemal complex,a meiosis-specific proteinaceous structure that binds homologous chromosomes,in the female mouse[J].Reprod Domest Anim,2008,43(1):124-126.
[10] Oikawa K,Akiyoshi A,Tanaka M,et al.Expression of various types of alternatively spliced WAPL transcripts in human cervical epithelia[J].Gene,2008,423(1):57-62.
[11]鲁笑钦,崔金全,胡 滨.hWAPL基因在宫颈癌组织中的特异性表达及意义[J].医药论坛杂志,2007,28(10):1-2.
[12] Kuroda M,Kiyono T,Oikawa K,et al.The human papillomavirus E6 and E7 inducible oncogene,hWAPL,exhibits potential as a therapeutic target[J].Br J Cancer,2005,92(2):290-293.
[13] Dirsch VM,Müller IM,Eichhorst ST,et al.Cephalostatin 1 selectively triggers the release of Smac/DIABLO and subsequent apoptosis that is characterized by an increased density of the mitochondrial matrix [J].Cancer Res,2003,63(24):8869-8876.
[14]潘巍巍,徐 营,易发平,等.人乳头瘤病毒关键基因在裸鼠体内表达的初步研究[J].中国病理生理杂志,2009,25(2):209-214.
[15]曹利仙,潘巍巍,黄玉蓉,等.hWAPL基因shRNA真核表达载体的构建及干扰效果的初步鉴定[J].解剖学杂志,2010,33(4):446-450.
[16] 李 强,曹明溶,刘志龙,等.去氢骆驼蓬碱诱导HepG2细胞凋亡并增强其对5-氟尿嘧啶和顺铂的敏感性[J].中国病理生理杂志,2013,29(2):284-289.
[17]许林锋,倪嘉延,陈耀庭,等.HIF-1α基因沉默对大鼠肝癌CBRH-7919细胞p27和Ki67表达的影响[J].中国病理生理杂志,2012,128(10):1825-1829.
[18]王晓蕾,张莲英,孙道旭,等.姜黄素对裸鼠乳腺移植瘤p21及CD44V6表达的影响[J].中国病理生理杂志,2007,23(8):1524-1526.
