G蛋白偶联受体激酶在心血管疾病中的作用*
2013-12-01田艳君刘海青
田艳君, 刘海青, 陈 京, 白 波
(1曲阜师范大学,山东曲阜273165;2泰山医学院,山东 泰安271000;3济宁医学院,山东济宁272000)
G蛋白偶联受体 (G-protein-coupled receptors,GPCRs)是与G蛋白偶联的膜受体,也是目前已知最大的细胞膜受体家族。GPCRs能够被不同配体所激活,可将激素、神经递质、药物、趋化因子以及光线等多种化学性和物理性细胞外信号转导入细胞内,在多种生理活动和病理过程中发挥重要的调节作用。GPCRs被认为是高血压、心力衰竭、帕金森氏综合症等多种疾病的药物治疗靶点,市售药物约50%都是以 GPCRs为靶点的[1]。
G蛋白偶联受体激酶(G-protein-coupled receptor kinases,GRKs)是一种丝氨酸/苏氨酸激酶,主要由7个成员组成,按发现时间顺序分别命名为GRK1~GRK7,它们拥有共同的功能结构(图1),包括1个中心催化区、1个供底物识别和含有G蛋白信号调节蛋白(regulators of G-protein signaling,RGS)样结构的氨基末端以及1个作用于细胞膜的长度可变的羧基末端[2-3]。RGS区具有三磷酸鸟苷(guanosine triphosphate,GTP)酶活性,能促进GTP(束缚于Gi和Gq的α亚基)的水解,从而缓冲经由Gαi和Gαq通路的信号转导[4]。
GRKs是GPCRs信号转导的关键负调节因子,GPCRs与配体结合后,除了能促进G蛋白的激活,还可以引发GRKs参与的GPCRs的磷酸化。GPCRs一旦发生磷酸化,抑制蛋白(β-arrestins)便会迅速与之结合,这将大大削弱受体与G蛋白对刺激物的应答作用。这种受体应答作用迅速丧失的现象称为脱敏(图2)。近年来的研究表明,GRKs的作用不止是使GPCR脱敏,它们还可以磷酸化非受体底物,如微管蛋白、突触核蛋白、光传感因子等[5]。此外,GRKs还可以与信号转导和运输中的多种蛋白[如Gαq、Gβγ、G蛋白偶联受体激酶相互作用蛋白(GRK-interacting proteins,GIT)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-ki-nase,PI3K)、网格蛋白和小窝蛋白等]发生相互作用, 以一种磷酸化非依赖的方式调节细胞功能。
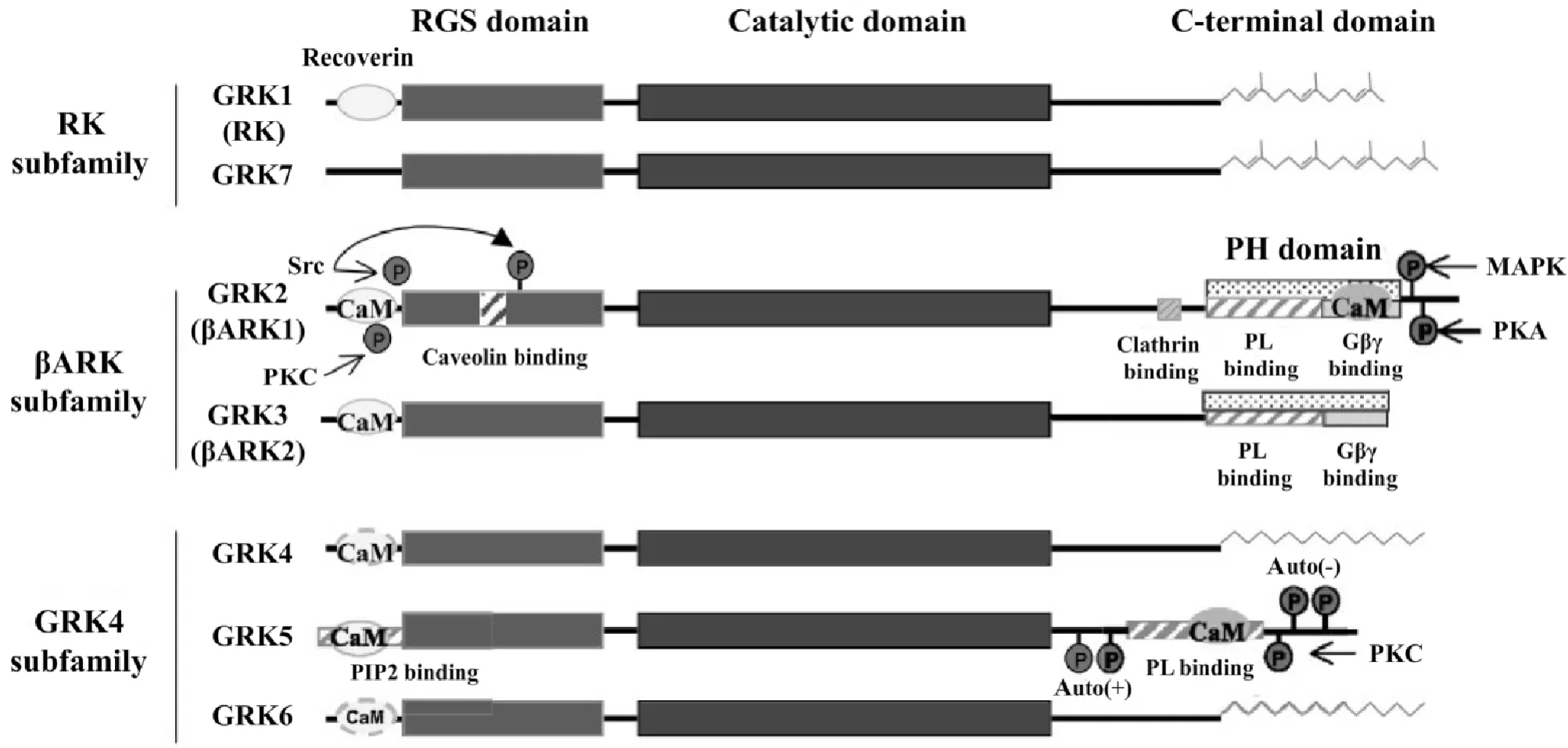
Figure 1.The construction features and classification of GRKs[2].GRKs are multidomain proteins interacting with a variety of cellular proteins.Such interactions determine the different cellular functions of these kinases and also contribute to modulating their activity and subcellular targeting.The figure depicts the regions where the different functional domains and regulatory phosphorylation and interaction sites have been mapped.RGS:regulators of G-protein signalling;CaM:calmodulin;PL:phospholipids;PH:pleckstrin homology;Auto(±):stimulatory or inhibitory autophosphorylation sites.图1 GRKs的结构特点和分类

Figure 2.Desensitization of GPCRs.GRKs are recruited to,and phosphorylate ligand-occupied GPCRs on the cytoplasmic carboxyl-terminal tail.β-arrestins then recruit to phosphorylated GPCRs with enhanced affinity,thereby creating a platform for blocking recoupling of the dissociated G-protein subunits to the GPCRs,and preventing further receptor activation(ie,desensitization).GRK:G-protein-coupled receptor kinase;GPCR:G-protein-coupled receptor.图2 GPCRs的脱敏过程
1 GRKs的分类和分布
已知哺乳动物体内的7种GRKs中,GRK1和GRK7分别分布于视网膜的视杆细胞和视锥细胞,介导光信号转导;GRK4仅在小脑、睾丸和肾脏表达;而GRK2、GRK3、GRK5和 GRK6在多数组织中均有表达[6]。
基于序列同源性的高低和组织表达特异性不同,GRKs可以分为3个亚家族:视紫红质激酶(rhodopsin kinase,RK)亚家族(GRK1 和 GRK7)、β-肾上腺素受体激酶(β-adrenergic receptor kinase,βARK)亚家族(GRK2和 GRK3)和 GRK4亚家族(GRK4、GRK5和 GRK6),见图1。
2 GRKs在心脏的表达和分布
研究显示,GRK2、GRK3和GRK5在健康人的心脏中均有表达,然而GRK4、GRK6和GRK7几乎检测不到[7]。其中,由于 C端功能区的差异,GRK2和GRK3位于胞浆内,而GRK5位于细胞膜。这3种GRKs在心脏的表达虽然存在某些共性,但它们是有区别的、具有调节特性的酶。体内实验显示,GRK3对凝血酶受体和α1B肾上腺素受体(α1B-adrenergic receptor,α1BAR)有特异性,GRK5对血管紧张素Ⅱ受体有选择性,而GRK2和GRK5在心肌的β-肾上腺素能受体(β-adrenergic receptor,βAR)βAR 系统中发挥重要作用[7-8]。而且,这些激酶及其受体的细胞分布和亚细胞定位也为GPCR-GRK相互作用的特异性提供了有利条件。
在胚胎形成和心脏发育过程中,不同的GRKs作用于不同的信号转导通路。敲除GRK2基因小鼠由于严重的心脏发育不全和心力衰竭,一般在胎龄12.5~15.5 d死亡;然而,缺乏GRK3或GRK5的小鼠则能成活,不会出现上述情况[7,9]。这种由于GRK2基因敲除而引起的胚胎致死和心血管损伤表明,GRK2在胚胎形成和心脏发育中拥有其它GRKs亚型所没有的特殊的关键功能。
虽然以上3种GRKs在心脏均有分布,但是它们在心脏的各种细胞类型中的分布却有差异。大鼠心脏的免疫组织化学分析显示,GRK2在心肌细胞中仅有微弱的表达,主要分布于血管内皮细胞;GRK3仅局限于心肌细胞;而GRK5则在心脏的各种类型细胞中均有分布[3]。心肌组织中不同GRKs亚型的分布反映了它们生理学作用底物的偏向性和在心脏病理学中的作用差异性。
3 心脏GRKs水平和功能的调节机制
3.1 相互作用蛋白的调控 如前所述,GPCRs可激活其偶联的G蛋白,完成信号转导。例如,βAR激动剂与βAR结合后激活G蛋白,使 G蛋白解离为Gα和 Gβγ两部分,这两部分分别介导不同的信号转导过程。但此过程受GRKs的调节。GRKs可使βAR发生磷酸化,磷酸化的βAR募集β-arrestins,导致βAR脱敏、内化。
强效刺激能使 GRKs与Gβγ或活化的 GPCRs结合。除此之外,GRKs的活性还能被可以牵制其催化活性的其它相互作用蛋白所调控,其中较为重要的一种是小窝蛋白(caveolin)。小窝蛋白可作为多种信号分子[其中包括β2AR和不同的丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)以及G蛋白]的骨架蛋白,还可以帮助限制或区分信号转导。GRK2可与存在于心脏的不同小窝蛋白亚型产生相互作用,尤其是在细胞膜小窝蛋白富集区若出现GRK2,小窝蛋白就易于与之产生相互作用。临床病例报道,心力衰竭病人的心脏内,小窝蛋白水平有所降低;并且,小窝蛋白基因敲除小鼠中,心肌肥大和心肌收缩功能障碍的发病率明显提高[10]。因此,GRK2-caveolin的相互作用的改变必然对心脏功能有重要调节作用。
最近发现,GRK2的另一个相互作用蛋白是Raf激酶抑制蛋白(Raf kinase inhibitor protein,RKIP)。RKIP被PKC磷酸化后,将会从Raf上转移下来,同时与GRK2的结合增强[11]。RKIP水平的降低将导致GRK2活性增强,心肌细胞收缩反应性受损。
3.2 钙离子结合蛋白的调控 细胞内钙离子水平的变化与心力衰竭的发展有明显相关性。不同细胞内,钙离子敏感蛋白会与不同的GRKs产生相互作用,从而调节后者的活性[2]。GRK5对钙离子结合的钙调蛋白(calmodulin,CaM),即Ca/CaM的存在很敏感,CaM可以阻止GRK5靶向细胞膜,增加GRK5对可溶性底物的活性;相反,GRK2只有在CaM浓度很高时才会受影响。由于GRK5对CaM具有高亲和力,在大多数类型细胞中当GPCR被激活而导致钙离子浓度升高时,GRK5会优先被抑制。
3.3 磷酸化调控 虽然GRKs可以使多种GPCRs磷酸化,但是GRKs本身也会被多种激酶磷酸化,第二信使依赖的蛋白激酶C(protein kinase C,PKC)和蛋白激酶A(protein kinase A,PKA)可调节多种GRKs的活性和膜靶向性。这种相互作用在心脏疾病中尤为重要,因为在人类心力衰竭中,PKC和PKA的表达都是上调的[3]。PKC可使GRK2和GRK5磷酸化,但是二者产生的效应不同。GRK2磷酸化后,它对GPCRs的催化活性增强(可能是通过缓解钙调蛋白引起的抑制效应);而GRK5磷酸化后,其催化活性显著降低[2,5]。另一方面,被以与 Gαs偶联为主的受体激活的PKA可直接磷酸化GRK2,该磷酸化并不影响GRK2自身的催化活性,而是增强GRK2与Gβγ亚基的结合,从而促进GRK2与细胞膜结合,增强其对活化受体的作用[2]。
GPCRs活化也可以引发非受体酪氨酸激酶的调节,如c-Src、MAPK。已有研究证明β2AR受刺激后,c-Src可以直接使GRK2磷酸化,进一步引起β2AR脱敏、内化,这一过程依赖β-arrestins招募c-Src的能力[12]。经酪氨酸磷酸化的GRK2对多种底物的活性也因此而增强;但从长期效应来看,该磷酸化可以促进对GRK2细胞水平的调节。
GRK2的活性还受细胞外信号调节激酶(extracellular signal-regulated kinase 1/2,ERK1/2)的调控。体外和原位实验均表明,ERK1可以磷酸化GRK2的Gβγ结合区。MAPK磷酸化可显著影响 GRK2和Gβγ的相互作用,从而抑制激酶的易位和对受体底物的催化活性。此外,GRK2被c-Src和MAPK磷酸化还能触发后续的激酶降解。
3.4 转录和降解的调控 在一些病理条件下,不同的GRKs mRNA表达水平有所改变。已有研究报道,在主动脉平滑肌细胞,诱发血管收缩和心肌肥大的试剂(例如佛波醇)可显著增强GRK2启动子的活性[3]。相反地,促炎细胞因子,如白细胞介素1β(interleukin 1β,IL-1β)、肿瘤坏死因子 α(tumor necrosis factorα,TNF-α)或干扰素 γ(interferon γ,IFN-γ),可引起相反的效应。
GRKs稳定性的调节对其表达水平的调控来说是一个重要的机制。GRK2是一个短寿命蛋白,要经历多聚泛素化并且可被c-Src和MAPK磷酸化,通过蛋白酶复合体通路降解[13]。此过程必须在一种稳定的包括β-arrestin的亚细胞环境中进行。
4 心血管疾病中GRKs水平和活性的变化
βARs是维持正常心脏功能的全程调节者,在人类心肌细胞,主要是由β1AR和β2AR两个亚型通过与Gαs偶联来介导正性变时、变力、变转导的肾上腺素能效应。在心力衰竭病人心脏中,βAR密度和反应性降低,主要是因为β1AR出现表达下调。有研究证实,心脏功能性的β3AR(通过Gαi蛋白进行信号转导)在心力衰竭的心肌中的表达是上调的[14]。
βARs通过激活其偶联的G蛋白而发挥作用。鉴于GRKs调节GPCRs信号转导的普遍性,心血管疾病中,βARs出现改变,GRKs相应地发生变化。尤其值得注意的是,GRK2和GRK5这2种亚型在心脏的表达和活性的改变。在动物的一些心力衰竭实验模型中,GRK2和GRK5的表达和活性明显增加。GRK2的表达和活性的增加还与高血压、心肌肥大和心肌缺血有关[7,15]。最有趣的是,GRK2 水平常在心力衰竭发生之前就已经增加,当βAR信号和心室功能改善时才恢复正常[16-17]。在高血压、心力衰竭等病理情形下,GRKs的结构和功能会发生显著的改变,因此,GRKs可以作为一种治疗靶点和评价心血管功能的潜在生物指标。
GRKs主要通过血管平滑肌上的GPCRs的磷酸化来调节血压。GRKs家族成员中,GRK2、GRK3、GRK4和GRK5对血压都有影响,尤其是GRK2和GRK5在高血压症状中发挥了关键作用。心力衰竭时,βAR信号转导被扰乱,交感神经系统受到持续的刺激,循环的儿茶酚胺类物质增加,结果导致βARs的脱敏和/或表达下调。在这一过程中,βARK1(GRK2)的表达也增加,进一步抑制了βAR的信号转导。GRK2和GRK5过量表达会严重损害βAR信号转导和β激动剂介导的心肌收缩功能。心力衰竭时,心肌 GRKs的活性提高了2~3倍,并且 GRK2 mRNA水平和蛋白表达水平均显著增加[18]。在其它如血压超负荷、心肌缺血和心肌梗塞等心脏病理情形下,也观察到类似的GRK2活性或表达水平的上调。此外,应用βARK-ct(βARK的C末端类似物,可竞争性抑制βARK1转位至细胞膜)抑制βARK1活性可使一些心力衰竭动物模型受损的心脏功能得以逆转,增加存活几率,与βAR阻断剂具有协同作用[3,19]。这表明,心力衰竭时 βARK1 表达增加并非保护性机制。与GRK2不同的是,GRK5的一个突变体——GRK5 Leu41起到类似βAR阻断剂的作用,能够延缓去甲肾上腺素刺激受体的间隔,具有抑制心力衰竭的作用[18]。
5 结语和展望
心血管疾病是造成人群死亡的首要原因。可以预计,未来10~20年心血管疾病的患病率和死亡率还将上升。目前,心血管疾病的诊断和防治是世界性研究热点。在研究这类疾病的病理生理机制时,发现更为有效的治疗靶点具有十分重要的理论和现实意义。
GRKs与其相互作用蛋白的功能复合体(GRK“interactome”)展示了这些激酶对不同的信号转导通路的重要性,GRKs蛋白水平或活性的变化会影响信号转导通路的效率或特征。在病理环境中,GRKs水平和/或功能的改变是它们正常的合成、降解和调控失衡的结果。在不同心脏细胞类型中这些过程的特异调控还有待进一步详细研究。另一方面,GRKs功能改变的结果可以在它们增加的复合体“interactome”中观测到,此复合体包括Gαq、PI3K和非GPCR底物。这一理论,结合心血管疾病动物模型的应用可帮助解决以下问题:GRK水平的改变是心血管疾病的正常结果还是突如其来的因子;GRKs水平的增加是有益的还是有害的(或者取决于疾病阶段)。我们可以这样理解:使用GRKs作为潜在的生物标志是一种新的诊断程序,或者是一种基于GRKs活性、水平或特异相互作用调控的新的治疗策略。
