LiBH4-xFx储氢材料的制备与性能研究
2013-11-01刘海迪曹中秋
刘海迪,曹中秋,张 轲,王 艳,鲁 捷
(沈阳师范大学 化学与生命科学学院,沈阳 110034)
0 引 言
工业革命以来,在人们享受物质财富的同时,气候变化的阴霾已悄然笼罩。20世纪80年代,应对气候变化的紧迫性和重要性开始逐渐被人正视。低碳发展是实现经济发展模式转变最根本的途径,如今低碳环保慢慢成为了人们时尚生活的风向标;石油资源的日益枯竭,温室效应、酸雨以及空气质量的急剧下降,使人类对于环境保护的意识更坚定。氢是一种洁净高效的能源载体,被认为是连接化石能源向可再生能源过渡的重要桥梁,实现能源可持续供给和循环的重要能源载体之一。在未来的能源体系中,氢能可以成为与电能并重而互补的终端能源,渗透并服务于社会经济生活的各个方面[1-4]。储氢材料历经40余年发展,已形成包括金属/合金氢化物、配位金属氢化物、氨基/亚氨基化合物、氨硼烷化合物、低维纳米结构材料、新型吸附剂(金属有机框架结构)等多个分支领域[5]。依材料——氢之间相互作用本质,可将上述储氢材料划分为物理吸附与化学吸附材料。前者通过范德华力吸附氢分子;后者则主要以氢原子成键方式储氢。多年研究表明:以碳纳米管为代表的高比表面积纳米结构材料对氢分子的束缚能过低(<10kJ/mol),难以满足近室温条件下的储氢应用需求。与之相比,化学吸附类材料在成分调整、结构调控方面具有较大探索空间。对于多数碱金属或碱土金属硼氢化物,其质量氢密度达到或超过10%(质量分数),高于美国能源部(DOE)提出的2015年车载氢源指标(9%)[6-10];LiBH4的储氢容量为18.5%,在目前可利用的储氢材料中具有最大的氢容量。然而,LiBH4作为储氢材料存在2个主要问题:一是放氢条件苛刻,其起始放氢温度高于400~600℃时只能释放约一半的氢;二是难于可逆,其可逆条件高至600℃和35MPa氢压[11]。Yin等[11]基于第一性原理计算发现,在LiBH4中实施F掺杂可生成部分替代的LiBH4-xFx晶格,氢化物分解反应焓变降低了14.4kJ/mol H2,体系的理论氢容量仍高达11.3%[[12-15]。
本文采用机械球磨法,制备LiBH4-xFx储氢材料,并且采用DSC-TG同步热分析仪测试、XRD等测试技术研究球磨时间对LiBH4-xFx储氢材料的储氢性能。
1 实验部分
1)实验原料
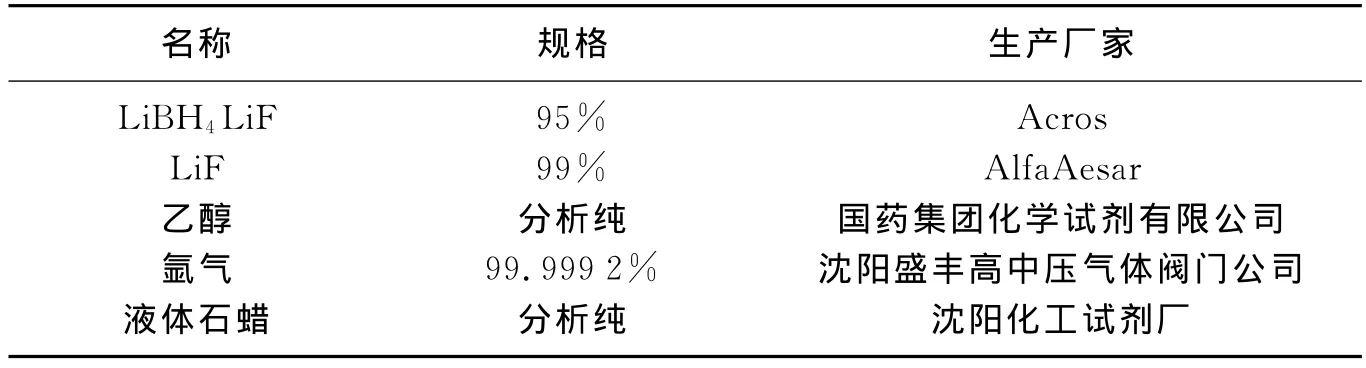
表1 实验材料和试剂
2)实验设备

表2 实验仪器
3)实验方法
将粉末LiBH4(95%,Acros)和LiF(99%,AlfaAesar),按照摩尔比LiBH4∶LiF=1∶1称量后装入球磨罐中,球料比为40∶1。由于反应物LiBH4极容易与空气中的氧气和水反应,所以上述实验步骤需在高纯氩气保护下的真空手套箱中进行,整个过程中保持氧含量和水含量低于0.5×10-6。球磨罐采用100mL的1Cr18Ni9Ti真空密封不锈钢罐,磨球的材质和罐体相同,其直径为10mm。实验采用南京大学生产的QR-1SP行星式球磨机,球磨机转速设为400r/min,采用间断运行方式,运行20min停2 min。球磨前先将球磨罐抽真空到背底真空度在5Pa以下后再充入2MPa的氩气,反复抽充两次后再进行球磨。按照预定的球磨时间,从球磨罐中取出少许样品以液体石蜡包裹后(防止其与空气中的氧和水反应)进行X射线衍射和DSC-TG同步热分析仪测试分析。
2 结果与讨论
2.1 放氢机理
纯 LiBH4放氢过程[18]如下:
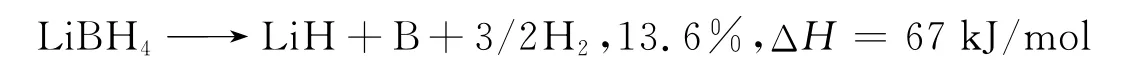
LiBH4晶体结构中各原子坐标[19]:Li:(0.160 2,0.25,0.111 6),B:(0.302.79,0.25,0.429 41),H(1):(0.399,0.25,0.562.7);H(2):(0.391 2,0.25,0.290),H(3):(0.213 8,0.046,0.431 2),LiBH4空 间 群 为Pnma(No.62),如图1。
确定掺杂远在F LiBH4中的占位情况时,考虑了5种情况,即3种不等价 H 原子位置[H(1),H(2),H(3)],间隙位(坐标为(0.5,0.5,0.5)。对 F而言,由于原子半径小,没有考虑取代BH4单元情形,因此,F取代H性很大,易形成LiBH4-xFx晶格,从而降低LiBH4的放氢温度。

图1 LiBH4超胞中原子位置示意图
2.2 XRD测试
如图1所示,采用分步球磨掺杂方法制备了LiBH4/LiF共掺杂样品,即首先将LiBH4/LiF球磨2、5、24h以实现均匀混合,分别取出样品进行XRD测试。如图2所示,共掺杂样品较LiBH4单相掺杂样品的组成成分能有所改变,纯样LiBH4在2(θ)为24.0、25.5、27.0有特征峰。球磨2h的LiBH4/LiF掺杂样品,不仅出现了明显的LiF特征峰,而且纯样LiBH4的特征峰有所减弱。如图1所示,以LiBH4/LiF球磨24h的掺杂样品最为显著;即纯样LiBH4在2(θ)在24.0、25.5、27.0的特征峰明显削弱,LiF的特征峰也是削弱相对明显;并且,该掺杂样品在28、32、36.5出现较强的峰值,可初步判断,这可能是由于LiF中F部分取代LiBH4中H的结果,即有LiBH4-xFx晶格形成。
2.3 热性能测试
图3为不同球磨时间所得掺杂样品LiBH4/LiF的DSC图,测试时选用的升温速率为5℃/min。纯LiBH4分为3个热分解过程:在118℃左右,LiBH4晶型转变;286℃左右为LiBH4熔融过程,并伴有少量氢气放出;大约500℃时放氢量达到最高值最终在600℃时释放出总计9%的氢。如图3所示,掺杂样品LiBH4/LiF随着球磨时间的增加,第一个热分解的温度无明显的降低。对比纯LiBH4第二个分解峰,球磨2、5、24hLiBH4/LiF的样品,其分解温度均降低了17℃。球磨24h后制得LiBH4/LiF样品其放氢反应的峰温为478℃(如图3所示),相对于纯LiBH4样品降低了22℃。这表明,球磨24h制得的LiBH4/LiF样品形成了LiBH4-xFx晶格,从而降低LiBH4的放氢温度。

图2 不同球磨时间所得掺杂样品LiBH4/LiF的XRD图
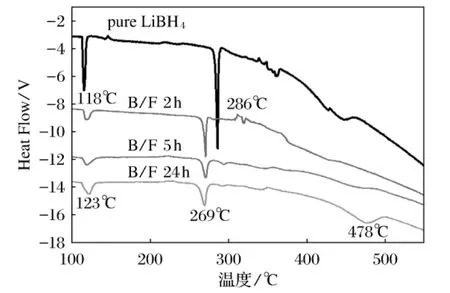
图3 不同球磨时间所得掺杂样品LiBH4/LiF的DSC图
3 实验结论
结合DSC与XRD的测试结果,LiF掺杂LiBH4样品,降低了纯LiBH4的放氢主峰温度。通过XRD测试分析,这是由于F部分取代LiBH4中H,LiBH4-xFx晶格形成的结果。对于不同球磨时间所制的LiBH4/LiF样品,球磨24h制得的LiBH4/LiF样品放氢温度最低,即放氢主峰温度478℃。并且,对于纯LiBH4熔融过程的热分解温度,也降低了17℃。这与XRD结果一致,该样品中LiBH4-xFx晶格对应的峰最强。
[1]陈军,朱敏.高容量储氢材料的研究进展[J].中国材料进展,2009,28(2):2-3.
[2]周晶晶,陈云贵,吴朝玲,等.新型轻质储氢材料的第一性原理原子尺度设计[J].物理学报,2009,58(7):4854-4855.
[3]孙立贤,宋莉芳,姜春红,等.新型储氢材料及其热力学与动力学问题[J].中国科学:化学,2010,40(9):1243-1245.
[4]周素芹,程晓春,居学海,等.储氢材料研究进展[J].材料科学与工程学报,2010,28(5):785.
[5]方占召,康向东,王平.硼氢化锂储氢材料研究[J].化学进展,2009,21(10):2213-2215.
[6]夏广林,余学斌,吴铸.Al添加对LiBH4可逆吸放氢性能影响的研究[J].稀有金属材料与工程,2009,38(9):161-162.
[7]唐文静,傅和青,黄洪.新型能源载体—储氢材料研究进展[J].化工新型材料,2006,34(10):22-23.
[8]毛松科.机械球磨固相化学反应合成AlH3及其放氢性能研究[D].兰州:兰州理工大学,2008:20-22.
[9]刘俊峰.球磨La2Mg17复合储氢材料结构及电化学性能研究[D].包头:内蒙古科技大学,2009:3-5.
[10]YUAN Pei Pei,LIU Bin Hong,ZHANG Bang Jie.Reversible Hydrogen Storage Composite Based on 6LiBH4+CaF2[J].J Phys Chem C,2011,115:7067-7069.
[11]YANG Jun,SUDIK A,SIEGEL D J.Hydrogen storage properties of 2LiNH2+LiBH4+ MgH2[J].J Alloy Compd,2007,446/447:345-349.
[12]MAO Jianfeng,GUO Zaiping,YU Xuebin.Enhanced hydrogen sorption properties in the LiBH4– MgH2system catalysed by Ru nanoparticles supported on multiwalled carbon nanotubes[J].J Alloy Compd,2011,509:5012-5015.
[13]RUDE L H,GROPPO E,ARNBJERG L M.Iodide substitution in lithium borohydride LiBH4– LiI[J].J Alloy Compd,2011,509:8299-8305.
[14]王新华,徐楼,吴晓诚.Ce基催化剂对2LiBH4/MgH2放氢性能的影响[J].稀有金属材料与工程,2011,40(11):1982-1984.
[15]杨明,王圣平,张运丰.储氢材料的研究现状与发展趋势[J].硅酸盐学报,2011,39(7):1053-1058.
[16]ORIMO S,NAKAMORI Y,ELISEO J R.Complex Hydrides for Hydrogen Storage[J].Chem Rev,2007,107:4123-4126.
[17]刘述丽,刘明明,张轲.Li-N-H储氢材料的高能球磨制备工艺研究[J].沈阳师范大学学报:自然科学版,2011,29(1):86-89.
[18]KOU Huaqin,ZHANG Xiaoxue,CHEN Lixin.Formation mechanism of MgB2in 2LiBH4+ MgH2system for reversible hydrogen storage[J].Trans Nonferr Metal Soc Chn,2011,21:1040-1046.
[19]李闯,周惦武,彭平.LiBH4-x(x=O,F和Cl)体系解氢性能的第一原理计算[J].化学学报,2012,70(1):71-77.
[20]郭威威,牛建平.改善LiBH4吸放氢动力学和热力学方法的研究进展[J].材料导报,2009,23(14):299-301.
[21]吴国涛,陈维东,熊智涛.设计新型高容量储氢材料[J].自然杂志,2011,33(1):27-33.
[22]杨敬葵.Li-Al-N-H复合体系储氢特性研究[D].杭州:浙江大学,2010:10-25.
[23]马宗强.氢能-21世纪的绿色能源[M].北京:化学工业出版社,2009:1-18.
[24]杨敏建,周仕学,张同环.碳微晶结构对球磨制备镁基储氢材料的影响[J].广东化工,2010,37(5):80-81.
[25]卢国俭,周仕学,马怀营.储氢材料85Mg10C4Ni1Al的制备及性能研究[J].现代化工,2007,27(9):42-45.
[26]张文丛,房文斌,罗念宁.储氢材料性能测试装置设计及应用[J].中国有色金属学报,2003,13(3):696-698.
