小麦幼苗对盐胁迫和水分胁迫的生理反应对比
2013-11-01王兰兰刘贺楠田丹丹吕永霞
王兰兰,刘 新,刘贺楠,田丹丹,吕永霞
(沈阳师范大学 化学与生命科学学院,沈阳 110034)
0 引 言
干旱和盐渍对植物生长和作物产量的不利超过其他自然灾害之和[1]。据统计,中国目前有3.8亿hm2以上盐碱地和0.07hm2亿以上盐渍化土壤,约占可耕地面积的20%,且呈逐年上升趋势[2-3]。
小麦,是世界上总产量第二的粮食作物,也是我国盐碱地主要栽培作物之一,在耕地不断减少、人口不断增长的情况下,研究小麦的耐旱耐盐机理,对开发和有效利用盐碱地具有重要的现实意义。研究表明,干旱属于渗透胁迫,导致细胞失水,严重的可造成细胞膨压的完全丧失,甚至细胞死亡。而盐分对植物生长的抑制机理是一个很复杂的问题,涉及到渗透胁迫、离子毒害等综合症状[4],但植物也通过积累可溶性物质进行渗透调节[5]以及提高各种抗氧化酶活性[6]等适应机制来提高其抗盐性。因此,开展小麦耐盐和耐旱性研究,进而了解小麦抵御渗透胁迫的生理机制,将为土地资源的合理开发利用提供理论依据,进而改善生态环境,缓解粮食问题。
研究以小麦幼苗为材料,利用PEG-6000及NaCl溶液作为渗透调节剂模拟水分胁迫及盐胁迫,从细胞膜透性、渗透调节、其他有关生理生化变化方面,较系统地研究小麦幼苗对水分胁迫及盐胁迫的各种生理反应,并比较小麦幼苗对水分胁迫与盐胁迫的生理反应差异,从而探讨小麦幼苗抵御渗透胁迫的生理机制,为小麦抗旱及抗盐害高产优质栽培提供理论依据。
1 材料与方法
1.1 实验材料
挑选均一饱满且无病虫害小麦种子,经表面消毒后,用去离子水冲洗数次,随后暗条件下25℃浸种12h。吸胀后的种子,在25℃光照培养箱中催芽12h,然后挑选发芽一致的种子均匀摆在纱网上,放于盛有适量水的塑料烧杯中,室温下培养,培养至一叶一心期备用。
1.2 实验处理
在小麦一叶一心期时进行胁迫处理。盐胁迫采用NaCl浓度分别为50、100、150、200mmol/L,水势为-0.23、-0.46、-0.68、-0.91MPa;干旱胁迫采用等渗于-0.23、-0.46、-0.68、-0.91 MPa的PEG-6000溶液,水势的计算按Michel和Kaufmann[7]经典公式计算,浓度分别为12.7%、18.7%、23.3%、26.8% (w/v),分别作为轻度、中度、重度和超重度处理来模拟水分胁迫的水分亏缺程度,以无NaCl和PEG处理为对照。所用溶液均用Hoagland营养液溶配制,分别于胁迫处理第7d后取样对各指标进行测定,同一指标重复3次。在水分胁迫及盐胁迫处理过程中,对照始终使用Hogland营养液培养。
1.3 测定方法
采用外渗电导率法测定细胞膜透性[8];丙二醛(MDA)含量测定采用TBA(硫代巴比妥酸)法测定[9];游离脯氨酸含量测定采用酸性茚三酮法[10];可溶性糖含量测定采用蒽酮法[11];叶绿素的提取和含量测定采用混合提取液法[12];叶绿素荧光参数测定:采用FMS2调制式荧光测定仪(英国Hansatech公司)测定荧光参数。
1.4 数据处理
采用SPSS 12.0软件,针对不同浓度处理的实验数据进行方差分析(One-way ANOVA)分析,比较各处理项与对照项之间差异显著性,数据以平均值±标准差(mean±SE)表示。
2 结果与分析
2.1 水分胁迫和盐胁迫对小麦叶片相对电导率影响
研究结果表明(如图1),随着胁迫程度的增加,两种胁迫下小麦叶片的相对电导率均逐渐增大;盐胁迫处理下小麦叶片的相对电导率均显著高于等渗水分胁迫处理。
2.2 水分胁迫和盐胁迫对小麦叶片MDA含量影响
研究结果表明(如图2),水分胁迫下,随着胁迫程度的增加,小麦叶片MDA含量升高;等渗盐处理后,MDA含量普遍高于水分胁迫;随着盐浓度升高,小麦叶片MDA含量呈先上升后降低趋势,NaCl处理i浓度在150mmol/L时MDA含量出现最大值,之后下降,到超重度胁迫时两种胁迫下MDA的含量相差不大。
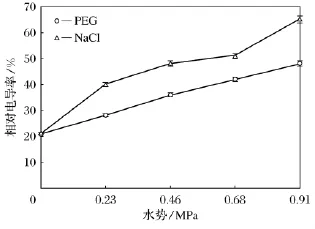
图1 水分胁迫和盐胁迫对小麦叶片相对电导率影响
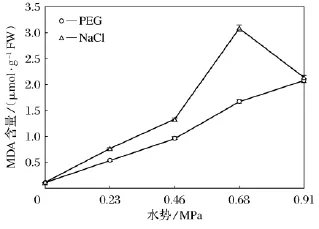
图2 水分胁迫和盐胁迫对小麦叶片MDA含量影响
2.3 水分胁迫和盐胁迫对小麦叶片游离脯氨酸含量影响
研究结果表明(如图3),随着渗透胁迫强度的增大,游离脯氨酸含量普遍高于对照,水分胁迫和盐胁迫对比,水分胁迫下,游离脯氨酸含量除重度胁迫外普遍高于盐胁迫处理。
2.4 水分胁迫和盐胁迫对小麦叶片可溶性糖含量影响
研究结果表明(如图4),两种胁迫处理下,随着胁迫程度的增加,可溶性糖含量均是呈先上升后下降趋势;盐胁迫下可溶性糖含量普遍高于水分胁迫处理。
2.5 水分胁迫和盐胁迫对小麦叶片叶绿素含量影响
研究结果表明(如图5),在两种胁迫处理下,随着胁迫程度的增加,叶绿素b含量的变化不显著,而总叶绿素含量随着叶绿素a含量的变化而变化,二者变化趋势相同,均为低渗条件下与对照比较,略有升高后降低;等渗条件下,重度胁迫时,盐胁迫下叶绿素含量显著低于水分胁迫处理。
2.6 水分胁迫和盐胁迫对小麦叶片Fv/Fm影响
研究结果表明(如图6),随着两种胁迫程度的增加,与对照比较,小麦Fv/Fm在低渗条件下略有上升后普遍降低,等渗条件下,盐胁迫下小麦Fv/Fm显著低于水分胁迫处理。
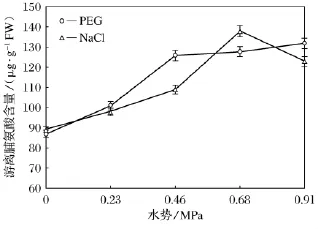
图3 水分胁迫和盐胁迫对小麦叶片游离脯氨酸含量影响
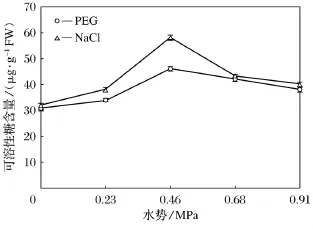
图4 水分胁迫和盐胁迫对小麦幼苗可溶性糖含量影响

图5 水分胁迫和盐胁迫对小麦幼苗叶绿素含量影响
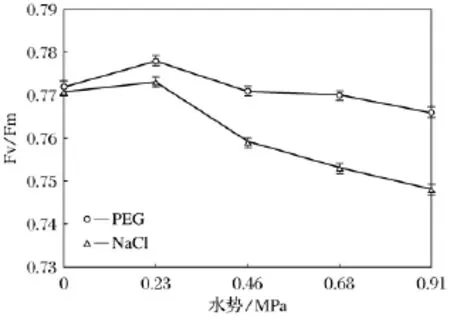
图6 水分胁迫和盐胁迫对小麦幼苗Fv/Fm影响
3 讨 论
3.1 水分胁迫和盐胁迫对小麦叶片细胞质膜透性影响
本研究结果表明,水分胁迫和盐胁迫下,与对照比较,小麦幼苗相对电导率和MDA含量显著升高,表明渗透胁迫下,细胞质膜透性增大,膜质过氧化加剧。等渗盐处理后,相对电导率和MDA含量普遍高于水分胁迫,说明盐胁迫除对植物产生渗透胁迫外还存在离子毒害作用。另外盐胁迫下,MDA含量在150mmol/L时出现最大值,之后含量呈下降趋势,可能为高浓度盐胁迫已经造成了细胞膜结构的破坏以及正常生理功能的紊乱所致。
3.2 水分胁迫和盐胁迫对小麦叶片渗透调节物质含量影响
渗透调节可以帮助植物顺应干旱或盐的胁迫,小麦在盐分或干旱胁迫下渗透调节主要是通过可溶性糖,脯氨酸等亲水性溶质的积累而实现[13]。不同研究均表明小麦在干旱胁迫或盐胁迫下,可溶性糖增加,参与调节细胞渗透势,提高渗透调节能力,从而保持相对良好的叶片水分状况[14-15]。本研究表明,水分或盐胁迫条件下,两种渗透调节物质含量普遍高于对照,而可溶性糖积累量随胁迫程度增加出现先上升后略有下降的现象,这可能是因为渗透调节作用有一定的局限性,严重胁迫使植物渗透调节能力降低或丧失[16],从而导致可溶性糖含量的下降。而等渗盐胁迫下可溶性糖含量普遍高于水分胁迫,而游离脯氨酸含量普遍低于盐胁迫,说明可溶性糖可能是盐胁迫下的一种主要渗透调节物质,而游离脯氨酸可能是水分胁迫下的主要渗透调节物质。
3.3 水分胁迫和盐胁迫对小麦叶片光合作用的影响
申玉香[17]等低盐胁迫处理小麦叶片的叶绿素下降速度缓慢,高盐胁迫处理叶绿素含量快速下降。本研究结果表明,叶绿素含量低渗条件下与对照比较,略有升高后降低,可能是植物自身对外界刺激有一个应激反应,而使叶绿素含量上升。而后由于盐胁迫下,植物吸收不到足够的水分和矿质营养,造成营养不良,致使叶绿素含量降低,进而影响植物对光能的吸收。尤其是促进了叶绿素a的降解,从而导致总叶绿素含量的降低。重度渗透胁迫时,等渗盐胁迫下叶绿素含量显著低于水分胁迫。这也可能是离子毒害和细胞脱水的累加作用所致。
研究认为植物叶绿素荧光的变化可以反映植物受胁迫的情况[18]。本研究表明,轻度胁迫对小麦的Fv/Fm起到促进作用,而中度和重度胁迫则使Fv/Fm下降,这与叶绿素含量变化相一致,表明Fv/Fm的变化可能受叶绿素含量变化的直接影响。等渗条件下,盐胁迫下小麦Fv/Fm显著低于水分胁迫,说明除了脱水作用,盐胁迫的离子伤害及其引发的过氧化作用可能是小麦Fv/Fm大幅降低的主要原因。
[1]陈成升,谢志霞,刘小京,等.渗盐分、干旱胁迫下冬小麦叶片部分渗透调节物质的动态变化[J].植物研究,2009,29(6):708-713.
[2]LI J,SHHUANG Y Z H.Physiological studies of plant salt tolerance[J].Chin Bull Bota,1995,12(3):15-19.
[3]ZHU J K.Plant salt tolerance[J].Trends Plant Sci,2001,6:66-71.
[4]MUNNS R.Comparative physiology of salt and water stress[J].Plant Cell Environ,2002,25(2):239-250.
[5]NUCCIO M L,RHODES D R,MCNEIL S D,et al.Metabolic engineering of plants for osmotic stress resistance[J].Curr Opin Plant Biol,1999(2):128-134.
[6]时忠杰,胡哲森,李荣生.水分胁迫与活性氧代谢[J].贵州大学学学报:农业与生物科学版,2002,21(2):140-145.
[7]MICHEL E,KAUFMANN R.The osmotic potential of polyethylene glycol 6000[J].Plant Physiol,1973,51:914-924.
[8]郝建军,刘延吉.植物生理学实验技术[M].沈阳:辽宁科学技术出版社,2001.
[9]赵世杰,刘华山,董新纯.植物生理学实验指导[M].北京:中国农业科技出版社,1998:161-162.
[10]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000:161-162.
[11]汤章城.现代植物生理学实验指南[M].北京:科学出版社,2003:127-217.
[12]张宪政.植物叶绿素含量测定一丙酮乙醇混合液法[J].辽宁农业科学,1986(3):26-28.
[13]杜金友,陈晓阳,胡东南,等.干旱胁迫条件下胡枝子渗透物质的变化[J].福建林学院学报,2006,26(4):349-352.
[14]梁超,王超,杨秀风,等.“德抗961”小麦耐盐生理特性研究[J].西北植物学报,2006,26(10):2075-2082.
[15]李德全,邹琦,程炳嵩.土壤干旱下不同抗旱性小麦品种的渗透调节和渗透调节物质[J].植物生理学报,2007,18(2):34-37.
[16]王霞,侯平,伊林克.水分胁迫对柽柳植物可溶性物质的影响[J].干旱地区农业研究,1999,16(2):1-10.
[17]申玉香,郭文善,周影,等.盐分胁迫对小麦花后剑叶衰老特性和产量的影响[J].扬州大学学报,2007,28(1):60-63.
[18]卢从明,张其德,匡廷云.水分胁迫对小麦叶绿体激发能分配和光系统Ⅱ原初光能转换效率的影响[J].生物物理学报,1995,11(1):82-86.
