山茱萸环烯醚萜总苷对晚期糖基化终末产物诱导的肾系膜炎症反应的调节
2013-11-01张晓双刘继平
郭 洁,张晓双,刘继平
(陕西中医学院药理教研室,陕西咸阳 712046)
糖尿病肾病是糖尿病常见的微血管并发症之一,是终末期肾功能衰竭的主要原因。流行病学调查显示终末期肾脏病的年发病率为3.36%,其中糖尿病引发的慢性肾病占糖尿病患者的一半,而约20%~40%的糖尿病肾病患者进展为终末期肾病[1-2]。现代病理学研究显示糖尿病肾病的病理改变为肾小球肥大、细胞外基质积聚、基底膜增厚,导致弥漫性或结节性肾小球硬化和肾功能衰竭[3]。糖尿病肾病的发病机制复杂,其机理尚未完全明白。最新的研究显示,晚期糖基化终末产物(AGEs)诱导的炎症反应在糖尿病肾病的发生发展中扮演着重要的角色[4]。AGEs是还原糖与蛋白、脂质或核酸的氨基经过希夫氏碱反应形成的一类化合物,可以激发炎症反应,造成肾系膜细胞损伤及病变[5]。因此,通过干预AGEs诱导的炎症反应减轻肾细胞的损伤成为有效的策略。
环烯醚萜总苷为山茱萸一类重要的成分。研究显示,山茱萸环烯醚萜总苷对糖尿病肾病病变具有保护作用[6]。山茱萸环烯醚萜总苷能通过抑制氧化应激来对抗AGEs诱导的肾系膜损伤作用[7]。除此以外,山茱萸环烯醚萜总苷能不同程度地减轻肾小球系膜增生、基底膜增厚、糖原沉积以及肾小管空泡透明变性等[6]。但是,对AGEs诱导的炎症反应未见报道,且机制也不明确。因此,本研究对山茱萸环烯醚萜总苷对抗AGEs诱导的炎症反应活性进行了评估,且探索了可能的作用机制。
1 材料
1.1 药物和制剂 山茱萸环烯醚萜总苷由实验室自制,主要包括马钱苷及莫诺苷等,经HPLC测定分析总苷纯度达到 67.4%;IL-6(批号:KGERC003-1),IL-10(批号:KGERC004-2),肿瘤坏死因子(TNF-α,批号:KGERC007-1)和单核细胞趋化蛋白-1(MCP-1,批号:KGERC009-1)ELISA试剂盒购自北京科盈美科技有限公司;牛血清白蛋白,D-葡萄糖,氨基胍购自 Sigma公司;RAGE抗体购自 Sinio Biological Inc.;低糖DMEM培养基(Gibco);胎牛血清(FBS),杭州四季青。
1.2 仪器 酶标仪(美国 Moleculor Devices,USA);LDZ4-1.2离心机(北京精力离心机有限公司);超净工作台(苏州净化设备有限公司);164-5051型Western电泳仪(美国Bio-Rad公司);BL310型电子天平(德国Sartorias公司),压力蒸汽灭菌器(上海博迅医疗设备厂)。
1.3 细胞及动物 大鼠肾小球系膜细胞株HBZY-1,由武汉细胞生物研究所提供。SPF级昆明种小鼠,雌雄各半,雄性,体质量(18.0±2.0)g,由第四军医大学实验动物中心提供,合格证号SCXK-军-2011-016。
2 方法
2.1 AGEs的制备 根据文献的制备方法[7],将5%牛血清白蛋白与0.5 mol/L的D-葡萄糖溶于0.2 mol/L的磷酸盐缓冲溶液PBS(pH=7.2)中,混合液经0.22μm滤膜过滤除菌后,置于无菌条件37℃ 孵育3个月。孵育完毕,将获得的溶液以透析膜置于0.1 mol/L的PBS溶液中过夜除去未结合的分子,最后再用0.22μm滤膜过滤除菌,4℃下存储备用。
2.2 细胞培养 大鼠肾小球系膜细胞株HBZY-1细胞悬液接种至25 cm2的聚苯乙烯培养瓶中(GIBCO),以低糖DMEM培养基(含10%胎牛血清、100 U/mL青/链霉素)培养。细胞保持在37℃条件95%空气/5%CO2的培养箱中,待细胞长至80%~90%融合度时,以0.125%胰酶-0.1%EDTA消化,制备细胞悬液,作进一步实验用。
2.3 巨噬细胞穿透能力测定 根据已有文献的试验方法[8],将PBS溶液置于4℃冷藏2 h,待完全冷却,取10 mL PBS注入昆明种小鼠腹腔,迅速脱臼处死,置于75%酒精中浸泡30 s,于超净台无菌环境中抽取腹液,置于10 mL离心管中,3000×g离心5 min,将沉淀物以0.83% 氯化铵吹匀,裂解红细胞,3000×g离心5 min,将剩余的沉淀物以培养基吹匀,计数(1×105个/mL),接种至24孔Transwell的上室,下室接种HBZY-1系膜细胞(5×105个/mL),培养基应高于上室膜的高度,保证巨噬细胞的孵育条件,然后共同孵育24 h。待孵育完毕,分别设牛血清白蛋白组(200μg/mL)、AGEs(200μg/mL)组、阳性对照氨基胍(10μmol/L)+AGEs(200μg/mL)、山茱萸环烯醚萜总苷高剂量(1 mg/mL)+AGEs(200μg/mL)、山茱萸环烯醚萜总苷中剂量(0.5 mg/mL)+AGEs(200μg/mL)和山茱萸环烯醚萜总苷低剂量(0.25 mg/mL)+AGEs(200μg/mL)。先给予药物,间隔30 min后再给予AGEs。孵育24 h后,取出上室,以脱脂棉轻轻擦拭小室的内侧,PBS润洗3次后,以1%结晶紫染色10 min,取出洗去未结合的结晶紫,然后以刀片取膜,以30%冰醋酸溶解,于580 nm波长下测定吸光度值。
2.4 炎症因子的ELISA测定 在共培养结束后,将细胞的上清液取出,根据试剂盒的说明,测定细胞上清液中的炎症因子 IL-6、IL-10、MCP-1和TNF-α的分泌水平。在反应完毕后,样品于振荡器中震荡1 min以混匀,然后酶标仪中分别在450 nm条件下测定IL-6,IL-10,MCP-1和 TNF-α样品的吸光度值。根据对照品标注曲线计算IL-6,IL-10,MCP-1和TNF-α的水平。
2.5 ICAM-1和 TGF-β1蛋白的 Western blot分析将1×106个/mL接种至6孔板中,给药孵育后,以冰冷的PBS溶液润洗3次,以细胞裂解液提取蛋白。匀浆转移至 Ep管中,14000×g离心 15 min,取上清,以lowry法[6]测定上清液中的蛋白浓度。将定量好蛋白量的蛋白提取液(50μg)与蛋白电泳上样缓冲液混合,煮5 min,然后上样,以聚丙烯酰胺凝胶电泳10%SDS-PAGE进行分离(浓缩胶80 V恒压30 min,分离胶100 V恒压90 min)。完毕取出凝胶,置于转移缓冲液中平衡15 min。准备滤纸及NC膜,分别置入转移缓冲液及去离子水中,进行湿电转移(恒流200 mA通电,电转移100 min)。NC膜在5%脱脂奶粉封闭液中4℃封闭过夜,弃去封闭液,不洗,依次加ICAM-1(1∶1000)和 TGF-β1(1∶1000)一抗、孵育、洗涤、HRP结合的二抗(1∶5000)、孵育2 h,然后用TBST充分洗膜,漂洗4次,每次10 min。最后以ECL试剂盒按规定方法进行显影曝光。图像以Image-Pro plus(version 415,USA)处理并进行定量分析。β-actin作为内参进行比较分析。
3 结果
3.1 山茱萸环烯醚萜总苷对巨噬细胞迁移能力的影响 从图1可以看出,与牛血清白蛋白对照组相比,模型组细胞在给予AGEs刺激24 h后,紫色结晶明显增多(P<0.01)。在先给予阳性对照药AGEs抑制剂氨基胍,再给予AGEs后,AGEs诱导迁移的巨噬细胞显著减少(P<0.01)。与AGEs模型组相比,在先给予各剂量组山茱萸环烯醚萜总苷(1.0、0.5、0.25 mg/mL)后,迁移巨噬细胞均明显下降(P<0.05,P<0.01)。图2的结果显示AGEs组的吸光度值为0.29±0.02,而不同山茱萸环烯醚萜总苷给药组(1.0、0.5、0.25 mg/mL)的吸光度值分别为 0.17±0.02(高),0.22±0.03(中),0.27±0.01(低),相对的抑制率为42.09% ±7.25%,26.44%±10.23%,20.84% ±6.84%,说明山茱萸环烯醚萜总苷具有抑制AGEs诱导的巨噬细胞迁移的作用,并且该抑制作用呈剂量。
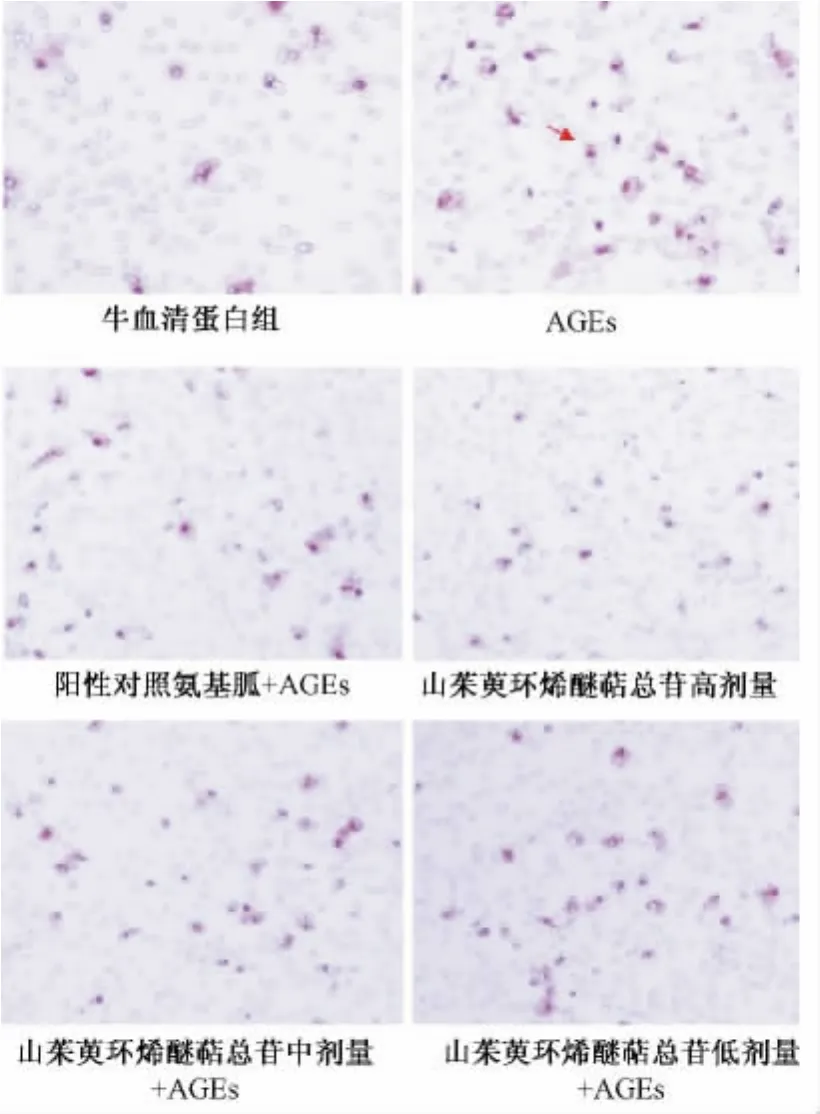
图1 巨噬细胞迁移图(结晶紫染色,200×)Fig.1 Macrophage migration(crystal violet staining,200×)

图2 迁移的巨噬细胞吸光度值Fig.2 Absorbance value of migration of macrophages
3.2 山茱萸环烯醚萜总苷对炎症因子IL-6,IL-10,MCP-1和TNF-α水平的影响 与空白对照200μg/mL牛血清白蛋白组相比,给予200μg/mL AGEs 24 h后,模型组炎症因子IL-6,IL-10,MCP-1和TNF-α水平均有明显增加(P<0.05,P<0.01)。但是在给予不同剂量山茱萸环烯醚萜总苷(1.0、0.5 mg/mL)后,与模型组相比,高、中剂量给药组均能剂量依赖性地降低 IL-6、IL-10、MCP-1和TNF-α水平,具有显著的统计学意义(P<0.05,P<0.01)。结果表明,山茱萸环烯醚萜总苷具有减轻AGEs-诱导的炎症反应,降低炎症因子的分泌水平,减缓系膜损伤。见表1。
表1 山茱萸环烯醚萜总苷对HBZY-1细胞IL-6,IL-10,MCP-1和TNF-α水平的影响(,n=6)Tab.1 Effect of iridoid glucosides from Corni officinalis Fructus on the levels of IL-6,IL-10,MCP-1 and TNF-α in HBZY-1 cells(,n=6)
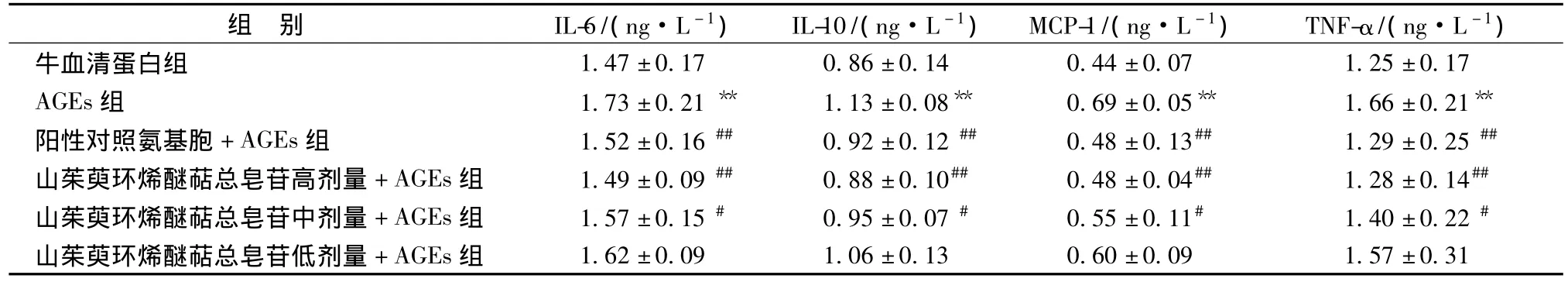
表1 山茱萸环烯醚萜总苷对HBZY-1细胞IL-6,IL-10,MCP-1和TNF-α水平的影响(,n=6)Tab.1 Effect of iridoid glucosides from Corni officinalis Fructus on the levels of IL-6,IL-10,MCP-1 and TNF-α in HBZY-1 cells(,n=6)
注:与牛血清蛋白组相比,**P<0.01;与AGEs组相比,#P<0.05,##P<0.01
组 别 IL-6/(ng·L-1) IL-10/(ng·L-1) MCP-1/(ng·L-1) TNF-α/(ng·L-1)1.47±0.17 0.86±0.14 0.44±0.07 1.25±0.17 AGEs组 1.73 ±0.21 ** 1.13 ±0.08** 0.69±0.05** 1.66±0.21**阳性对照氨基胞+AGEs组 1.52±0.16## 0.92±0.12## 0.48±0.13## 1.29±0.25##山茱萸环烯醚萜总皂苷高剂量+AGEs组 1.49±0.09## 0.88±0.10## 0.48±0.04## 1.28±0.14##山茱萸环烯醚萜总皂苷中剂量+AGEs组 1.57±0.15# 0.95±0.07# 0.55±0.11# 1.40±0.22#山茱萸环烯醚萜总皂苷低剂量+AGEs组牛血清蛋白组1.62±0.09 1.06±0.13 0.60±0.09 1.57±0.31
3.3 山茱萸环烯醚萜总苷对促炎症因子ICAM-1和TGF-β1蛋白表达的影响 Western blot分析结果显示,与牛血清白蛋白组相比,在给予AGEs刺激后,促炎症因子ICAM-1和TGF-β1的蛋白表达显著增加(P<0.01)。而先给予不同剂量山茱萸环烯醚萜总苷后,再给AGEs后,ICAM-1和TGF-β1的蛋白表达被剂量依赖性地下调(图3)。与AGEs组相比,具有显著的统计学差异(P<0.05,P<0.01)。统计结果显示,AGEs模型组ICAM-1的蛋白表达水平为1.54±0.14,而各剂量山茱萸环烯醚萜总皂苷组(1.0、0.5、0.25 mg/mL)的ICAM-1蛋白表达水平分别为0.66±0.03、1.01±0.12、1.28±0.08;对于 TGF-β1,AGEs模型组的蛋白水平为1.59±0.15,不同剂量山茱萸环烯醚萜总苷组的蛋白表达分别为0.73±0.07、0.77±0.11、1.32±0.14。Western blot分析结果表明山茱萸环烯醚萜总苷能下调AGEs诱导的促炎症因子的蛋白表达,降低炎症反应。
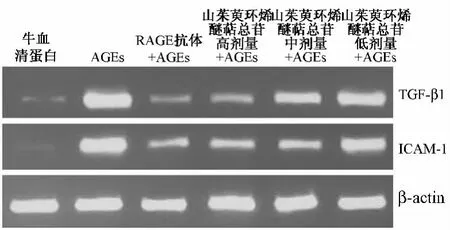
图3 ICAM-1和 TGF-β1 的 western blot图Fig.3 Western blot analysis of ICAM-1 and TGF-β1
对于可能的作用机制,以AGEs受体(RAGE)的特异性抗体来阻断AGEs的损伤作用。图3和表2的结果显示,在先给予5μg/mL的RAGE抗体后,AGEs诱导的炎症反应被显著抑制(P<0.01)。这个结果提示AGEs诱导的炎症反应至少与RAGE的作用相关,且山茱萸环烯醚萜总苷减轻AGEs的炎症反应的作用与RAGE抗体的作用机制可能相似。
表2 山茱萸环烯醚萜总苷对 HBZY-1细胞 TGF-β1和ICAM-1蛋白表达的影响(,n=3)Tab.2 Effect of iridoid glucosides from Corni officinalis Fructus on TGF-β1 and ICAM-1 protein expressions(,n=6)
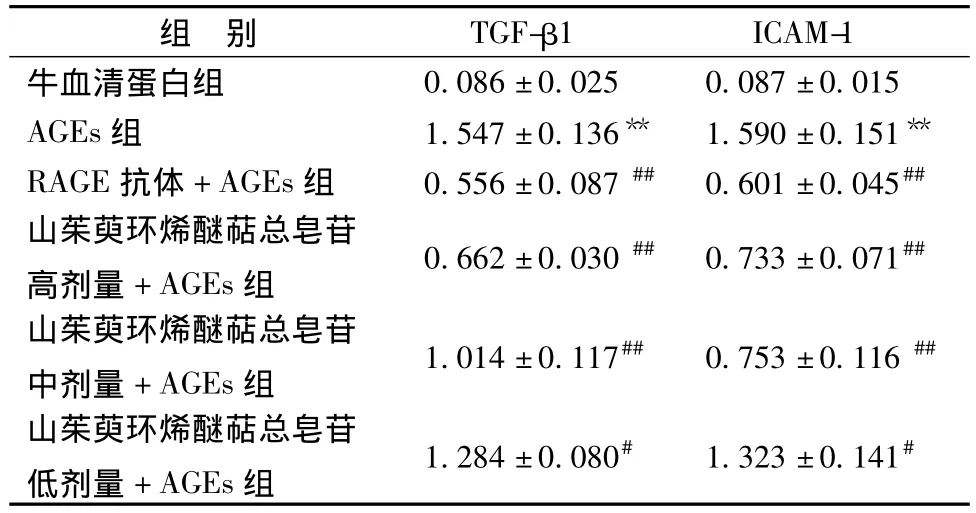
表2 山茱萸环烯醚萜总苷对 HBZY-1细胞 TGF-β1和ICAM-1蛋白表达的影响(,n=3)Tab.2 Effect of iridoid glucosides from Corni officinalis Fructus on TGF-β1 and ICAM-1 protein expressions(,n=6)
注:与牛血清蛋白组相比,**P<0.01;与AGEs组相比,#P<0.05;##P<0.01
ICAM-1牛血清蛋白组组 别 TGF-β10.086±0.025 0.087±0.015 AGEs组 1.547±0.136** 1.590±0.151**RAGE抗体+AGEs组 0.556±0.087## 0.601±0.045##山茱萸环烯醚萜总皂苷高剂量+AGEs组 0.662±0.030## 0.733±0.071##山茱萸环烯醚萜总皂苷中剂量+AGEs组 1.014±0.117## 0.753±0.116##山茱萸环烯醚萜总皂苷低剂量+AGEs组 1.284±0.080# 1.323±0.141#
4 讨论
糖尿病肾病是一种常见的糖尿病微血管并发症,主要病理特征是基底膜增厚,导致肾小球硬化,当发展到晚期,肾组织被大量破坏,肾的排泄功能出现进行性衰退,体内代谢产物及毒性物质排泄减少,引起体内环境的紊乱,临床上出现一系列的慢性肾功能衰竭表现,即终末期肾病综合征[9]。糖尿病肾病的发生发展与多种因素相关,如高血压、高血糖、肥胖、遗传等。其中,因高血糖引发的糖代谢紊乱是一个重要的因素。在生物机体内,异常增多的还原糖与体内的蛋白、核酸以及脂质发生非酶糖基化反应,形成一类具有毒性的交联产物,称之为晚期糖基化终末产物,即AGEs[10]。异常增多积聚的AGEs与受体结合,触发级联信号事件,导致肾小球病理变化。
越来越多研究显示,AGEs引发的炎症对糖尿病肾病的发生发展起着不可忽略的作用。Hotamisligil研究发现糖尿病肾病的炎症是一种慢性低度、代谢引发的炎症,主要由营养物和代谢过剩所触发[11]。AGEs可以导致多种促炎症因子和炎症因子的表达增加,例如MCP-1、ICAM-1、白细胞介素系列、TGF-β1等。在本研究中发现肾系膜细胞暴露于AGEs能显著增加炎症因子的表达。这与以往的研究相一致。
山茱萸环烯醚萜苷是山茱萸中一类重要的活性成分,研究显示其对糖尿病肾病具有显著的保护作用。山茱萸环烯醚萜总苷能使系膜细胞的S期细胞减少,上调细胞内SOD和GSH-Px活性,下调ROS和 MDA[7,12]。许慧琴等研究还显示山茱萸环烯醚萜总苷能减少AGEs在肾皮质的过度沉积,同时亦能显著抑制RAGE的过高表达[13]。但是,山茱萸环烯醚萜总苷对AGEs诱导的炎症反应还未见报道。在本实验的细胞共培养体系中,山茱萸环烯醚萜总苷能显著抑制巨噬细胞的迁移。山茱萸环烯醚萜总苷抑制AGEs诱导的炎症因子的释放,包括IL-6、IL-10、MCP-1和TNF-α。除此之外,山茱萸环烯醚萜总苷还下调AGEs诱导的促炎症ICAM-1和TGF-β1的蛋白表达。在肾脏组织的病变中,AGEs上调的ICAM-1,可以促使单核巨噬细胞在肾脏组织中浸润,释放各种炎性因子如IL-6、IL-10、TGF-β1等,进一步促进炎细胞的浸润[14]。对于炎症因子MCP-1,是单核细胞最强的趋化因子。研究发现MCP-1在糖尿病肾病中呈现表达上调,可以调节黏附分子的表达,促使单核细胞浸润肾组织[15]。
许多研究显示AGEs和RAGE的相互作用在糖尿病肾病的发生发展中起着重要的作用[16]。AGEs与系膜细胞表面的RAGE结合并活化RAGE,触发氧化应激反应,导致大量的活性氧和活性氮的生成。氧化应激引发肾系膜细胞内的促炎症反应,上调炎症介质的分泌,形成微炎症环境,最终引起肾系膜细胞的结构和功能的紊乱。在本研究中,以RAGE的特异性抗体阻断AGEs与RAGE的相互作用来探索山茱萸环烯醚萜总苷可能的作用机制。结果证明RAGE抗体能部分减轻AGEs诱导的炎症反应,而山茱萸环烯醚萜总苷具有类似的作用。这可能与山茱萸环烯醚萜总苷干预AGEs-RAGE的相互作用有关。但是山茱萸环烯醚萜总苷对抗AGEs诱导的炎症反应是否是通过此受体作用,仍需进一步的深入研究。
总之,本研究显示山茱萸环烯醚萜总苷能减轻AGEs诱导的肾系膜细胞的炎症反应,对糖尿病肾病具有较好的干预作用。这种作用可能是与干预AGEs-RAGE途径相关。
[1]Harjutsalo V,Maric C,Forsblom C,et al.Sex-related differences in the long-term risk of microvascular complications by age at onset of type 1 diabetes[J].Diabetologia,2011,54(8):1999.
[2]Rossing P.Diabetic nephropathy:worldwide epidemic and effects of current treatment on natural history[J].Curr Diab Rep,2006,6(6):483.
[3]张浩军.糖肾方对糖尿病肾病大鼠保护作用及机制研究[D].北京:北京中医药大学,2009.
[4]Ramasamy R,Yan S F,Schmidt A M.Receptor for AGE(RAGE):signaling mechanisms in the pathogenesis of diabetes and its complications[J]. Ann N Y Acad Sci, 2011,1243:102.
[5]Wada J,Makino H.Inflammation and the pathogenesis of diabetic nephropathy[J].Clin Sci(Lond),2013,124(3):152.
[6]许惠琴,朱 荃.山茱萸环烯醚萜总苷对实验性糖尿病肾病变的保护作用[J].南京中医药大学学报,2003,19(6):344.
[7]许惠琴,刘 洪,沈 健,等.山茱萸环烯醚萜总苷对AGEs培养肾小球系膜细胞的影响[J].中国药理学通报,2006,22(4):436
[8]Xu Y,Feng L,Wang S,et al.Calycosin protects HUVECs from advanced glycation end products-induced macrophage infiltration[J].J Ethnopharmacol,2011,137(1):370.
[9]高志田,王 刚.黄葵胶囊对糖尿病肾病患者微炎症状态的观察[J].中国中西医结合肾病杂志,2011,12(12):1105.
[10]俞晓军,袁国裕,邓爱玲.晚期糖基化终末产物对高血压及其合并早期肾损害相关性分析[J].心脑血管病防治,2009,9(5):338.
[11]Hotamisligil G.Inflammation and metabolic disorder[J].Nature,2006,444(7121):867.
[12]皮文霞,蔡宝昌,许惠琴,等.山茱萸环烯醚萜总苷对糖尿病血管并发症模型大鼠血清SOD的影响[J].中药新药与临床药理,2003,14(1):24.
[13]许惠琴,郝海平,皮文霞,等.山茱萸环烯醚萜总苷对糖尿病大鼠肾皮质糖化终产物及其受体mRNA表达的影响[J].中药药理与临床,2003,19(4):11.
[14]张雪竹,赵凯利,戴 琦,等.中药糖复康胶囊对早期糖尿病肾病炎性因子的影响[J].中国中药杂志,2003,28(5):455.
[15]周 阳,郝丽蓉,汪年松.糖尿病肾病的炎症致病机制[J].中国中西医结合肾病杂志,2012,13(4):365.
[16]Tomino Y,Hagiwara S,Gohda T.AGE-RAGE interaction and oxidative stress in obesity-related renal dysfunction[J].Kidney Int,2011,80(2):135.