贯叶连翘提取物长期给药对大鼠的肝肾毒性
2013-11-01谢家骏周广兴乔正东王建新
谢家骏,周广兴,乔正东,王建新
(1.上海中医药大学,上海 201203;2.复旦大学实验动物科学部,上海 200032;3.上海市浦东医院医学科研与创新中心,上海 201399;4.复旦大学药学院,上海 201203)
贯叶连翘Hypericum perforatum L.为藤黄科金丝桃属多年生草本植物,属临床上用于治疗抑郁症的有效药物,先后被《美国草药典》、《德国药典》等收载。国内具有丰富的贯叶连翘植物资源,近年来基于该植物资源的深度开发受到了广泛关注。前期本课题组采用现代药理手段和提取分离技术成功开发了贯叶连翘提取物,该提取物抗抑郁活性强,有效成分含量高,其中含黄酮类成分的量超过50%。有文献报道,黄酮类化合物具有抗氧化和促氧化的双重作用[1-3],过量摄入会产生细胞毒性,甚而导致肝肾等脏器的损伤[4-5]。为了确保临床用药的安全性,本实验选用大鼠为受试动物,以其肝肾等重要脏器为靶器官,观察贯叶连翘提取物长期给药可能对其产生的毒性反应。
1 实验材料
1.1 受试物 贯叶连翘提取物:深褐色浸膏粉,味微苦、微涩,含苯并二蒽酮类以金丝桃素(C30O16O8)计为1.76%,含总黄酮以芦丁(C27H30O16)计为61.14%,由上海市中药研究所植物化学研究室提供,批号001227。实验时,先置研钵中研细,然后按3份受试物加5份淀粉的比例研匀,用蒸馏水配制成15%(15 g浸膏粉/100 mL)的受试药液,然后,按需要用25%淀粉蒸馏水混悬液配制成7.5%和3.75%的受试药液,随配随用。
1.2 实验动物 SPF级SD大鼠,雌雄各半。实验开始时鼠龄为四周,体质量(60~75)g。由复旦大学实验动物科学部提供,实验动物生产合格证号SCXK(沪)2002-0002号。饲养环境:室温22~24℃,相对湿度55% ~70%,照度15~20 Lux,12 h明暗交替。饲喂中外合资上海西普尔-必凯实验动物有限公司生产的鼠用固体高压料。
1.3 检测仪器 SYSMEX F—800血液分析仪(日本东亚公司);COBAS EMIRA PLUS生化分析仪(瑞士罗氏公司);MA—4210尿液分析仪(桂林市华通医用仪器有限公司)。
2 实验方法
2.1 分组及给药 设受试物高、中、低3个剂量组,分别灌服贯叶连翘提取物 1.5、0.6、0.3 g/kg,每天1次,每周6次,连续26周,停药后观察8周。其中高剂量组单日用药剂量为最大给药剂量,为临床拟用剂量的200倍;中剂量组单日用药剂量高于药效高剂量,为临床拟用剂量的80倍;低剂量组单日用药剂量高于药效有效剂量,为临床拟用剂量的40倍。另设空白对照组,灌服等容量25%淀粉蒸馏水混悬液。
2.2 操作步骤 给药及恢复期间,每日观察动物的外观体征,行为活动,摄食情况,粪便性状等,每周称体质量、食耗量。给药13周、26周、停药8周时,分别取10/34、14/34、10/34动物(雌雄各半),禁食不禁水12 h后收集尿液作尿液常规检查,眼眶动脉处采血作血液学和血清生化学检查,戊巴比妥钠麻醉后放血处死作系统尸解,取主要脏器作肉眼检查,脏器称定质量及换算成脏器系数,并作石蜡切片、H.E染色及组织学镜检。
2.3 检测项目
2.3.1 血液学检查 白细胞数(WBC),红细胞数(RBC),血红蛋白(HGB),红细胞压积(HCT),红细胞平均体积(MCV),红细胞平均血红蛋白浓度(MCHC),血小板数(PLT),凝血时间(CT),网织红细胞百分率(Retic),中性粒细胞百分率(Neut),淋巴细胞百分率(Lymph),单核细胞百分率(Mono),嗜酸细胞百分率(Eos),嗜碱细胞百分率(Baso)。
2.3.2 血清生化检查 天门冬氨酸转氨酶(AST),丙氨酸转氨酶(ALT),尿素氮(BUN),血糖(GLU),碱性磷酸酶(ALP),总胆红素(TBIL),总蛋白(TP),白蛋白(ALB),总胆固醇(TCHO)和肌酐(CRE)。
2.3.3 尿液检查 亚硝酸盐(NIT),酸碱值(PH),尿糖(GLU),尿蛋白(PRO),隐血(BLD),酮体(KET),胆红素(BIL),尿胆元(URO)。
2.3.4 脏器系数测定 心、肝、脾、肺、肾、肾上腺、甲状腺、脑湿质量,并换算成脏器系数(脏体比)。脏器系数计算公式:脏器系数(脏体比)=[脏器湿质量(g)÷体质量(g)]×100%。
2.3.5 组织学镜检 心、肝、脾、肺、肾、肾上腺、胸腺、甲状腺、胃、前列腺、睾丸、卵巢、子宫、脑。
2.4 数据统计 计量资料多组间均数比较,方差齐性时采用方差分析,方差不齐时采用非参数检验;计数资料多组间均数比较,采用χ2检验。
3 实验结果
3.1 一般症状 受试物各剂量组及空白对照组大鼠活动正常,粪便成形,整个实验过程中,未见动物死亡。
3.2 体质量与食耗量变化 给药18周以后,中、高剂量组大鼠体质量增长缓慢,与空白对照组比,18~26周时雄性大鼠体质量增长下降显著(P<0.05或P<0.01)。与此相对应,届时中、高剂量组大鼠食耗量亦未见有明显增加趋势,与空白对照组比,雌性大鼠食耗量增长下降显著(P<0.05)。停药后,中、高剂量组大鼠体质量增长加快,食耗量增加,恢复期3~8周时,与空白对照组比均无显著差异(P>0.05)。见图1~2。
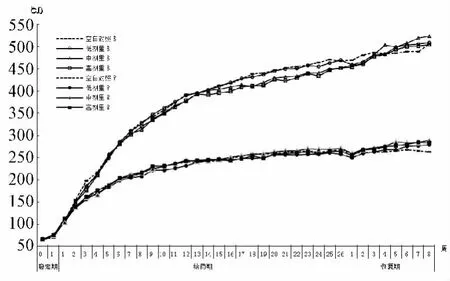
图1 贯叶连翘提取物对大鼠体质量轻时变化的影响Fig.1 Effect of Hypericum perforatum extracts on the change of body weight of rats with time
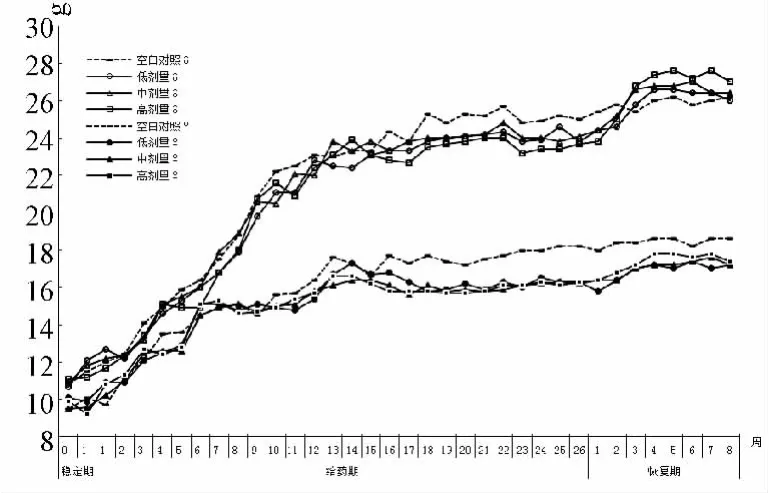
图2 贯叶连翘提取物对大鼠食耗量以时变化的影响Fig.2 Effect of Hypericum perforatum extracts on the change of food consumption of rats with time
3.3 血液学检测 给药13、26周及停药8周时,各用药组大鼠血液学各项指标平均值与相应对照组比均无显著性差异(P>0.05)。
3.4 血清生化检测 给药13周时,各用药组大鼠TP、ALB呈一定的升高趋势,其中,中剂量组大鼠ALP、中、高剂量组大鼠TP、ALB升高具有统计学意义(P<0.05或P<0.01);给药26周时,各用药组大鼠TP、ALB、BUN升高(P<0.01),中、高剂量组大鼠 CREA、TBIL亦升高(P<0.05)。其余各剂量组大鼠各时点各项血清生化学指标平均值与相应对照组比均无显著性差异(P>0.05)。见表1。
3.5 尿液检测 给药13周时,中、高剂量组pH升高(P<0.01)、URO降低(P<0.05);给药26周时,高剂量组URO降低(P<0.05)。其余各用药组大鼠各时点各项尿常规指标平均值与相应对照组比均无显著性差异(P>0.05)。见表2。
3.6 大体尸检 给药13、26周和恢复期8周时,心脏外膜光滑湿润,心肌呈红褐色,外观无异常;肝脏呈红褐色,被膜光滑湿润,质实且柔软,未见异常;肾表面光滑呈红褐色,肾脏被膜易剥离,外观无异常,肾切面皮、髓质境界清晰。其余各脏器大小、颜色均正常,未见有肿胀、出血、坏死等异常现象。
3.7 脏器湿质量和脏器系数 给药13周时,低、中、高剂量组大鼠肝、肾及睾丸系数均呈一定的升高趋势,与空白对照组比,低、高剂量组大鼠肝脏系数、中、高剂量组大鼠睾丸系数升高(P<0.05);给药26周时,中、高剂量组动物肾上腺湿质量及其系数显著上升(P<0.01);其余各剂量组大鼠各时点各脏器湿质量平均值与相应对照组比均无显著性差异(P>0.05)。见表3。
3.8 病理学检查 肝:空白对照组动物肝小叶结构清晰,肝细胞呈索状排列,未见明显的变性、坏死和炎症反应。给药13周时,高剂量组大鼠出现肝细胞轻度颗粒样变性3只(雄性1只,雌性2只),脂肪变性1只(雄性1只)。给药26周时,中剂量组大鼠出现肝细胞轻度颗粒样变性2只(雄性1只,雌性1只),脂肪变性有1只(雄性1只);高剂量组大鼠出现肝细胞轻度颗粒样变性6只(雄性3只,雌性3只),脂肪变性3只(雄性2只,雌性1只),且均有不同程度的炎性细胞浸润。空白对照组、低剂量组及停药8周时各剂量组动物肝细胞均未见明显的变性、坏死及炎症反应。
肾:空白对照组动物肾被膜和肾小球结构未见异常,各级肾小管、肾间质及肾盂基本正常。给药13周时,高剂量组大鼠肾脏近曲小管有轻度颗粒样变性,其中雄性3只,雌性2只。给药26周时,肾脏近曲小管呈轻度颗粒样变性的中剂量组大鼠有4只(雄性1只,雌性3只),高剂量组大鼠有11只(雄性7只,雌性4只)。空白对照组、低剂量组及停药8周时各剂量组动物肾脏均未发现有明显的毒性异常反应。
肾上腺:空白对照组大鼠肾上腺被膜、皮质和髓质分界清楚,基本正常;肾上腺球状带、束状带和网状带排列整齐,细胞均未见异常。给药26周时,中、高剂量组大鼠出现肾上腺皮质和/或髓质增生。停药8周后恢复正常。
除此之外,在给药13、26周以及停药8周时,各剂量组和对照组动物的心、脾、肺、胸腺、甲状腺、胃、前列腺、睾丸、卵巢、子宫、脑等组织器官均未发现明显异常。
表1 贯叶连翘提取物对大鼠血清生化学指标的影响()Tab.1 Effect of Hypericum perforatum extracts on serum biochemical indexes of rats()
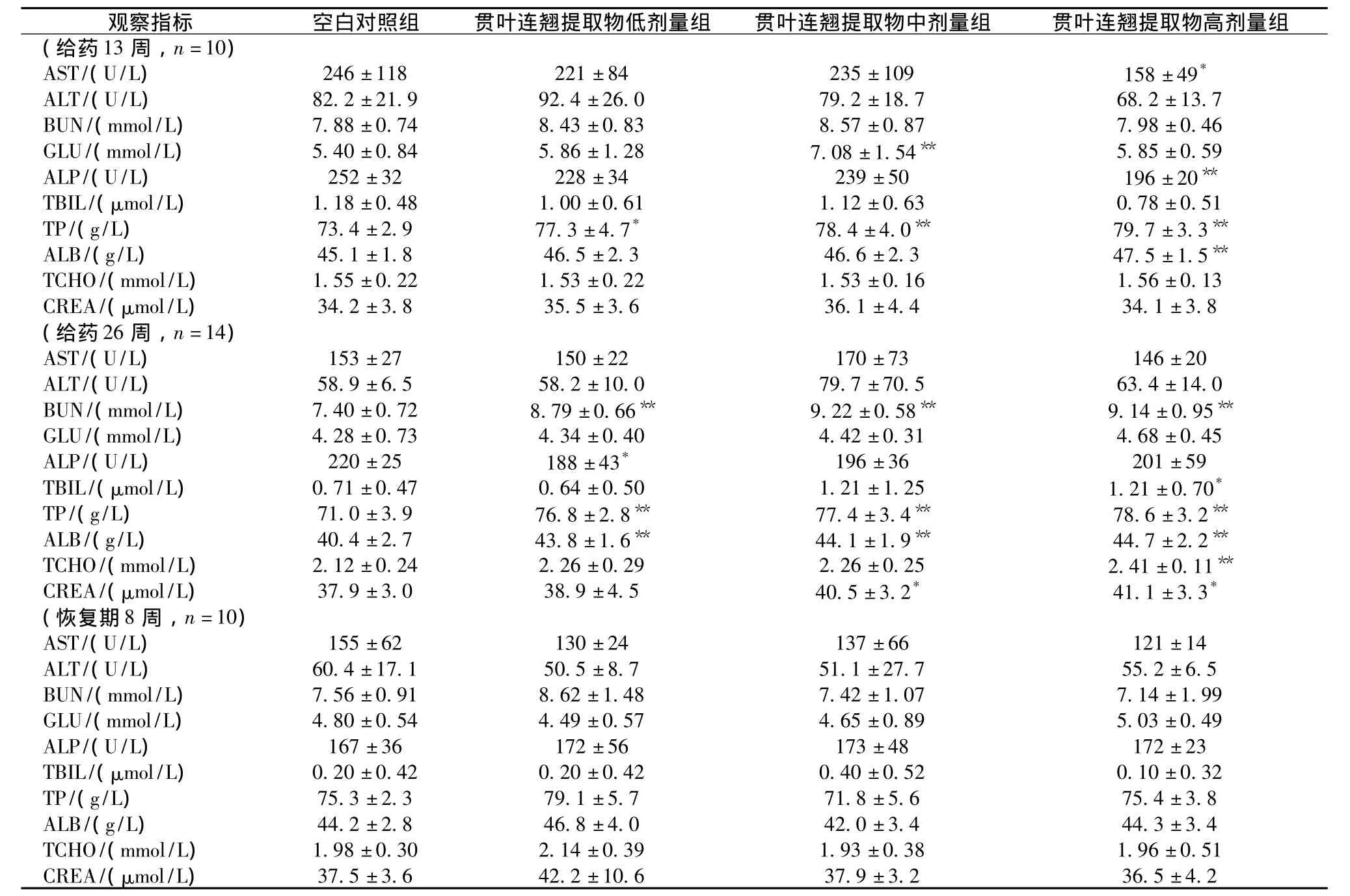
表1 贯叶连翘提取物对大鼠血清生化学指标的影响()Tab.1 Effect of Hypericum perforatum extracts on serum biochemical indexes of rats()
注:与空白对照组比较,*P<0.05,**P<0.01
剂量组观察指标 空白对照组 贯叶连翘提取物低剂量组 贯叶连翘提取物中剂量组 贯叶连翘提取物高(给药13周,n=10)AST/(U/L) 246±118 221±84 235±109 158±49*ALT/(U/L) 82.2±21.9 92.4±26.0 79.2±18.7 68.2±13.7 BUN/(mmol/L) 7.88±0.74 8.43±0.83 8.57±0.87 7.98±0.46 GLU/(mmol/L) 5.40±0.84 5.86±1.28 7.08±1.54** 5.85±0.59 ALP/(U/L) 252±32 228±34 239±50 196±20**TBIL/(μmol/L) 1.18±0.48 1.00±0.61 1.12±0.63 0.78±0.51 TP/(g/L) 73.4 ±2.9 77.3 ±4.7* 78.4 ±4.0** 79.7 ±3.3**ALB/(g/L) 45.1±1.8 46.5±2.3 46.6±2.3 47.5±1.5**TCHO/(mmol/L) 1.55±0.22 1.53±0.22 1.53±0.16 1.56±0.13 CREA/(μmol/L) 34.2±3.8 35.5±3.6 36.1±4.4 34.1±3.8(给药26周,n=14)AST/(U/L) 153±27 150±22 170±73 146±20 ALT/(U/L) 58.9±6.5 58.2±10.0 79.7±70.5 63.4±14.0 BUN/(mmol/L) 7.40±0.72 8.79±0.66** 9.22±0.58** 9.14±0.95**GLU/(mmol/L) 4.28±0.73 4.34±0.40 4.42±0.31 4.68±0.45 ALP/(U/L) 220±25 188±43* 196±36 201±59 TBIL/(μmol/L) 0.71±0.47 0.64±0.50 1.21±1.25 1.21±0.70*TP/(g/L) 71.0±3.9 76.8 ±2.8** 77.4 ±3.4** 78.6±3.2**ALB/(g/L) 40.4±2.7 43.8 ±1.6** 44.1 ±1.9** 44.7±2.2**TCHO/(mmol/L) 2.12±0.24 2.26±0.29 2.26±0.25 2.41±0.11**CREA/(μmol/L) 37.9±3.0 38.9±4.5 40.5±3.2* 41.1±3.3*(恢复期8周,n=10)AST/(U/L) 155±62 130±24 137±66 121±14 ALT/(U/L) 60.4±17.1 50.5±8.7 51.1±27.7 55.2±6.5 BUN/(mmol/L) 7.56±0.91 8.62±1.48 7.42±1.07 7.14±1.99 GLU/(mmol/L) 4.80±0.54 4.49±0.57 4.65±0.89 5.03±0.49 ALP/(U/L) 167±36 172±56 173±48 172±23 TBIL/(μmol/L) 0.20±0.42 0.20±0.42 0.40±0.52 0.10±0.32 TP/(g/L) 75.3±2.3 79.1±5.7 71.8±5.6 75.4±3.8 ALB/(g/L) 44.2±2.8 46.8±4.0 42.0±3.4 44.3±3.4 TCHO/(mmol/L) 1.98±0.30 2.14±0.39 1.93±0.38 1.96±0.51 CREA/(μmol/L)37.5±3.6 42.2±10.6 37.9±3.2 36.5±4.2
表2 贯叶连翘提取物对大鼠尿常规指标的影响()Tab.2 Effect of Hypericum perforatum extracts on urinalysis indexes of rats()
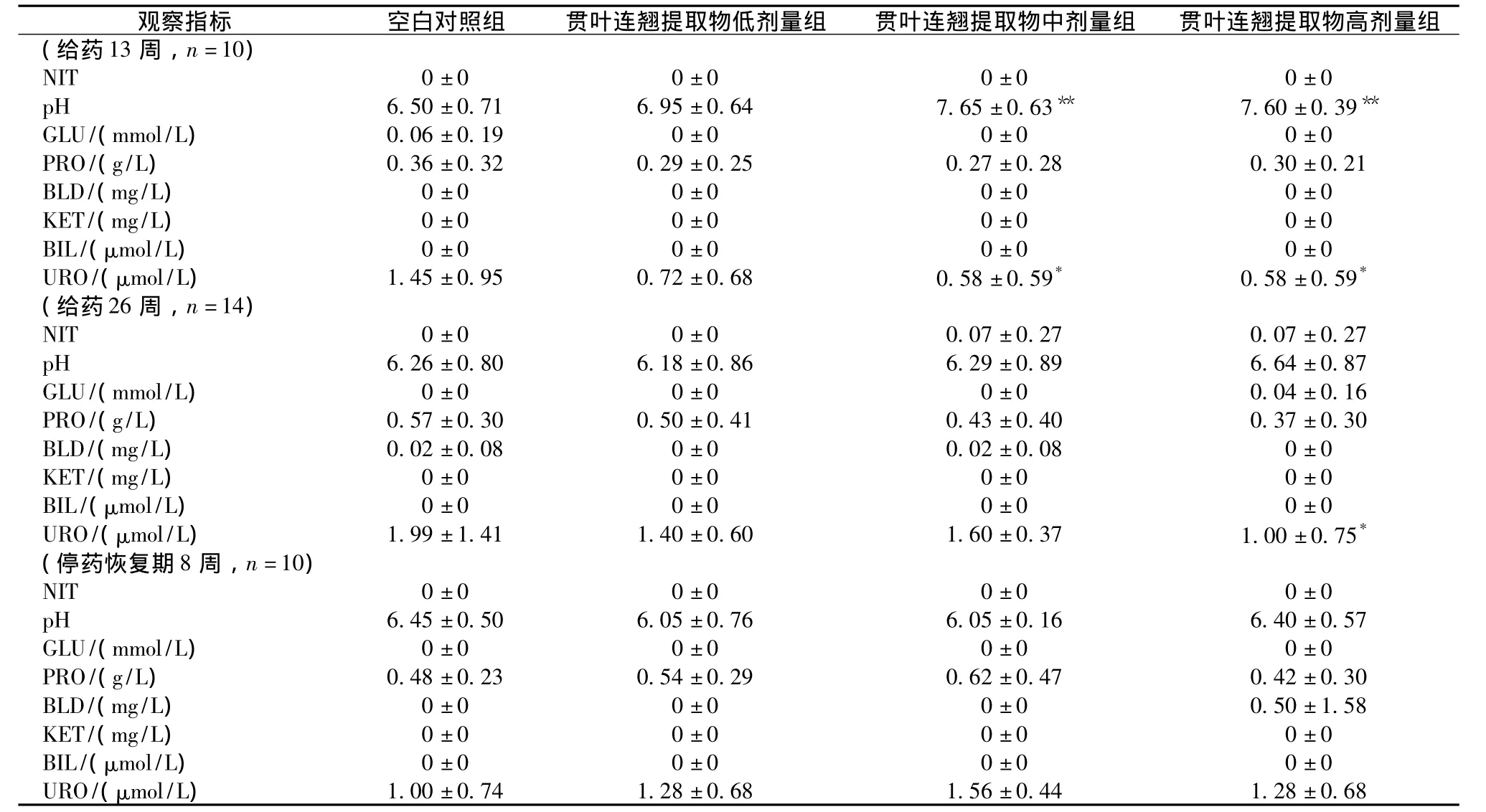
表2 贯叶连翘提取物对大鼠尿常规指标的影响()Tab.2 Effect of Hypericum perforatum extracts on urinalysis indexes of rats()
注:与空白对照组比较,*P<0.05,**P<0.01
剂量组(给药13周,n=10)观察指标 空白对照组 贯叶连翘提取物低剂量组 贯叶连翘提取物中剂量组 贯叶连翘提取物高NIT 0±0 0±0 0±0 0±0 pH 6.50 ±0.71 6.95 ±0.64 7.65 ±0.63** 7.60 ±0.39**GLU/(mmol/L) 0.06±0.19 0±0 0±0 0±0 PRO/(g/L) 0.36±0.32 0.29±0.25 0.27±0.28 0.30±0.21 BLD/(mg/L) 0±0 0±0 0±0 0±0 KET/(mg/L) 0±0 0±0 0±0 0±0 BIL/(μmol/L) 0±0 0±0 0±0 0±0 URO/(μmol/L) 1.45±0.95 0.72±0.68 0.58±0.59* 0.58±0.59*(给药26周,n=14)NIT 0±0 0±0 0.07±0.27 0.07±0.27 pH 6.26±0.80 6.18±0.86 6.29±0.89 6.64±0.87 GLU/(mmol/L) 0±0 0±0 0±0 0.04±0.16 PRO/(g/L) 0.57±0.30 0.50±0.41 0.43±0.40 0.37±0.30 BLD/(mg/L) 0.02±0.08 0±0 0.02±0.08 0±0 KET/(mg/L) 0±0 0±0 0±0 0±0 BIL/(μmol/L) 0±0 0±0 0±0 0±0 URO/(μmol/L) 1.99±1.41 1.40±0.60 1.60±0.37 1.00±0.75*(停药恢复期8周,n=10)NIT 0±0 0±0 0±0 0±0 pH 6.45±0.50 6.05±0.76 6.05±0.16 6.40±0.57 GLU/(mmol/L) 0±0 0±0 0±0 0±0 PRO/(g/L) 0.48±0.23 0.54±0.29 0.62±0.47 0.42±0.30 BLD/(mg/L) 0±0 0±0 0±0 0.50±1.58 KET/(mg/L) 0±0 0±0 0±0 0±0 BIL/(μmol/L) 0±0 0±0 0±0 0±0 URO/(μmol/L)1.00±0.74 1.28±0.68 1.56±0.44 1.28±0.68
表3 贯叶连翘提取物对大鼠脏器系数的影响()Tab.3 Effect of Hypericum perforatum extracts on organ coefficients of rats()
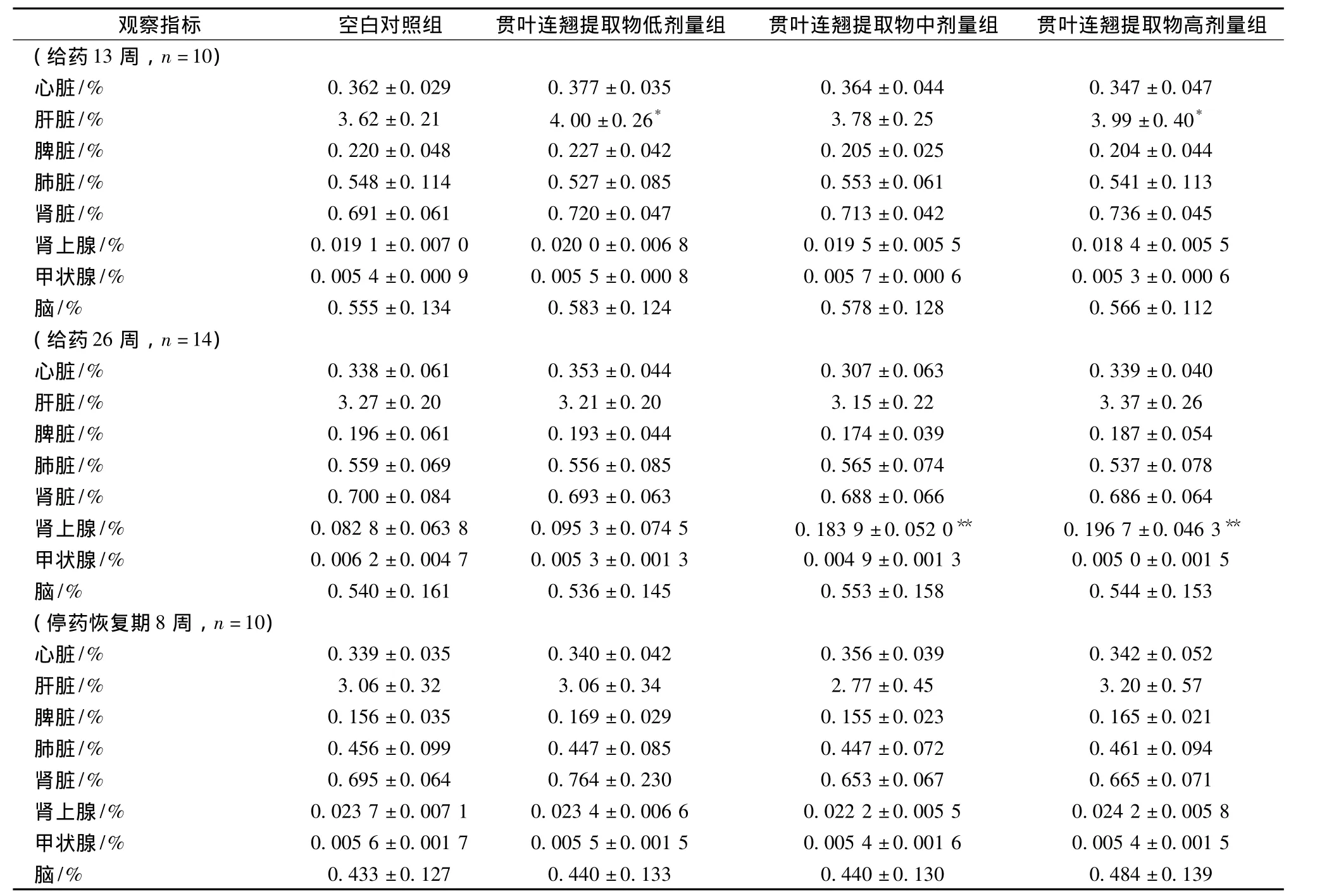
表3 贯叶连翘提取物对大鼠脏器系数的影响()Tab.3 Effect of Hypericum perforatum extracts on organ coefficients of rats()
注:与空白对照组比较,*P<0.05,**P<0.01
剂量组(给药13周,n=10)观察指标 空白对照组 贯叶连翘提取物低剂量组 贯叶连翘提取物中剂量组 贯叶连翘提取物高心脏/% 0.362±0.029 0.377±0.035 0.364±0.044 0.347±0.047肝脏/% 3.62±0.21 4.00±0.26* 3.78±0.25 3.99±0.40*脾脏/% 0.220±0.048 0.227±0.042 0.205±0.025 0.204±0.044肺脏/% 0.548±0.114 0.527±0.085 0.553±0.061 0.541±0.113肾脏/% 0.691±0.061 0.720±0.047 0.713±0.042 0.736±0.045肾上腺/% 0.0191±0.0070 0.0200±0.0068 0.0195±0.0055 0.0184±0.0055甲状腺/% 0.0054±0.0009 0.0055±0.0008 0.0057±0.0006 0.0053±0.0006脑/% 0.555±0.134 0.583±0.124 0.578±0.128 0.566±0.112(给药26周,n=14)心脏/% 0.338±0.061 0.353±0.044 0.307±0.063 0.339±0.040肝脏/% 3.27±0.20 3.21±0.20 3.15±0.22 3.37±0.26脾脏/% 0.196±0.061 0.193±0.044 0.174±0.039 0.187±0.054肺脏/% 0.559±0.069 0.556±0.085 0.565±0.074 0.537±0.078肾脏/% 0.700±0.084 0.693±0.063 0.688±0.066 0.686±0.064肾上腺/% 0.0828±0.0638 0.0953±0.0745 0.1839±0.0520** 0.1967±0.0463**甲状腺/% 0.0062±0.0047 0.0053±0.0013 0.0049±0.0013 0.0050±0.0015脑/% 0.540±0.161 0.536±0.145 0.553±0.158 0.544±0.153(停药恢复期8周,n=10)心脏/% 0.339±0.035 0.340±0.042 0.356±0.039 0.342±0.052肝脏/% 3.06±0.32 3.06±0.34 2.77±0.45 3.20±0.57脾脏/% 0.156±0.035 0.169±0.029 0.155±0.023 0.165±0.021肺脏/% 0.456±0.099 0.447±0.085 0.447±0.072 0.461±0.094肾脏/% 0.695±0.064 0.764±0.230 0.653±0.067 0.665±0.071肾上腺/% 0.0237±0.0071 0.0234±0.0066 0.0222±0.0055 0.0242±0.0058甲状腺/% 0.0056±0.0017 0.0055±0.0015 0.0054±0.0016 0.0054±0.0015脑/% 0.433±0.127 0.440±0.133 0.440±0.130 0.484±0.139
4 讨论
抑郁症作为一种严重的精神障碍,目前其发病率已跃居世界十大常见疾病的第四位,预期2020年可能会上升为第二大常见疾病[6],已成为突出的社会问题。在此背景下,贯叶连翘作为治疗抑郁症的全天然植物药受到了社会的广泛关注,其疗效显著、毒副作用少的鲜明特点已成为当前全球植物药研发热点品种之一。
贯叶连翘提取物是基于贯叶连翘植物中抗抑郁活性成分而提取富集的主要有效部位,其主要活性成分包括苯并双蒽酮类、黄酮类和间苯三酚类等化合物[7],且成分可控比例达50%以上。前期研究表明,贯叶连翘提取物可减少小鼠悬尾不动时间,减少大鼠强迫游泳不动时间,增强5-羟色胺酸甩头行为,加强阿朴吗啡降温强度,其作用机制与通过对脑内5-羟色胺、去甲肾上腺素和多巴胺等神经递质重摄取具有抑制作用有关[8]。本实验就其长期给药对大鼠肝肾等主要脏器的影响进行了研究。结果显示,贯叶连翘提取物连续灌胃13、26周对SD大鼠肝、肾组织和功能具有轻度的毒性作用,但停药后可随时间而逐步消失,其毒性程度与给药剂量和服用持续时间呈正相关。贯叶连翘提取物灌胃给药的安全剂量为0.3 g/kg,相当临床治疗抑郁症拟用剂量的40倍。
在贯叶连翘提取物中,黄酮类化合物占50%以上,其中包括槲皮素、金丝桃苷、芦丁、阿曼托黄素等成分[9]。黄酮类化合物属植物次生代谢产物,广泛分布于陆生维管束植物中[10],在蔬菜、水果、药用植物中普遍存在,其不仅是许多中草药的主要活性成分,还是多种膳食中的营养物质。但有文献报道,某些类黄酮存在着潜在的因过量摄入产生的毒副作用。如长期大剂量摄入儿茶酚,可使啮齿类动物出现肝脏损伤[5]。贯叶连翘提取物长期大剂量服用出现的轻度肝肾毒性是否与其含有50%以上比例的黄酮类化合物有关,有待作进一步的考证和研究。
[1]Yasuko S,Michael F C,Stephen C G,et al.Plant phenolic antioxidant and prooxidant activities:phenolics-induced oxidant damage mediated by metals in plant[J].Toxicology,2002,177(1):67-80.
[2]Mitsuyoshi M,Naoko S,Kotaro S,et al.Cytotoxicity of flavornoids toward cultured normal human cells[J].Bio Pharm Bull,2005,28(2):253.
[3]Decker E A.Phenolics:prooxidants or antioxidants[J].Nutrition,1997,55:396-407.
[4]Boots A W,Balk J M,Bast A,et al.The reversibility of the glutathionyl-quercetin adduct spreads oxidized quercetin-induced toxicity[J].Biochem Biophys Res Commu,2005,338(2):923-929.
[5]Galati G,O'Brien P J.Potential toxicity of flavonoids and other dietary phenolics:significance for their chemopreventive and anticancer properties[J].Free Radi Biol Med,2004,37(3):287-303.
[6]Nowak G,Szewczyk B,Wieronska J,et al.Antidepressant-like effects of acute and chronic treatment with zinc in forced swim test and olfactory bulbectomy model in rats[J].Brain Res Bull,2003,61(2):159-164.
[7]刘一兵.贯叶金丝桃研究进展Ⅰ-原植物、采收、制剂和化学成分[J].国外医药:植物药分册,1998,13(3):99-101.
[8]谢家骏,罗质璞,黄世杰,等.解郁舒心片抗抑郁活性的主要药效学及作用机制[J].中成药,2013,35(11):9-14.
[9]宋 英,宋 崎,周小初,等.解郁舒心片中黄酮类化合物的HPLC和 UV法测定[J].中国医药科学,2011,1(11):38-40.
[10]Martens S,Mithfer A.Flavones and flavone synthases[J].Phytochemistry,2005,66(20):2399-2407.
