siRNA干扰CLEC2B基因沉默对黑素细胞的影响
2013-11-01张峻岭柳君如徐士福程琳ZHOUYouwen
张峻岭 ,柳君如 ,徐士福 ,程琳 ,ZHOU Youwen
(1.天津市中医药研究院附属医院,天津300120;2.解放军第四零四医院,威海264200;3.浙江大学医学院附属儿童医院,杭州310003;4.河北省石家庄市妇幼保健院,石家庄050000;5.不列颠哥伦比亚大学,温哥华V5Z4E8)
多数学者认为白癜风是一种自身免疫相关性皮肤病,近年来发现基因的差异表达在免疫性皮肤病中起着非常重要的作用,国外学者Youwen Zhou教授首次发现白癜风皮损区CLEC2B(C-type lectin domain family 2,member B)mRNA表达高于非皮损区,并经RT-PCR方法确证。我们在以往的研究中应用实时荧光定量PCR方法,发现白癜风患者皮损区CLEC2B基因较正常人表达增加,并发现CLEC2B基因过表达的淋巴细胞培养上清液对黑素细胞的增殖和黑素合成有一定的抑制作用[1]。在此基础上我们进一步利用RNA干扰技术,使CLEC2B基因沉默,观察CLEC2B基因沉默后的淋巴细胞上清液对黑素细胞增殖活性的影响,从而进一步探索CLEC2B基因在白癜风发病中的作用。
1 材料与方法
1.1 主要试剂与材料 DMRIE-C脂质体及OPTI MEM购于美国Invitrogen公司,CLEC2B引物序列由不列颠哥伦比亚大学Youwen Zhou教授惠赠,CLEC2BsiRNA由上海吉玛制药技术有限公司设计合成,RPMI1640液态培养基购于美国Gibco公司,DMEM高糖液态培养基、TBD胎牛血清购于天津灏洋生物科技有限公司,TRIzol、TRANScript cDNA第一链合成试剂盒、SuperReal PreMix(SYBR Green I)均购于天根生化科技有限公司,MTT细胞增殖及细胞毒性检验试剂盒购于南京凯基生物科技有限公司,DMSO购于美国Sigma公司,人Jurkat淋巴瘤细胞株来自中国科学院血液病研究所,小鼠B16黑素瘤细胞株由中国科学院上海细胞研究所提供。
1.2 方法
1.2.1 细胞培养 细胞培养条件均为37℃,5%CO2进行培养,Jurkat淋巴瘤细胞用RPMI1640培养基,以密度为2×105/mL接种于25 cm2培养瓶;小鼠B16黑素瘤细胞以2~3×105/mL接种于25 cm2培养瓶,高糖DMEM培养基中进行培养,待细胞以对数生长期、密度近1×106/mL(融合度近80%)时进行实验。
1.2.2 siRNA转染 DMRIE-C脂质体转染3条CLEC2BsiRNA入Jurkat淋巴瘤细胞,采用反向转染法[2],转染体系为600μL,siRNA终浓度约80 nmol/L,siRNA:DMRIE-C 实际配比=3 μL∶2 μL。实验共设定CLEC2B沉默组、非沉默对照组(siRNA对照组,转染scrambledsiRNA,)及空白对照组(不作任何处理),转染具体步骤试剂盒说明操作。
1.2.3 CLEC2B基因沉默效率检测 转染后48 h,收集细胞,进行RNA提取、cDNA合成及实时荧光定量PCR方法检测CLEC2B基因沉默效率。具体步骤按照试剂盒说明操作。CLEC2B上游引物5'-CCCCTATGATTGGATTGGTT-3’,下游引物 5'-GGCATGTTGAGTGGAACAGT-3,产物大小 79bp;βactin上游引物5'-CCTGGAGAAACCTGCCAAGT-3',下游引物5'-TGGGAGTTGCTGTTGAAGTC-3',产物大小124 bp。应用RG-3000荧光定量PCR仪(澳大利亚Corbett Research Sydney公司)进行检测以选取沉默效率最高的CLEC2BsiRNA进行后续实验。
1.2.4 CLEC2B基因沉默后淋巴细胞增殖率检测及淋巴细胞上清液作用后黑素细胞增殖率检测 ①Jurkat淋巴瘤细胞增殖率检测,选择转染后48 h CLEC2B基因沉默率最高的转染组,采用MTT比色法。实验分组:空白对照组(未进行转染)、非沉默对照组(转染scrambled siRNA,该siRNA无基因干扰效应,是与目的基因序列无同源性的阴性对照siRNA序列,即siRNA对照组)、CLEC2B沉默组(转染最佳CLEC2BsiRNA),每组设3个复孔。选择基因沉默效率最高的CLEC2BsiRNA进行转染,转染后培养48 h,MTT法测细胞增殖率,具体步骤按说明书进行。酶标仪在570 nm波长处测各孔的光密度(A值)。②淋巴细胞上清液作用后黑素细胞增殖率检测,实验设CLEC2B沉默组(最佳沉默组上清液100 μL+10%血清 DMEM 培养基液 100 μL)、非沉默组(非沉默组上清液100 μL+10%血清DMEM培养基液 100 μL)、空白对照组(D-Hank’s液 100 μL+10%血清DMEM培养基液100 μL),每组设3个复孔,孵育48 h后MTT法检测黑素细胞增殖情况,酶标仪在550 nm波长检测各孔的光密度(A值)。
1.2.5 结果分析 基因表达相对变化采用2△△Ct法处理数据[3]。统计分析时用△Ct代表基因的相对定量,Ct值代表目标基因扩增产物达到设定阈值所经历的循环数。△Ct=目的基因Ct值-内参基因Ct值,△△Ct=待测样本△Ct-标准样本△Ct。
1.3 统计学处理 计量资料符合正态分布分别以均数±标准差()表示,两样本间均数的比较采用t检验;多个样本均数间的多重比较用方差分析,以P<0.05为差异有统计学意义。所有数据运用SPSS13.0进行统计,采用单因素方差分析及SNK法多重比较,进行多组间及两两组间比较及统计分析,两样本间比较采用t检验,显著性检验水准α=0.05。
2 结果
2.1 CLEC2B基因沉默效率检测 转染CLEC2BsiRNA后,各转染组淋巴细胞较非沉默对照组CLEC2BmRNA表达下降。3条siRNA序列对CLEC2B基因沉默效率不等,分别为C1组:23±3.3%,C2组:35±1.9%,C3组:14.8±2.5%。其中 C2组siRNA沉默效率最高,可达到35±1.9%(t=15.9,P<0.05)。上述结果显示RNA干扰实现了对淋巴细胞CLEC2B基因mRNA的表达抑制。
2.2 CLEC2B基因沉默后对淋巴细胞增殖影响CLEC2B基因沉默后淋巴细胞增殖率检测结果示:A值,CLEC2B 沉默组 0.36±0.04,非沉默组 0.35±0.03,空白对照组0.39±0.04,经单因素方差分析SNK法检验无明显统计学差异(F=1.95,P>0.05),提示CLEC2B基因一定程度下沉默对淋巴细胞增殖率的影响差异无统计学意义。
2.3 CLEC2B基因沉默后淋巴细胞上清液对黑素细胞增殖率的影响 采用MTT法检测淋巴细胞上清液对黑素细胞增殖的影响,结果见表1。3组间A值差异经单因素方差分析SNK法检验,差异有统计学意义(F=6.67,P<0.05),进一步进行2组间比较发现,CLEC2B沉默组与非沉默组/空白对照组比较,差异均有统计学意义(P<0.05)。提示:空白对照组,未添加淋巴细胞上清液,黑素细胞生长状态良好;非沉默组淋巴上清液对黑素细胞有较强抑制作用,其增殖率约为70%;CLEC2B基因沉默后淋巴细胞上清液虽仍然对黑素细胞有抑制作用,但其程度较未沉默组有所下降,黑素细胞增殖率约为87%。该结果提示,CLEC2B沉默后淋巴细胞上清液减轻了对黑素瘤细胞增殖的抑制,有利于黑素细胞存活。
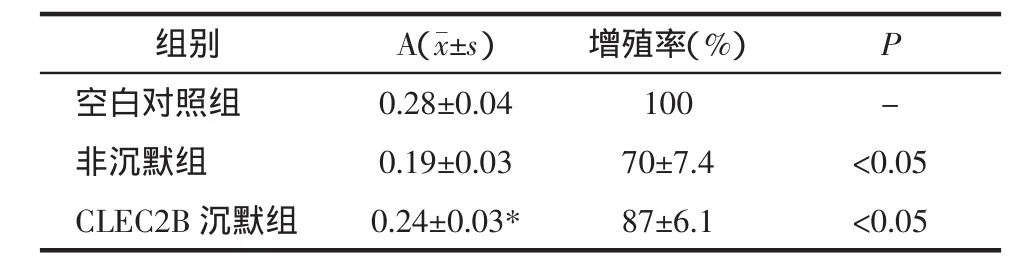
表1 CLEC2B基因沉默后淋巴细胞上清液对黑素细胞增殖的影响(n=3)
3 讨论
人类自然杀伤基因复合体(NKC)包括大量C型凝集素样受体,其表达于多种免疫细胞,包括自然杀伤细胞和骨髓细胞。在人体中,C型凝集素样受体分为CLEC-2家族,主要包括CLEC2A,AICL(CLEC2B),CD69(CLEC2C),和 LLT1(CLEC2D)。CLEC2B为CLEC-2家族的一个分型,是一个分子质量为33 kd的Ⅱ型跨膜糖蛋白,属于C型凝集素受体家族“Dectin-1集群”成员之一,其编码基因位于12号染色体12p13-p12 NK细胞基因复合体区。研究显示该基因可在NK细胞和单核细胞中表达[4-5]。并有研究报道AICL通过与NKp80结合,可对NK细胞及效应记忆T细胞(CD8+T)产生一定的激活作用[6]。也有研究显示在活化的淋巴细胞该基因转录表达增加,为淋巴细胞活化后早期转录表达的基因[7]。
已有研究表明,NK细胞与T细胞之间存在密切的免疫相关性,多种细胞因子参与彼此之间的调节,其共同终末效应为作用于黑素细胞,影响其存活及黑素合成功能。笔者曾研究显示CLEC2B过表达的淋巴细胞培养上清液抑制黑素细胞增殖,推测CLEC2B基因过表达可能参与白癜风的发病[1],本实验显示CLEC2B基因沉默后的淋巴细胞上清液作用于黑素细胞后,沉默组增殖率较未沉默组增加,推测该基因沉默后可能抑制了白癜风相关细胞因子表达,改善黑素细胞微环境,从而减轻了对黑素细胞增殖的抑制作用,有利于黑素细胞的生存,本实验结果进一步支持CLEC2B基因参与白癜风发病。其机制可能通过影响某些细胞因子转录表达,直接刺激T淋巴细胞活化和间接影响NK细胞的功能,最终导致黑素细胞减少而参与白癜风发病。
[1]张峻岭,徐士福,柳君如,等.CLEC2B基因过表达的Jurkat细胞培养上清液对黑素瘤细胞B16的影响[J].中国中西医结合皮肤性病学杂志,2012,11(6):348-350.
[2]杨萍,严金川,刘培晶.siRNA反向转染法提高原代悬浮细胞转染效率的应用[J].江苏大学学报(医学版),2010,20(3):267-269.
[3]Pfaffl MW.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Res,2001,29:e45.
[4]Holmskov U,Malhotra R,Sim RB,et al.Collectins:collagenous C-type lectins of the innate immune defense system[J].Immunol Today,1994,15:67-74.
[5] Ljunggren HG.Cancer immunosurveillance:NKG2D breaks cover[J].Immunity,2008,28:492-494.
[6]Kuttruff S,Koch S,Kelp A,et al.NKp80 defines and stimulates a reactive subset of CD8 T cells[J].Blood,2009,113:358-369.
[7] Eichler W,Ruschpler P,Wobus M,et al.Differentially induced expression of C-type lectins in activated lymphocytes[J].J Cell Biochem Suppl,2001,Suppl 36:201-208.
