非天然氨基酸修饰蛋白质研究进展
2013-10-28杜方川神应强陈灿玉王安明
杜方川,王 芬,神应强,陈灿玉,王安明
(1. 杭州师范大学生物医药与健康研究中心,浙江 杭州 311121;2. 杭州师范大学生命与环境科学学院, 浙江 杭州 310036;3. 杭州师范大学材料与化学化工学院, 浙江 杭州 310036)
非天然氨基酸修饰蛋白质研究进展
杜方川1,2,王 芬1,3,神应强1,2,陈灿玉1,王安明1
(1. 杭州师范大学生物医药与健康研究中心,浙江 杭州 311121;2. 杭州师范大学生命与环境科学学院, 浙江 杭州 310036;3. 杭州师范大学材料与化学化工学院, 浙江 杭州 310036)
蛋白质修饰是改善其物理化学和生物学特性的一种重要方法,目前已成为生物技术、生物催化和生物医学领域的研究热点.非天然氨基酸在蛋白质修饰中表现突出.介绍了非天然氨基酸种类及修饰方法,概述了其应用领域,以期为扩大利用此方法者提供参考.
生物正交反应;蛋白质修饰;非天然氨基酸;密码子扩展
蛋白质仅仅用20种天然氨基酸执行了一系列显著功能,仅有的20种天然氨基酸携有的功能基团数量有限,无法满足化学、生物科学研究和应用中对蛋白质结构和功能的需求[1].目前,通过化学修饰、基因定点突变和计算机辅助蛋白质设计,虽然对蛋白质的结构改造赋予了天然蛋白质新的功能[2],但这些方法都依赖于20种天然氨基酸本身[3];其用于修饰改造的功能基团仅有巯基、羟基、羧基、氨基等几种有限基团,功能化方式十分有限[4].与此相反,可人为赋予多样性功能基团的非天然氨基酸(Unnatural Amino Acids,UAAs)在蛋白质修饰中表现突出[5],这些UAAs含有酮基、醛基、叠氮、炔基、烯基、酰胺基、硝基、磷酸根、磺酸根等多样性功能基团,可进行多种修饰反应,如:点击化学、光化学、糖基化、荧光显色等反应[6].通过UAAs对蛋白质进行修饰给其结构和功能的理论研究与应用带来了新的契机.本文回顾了UAAs修饰蛋白质研究的最新进展,并对密码子扩展法进行详细介绍.
1 UAA种类
一系列UAAs已经被用在细菌、酵母和哺乳动物细胞中进行蛋白质修饰,其精确性和效率非常高;它们大多都是20种天然氨基酸的衍生物,现今报道的UAA衍生物有苯丙氨酸衍生物、酪氨酸衍生物、谷氨酰胺衍生物、丙氨酸衍生物、半胱氨酸衍生物、丝氨酸衍生物、赖氨酸衍生物等[7].部分UAAs结构如图1所示.
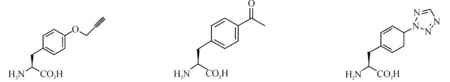


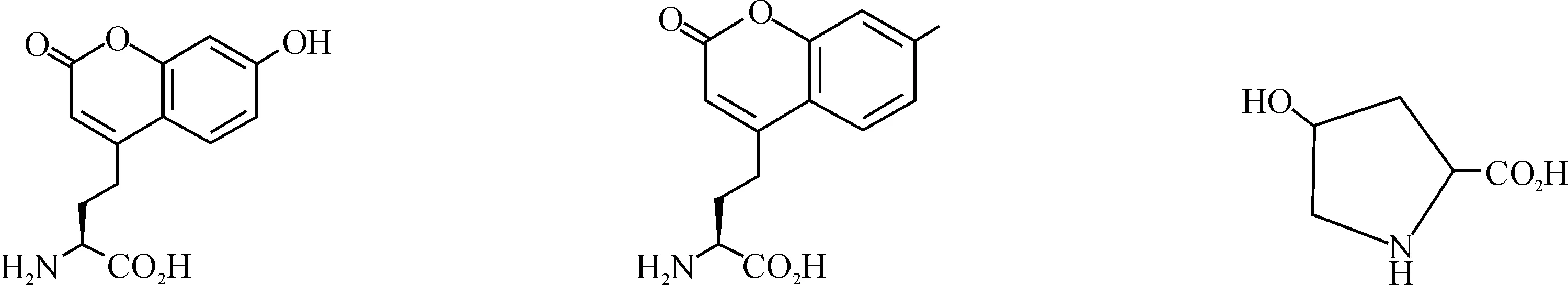
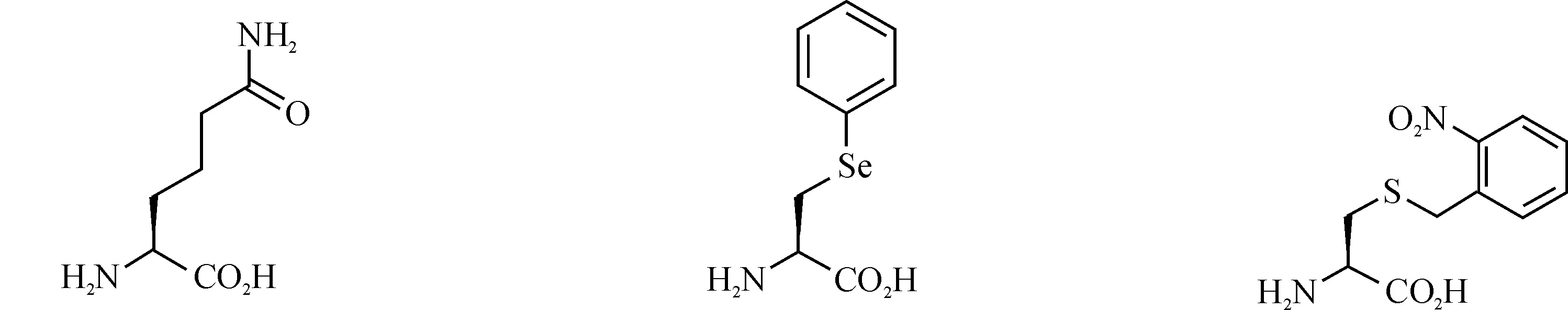
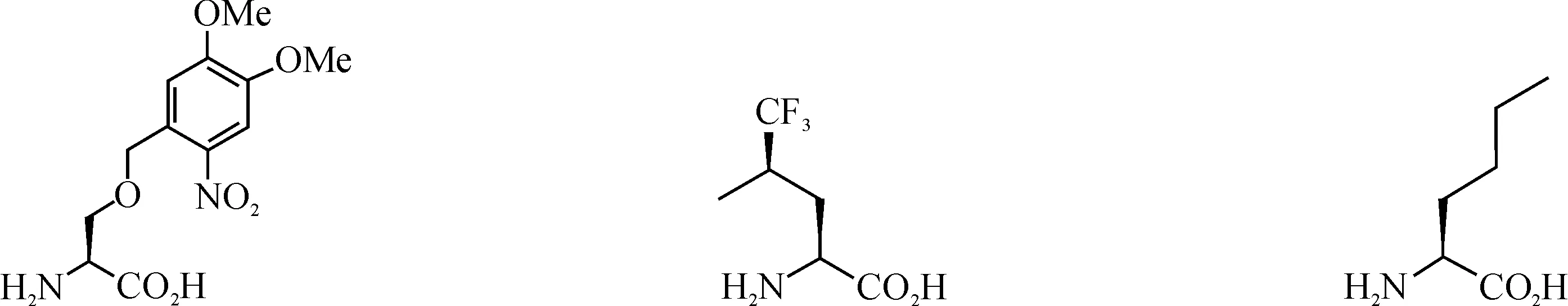
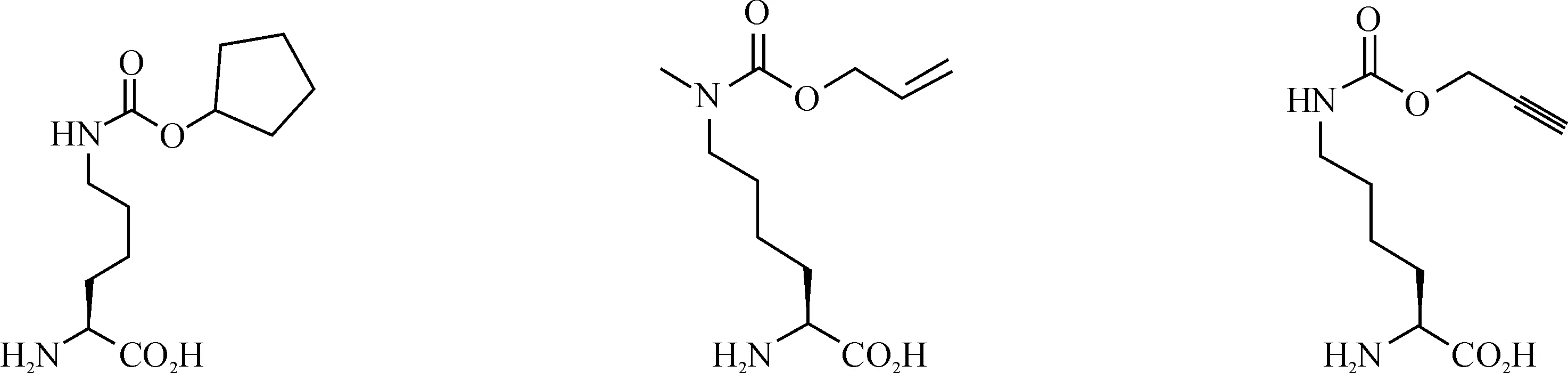

图1 非天然氨基酸结构Fig. 1 The structure of unnatural amino acids
2 UAA修饰方法与过程
2.1 化学合成法
固相肽合成方法和半合成方法相结合能合成出含UAAs的大片段蛋白质[8].例如,在化学连接中,一个C端含α-硫脂的多肽将和一个N端含半胱氨酸的多肽反应,在经历一个酰基重排后,硫脂键形成一个肽键将这两个片段连接在一起[9].固相肽合成和连接技术已经用于修饰蛋白质骨架、红细胞生成素同系物、荧光探针、信号蛋白、离子通道、组蛋白等.然而这项技术的应用受所需要保护基团的化学性质、连接位点、蛋白质折叠等限制[1].
2.2 体外生物合成法
体外生物合成方法已经合成了含UAA的蛋白质.在这个技术中,缩短了的tRNAs被酶法连接到化学氨酰化的核苷酸上,这些目的tRNA从连接的天然氨基酸上去耦掉,同时与非天然氨基酸结合;随后细胞翻译系统在相应的空白密码子或者编码密码子下,使用这些带有非天然氨基酸的氨酰化的tRNAs合成蛋白质,但含有非天然氨基酸的氨酰化tRNA加合物稳定性很差[10].
2.3 显微注射法
在体内,通过显微注射技术对蛋白质进行位点特异性修饰来自于体外生物合成方法的拓展.如非洲爪蟾蜍卵母细胞被显微注射进2种RNA:一种是编码蛋白质的mRNA,其目标位点含有UAG终止密码子;一种是合成的氨酰化较正tRNA(suppressor tRNA),它能装载相应的UAA.在体内,通过UAG终止密码子对蛋白质进行位点特异性修饰,其中UAAs有酪氨酸同系物、α-羟基氨基酸等.但它继承了体外生物合成方法的缺点,即校正tRNA必须在体外化学氨酰化带上UAA,氨酰化的tRNA不能被重复利用,只能应用于能进行显微注射的细胞[11].
2.4 营养缺陷型法
50年以前,研究者发现许多天然氨基酸的同系物能抑制细菌的生长,分析发现在这些氨基酸同系物存在下合成的蛋白质,其天然氨基酸已被同系物替换[10],这是因为氨酰-tRNA合成酶(aminoacyl-tRNA synthetase, aaRS)不能明显地把天然氨基酸和其同系物严格区分开来,例如,正亮氨酸(norleucine)能被甲硫氨酰-tRNA合成酶识别,氟苯丙氨酸(p-fluorophenylalanine)能被苯丙氨酰-tRNA合成酶识别[12].Merkel等[13]同时用4(S)-氟脯氨酸(4(S)-fluoroproline, (4(S)-F)Pro),4-氟苯丙氨酸(4-fluorophenylalanine, (4-F)Phe)和6-氟色氨酸(6-fluorotryptophan, (6-F)Trp)3种UAAs对脂肪酶进行修饰,其脂肪酶的结构和活性均未被破坏.DNA聚合酶是一种高的动力学酶,Holzberger等[14]用大肠杆菌营养缺陷型菌株对DNA聚合酶中32个脯氨酸替换成4(R)-氟脯氨酸(4(R)-fluoroproline, (4(R)-F)Pro),完成了(4(R)-F)Pro对DNA聚合酶的修饰,而DNA聚合酶在其保真度、活性和敏感方面均未发生变化.但运用营养缺陷性菌株来进行UAAs对蛋白质的修饰,没有位点特异性、细胞不能持续生长,且UAAs仅是天然氨基酸的同系物[15].
2.5 翻译后修饰法
蛋白质翻译后修饰在生命体中具有十分重要的作用,它使蛋白质的结构更为复杂,功能更为完善,调节更为精细,作用更为专一.常见的蛋白质翻译后修饰过程有泛素化、磷酸化、糖基化、脂基化、甲基化和乙酰化等.
Carrico等[16]通过在麦芽糖结合蛋白、人类生长激素和分枝杆菌磺基转移酶蛋白中,引入一个含6个氨基酸的共有序列(LCTPSR),它能被甲酰甘氨酸生成酶识别并修饰,从而生成醛基基团,新生成的醛基基团能进一步引入生物物理探针和抗原表位标签到蛋白质中.Ohno等[17]用叠氮基酪氨酸(3-azidotyrosine)对钙调蛋白进行修饰,再用三芳膦同系物对其进行选择性的生物酰化修饰,从而开创了一种新的蛋白质位点选择性翻译后修饰方法.
3 基于密码子扩展修饰蛋白质


1.宿主细胞;2.校正基因载体;3.校正MjTyrRS基因载体;4.目标基因载体;5.特异非天然氨基酸;6.含非天然氨基酸蛋白质.
3.1 校正tRNA/aaRS对
在过去的20年中,正交tRNA/aaRS对(Orthogonal tRNA/aaRS pair)已在大肠杆菌、酿酒酵母和哺乳动物中相继报道,其种类已超过20种(表1).
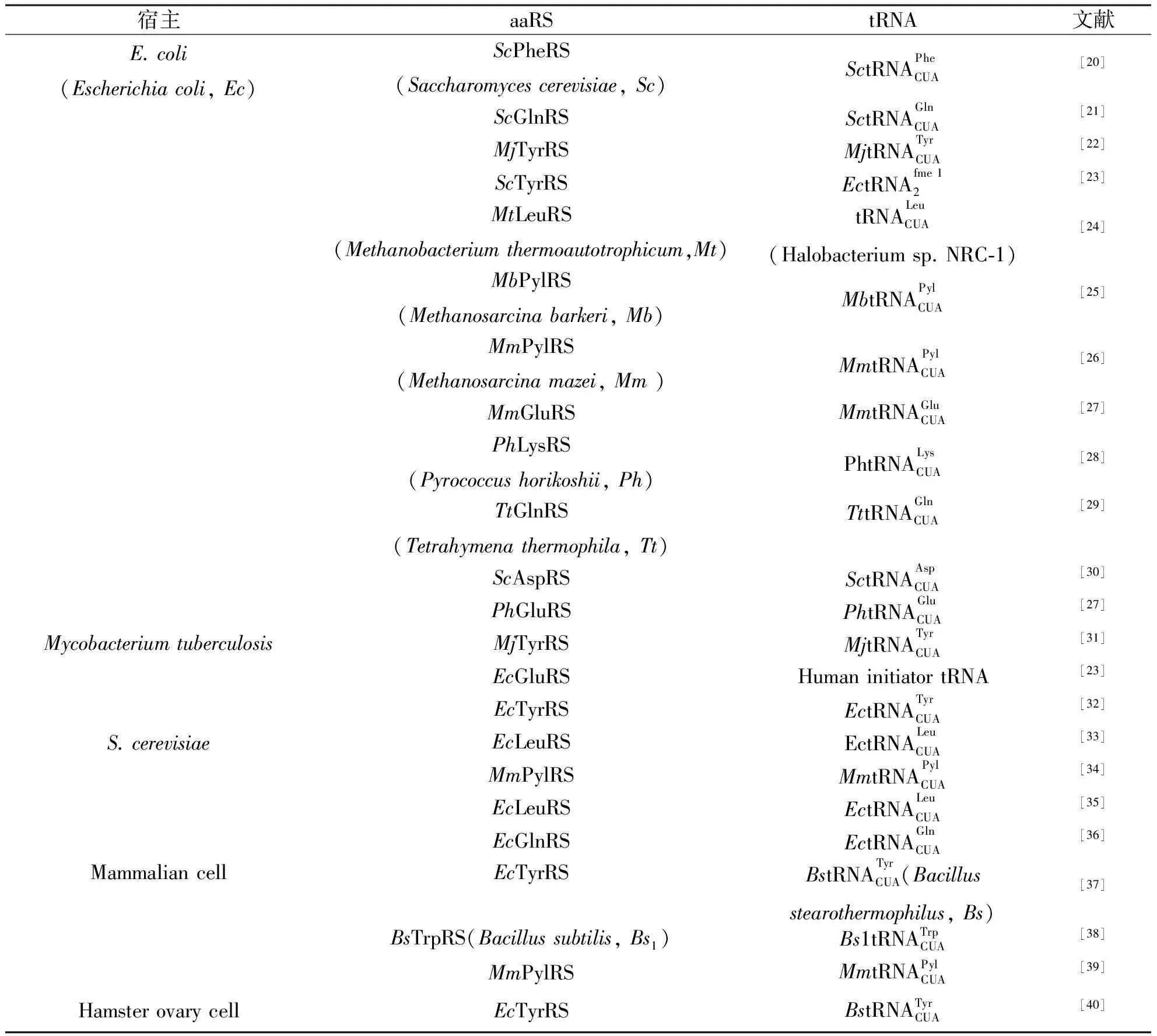
表1 正交tRNA/aaRS对
3.1.1 校正tRNA

图3 校正tRNA筛选Fig. 3 Screening suppressor tRNA
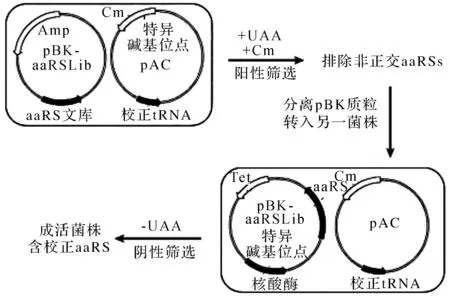
图4 校正aaRS筛选Fig. 4 Screening suppressor aaRS
3.1.2 校正aaRS
为筛选出识别特异非天然氨基酸的校正aaRS(suppressor aaRS),对正交aaRS (orthogon-Al, aaRS)的活性中心残基进行随机突变产生一个aaRSs突变体文库(>109个),再通过阳性和阴性组合筛选出仅能识别某一非天然氨基酸的正交aaRS[43].阳性筛选——在非天然氨基酸存在下,正交aaRSs能氨酰化非天然氨基酸或天然氨基酸装载到校正tRNA上,氨酰化tRNA通读含特异碱基位点的氯霉素乙酰转移酶(chloramphenicol acetyl transferase, CAT)基因,使宿主细胞存活在氯霉素(chloramphenicol, Cm)下,从而排除非正交aaRSs;阴性筛选——非校正aaRSs氨酰化天然氨基酸装载到校正tRNA上,含特异碱基位点的核酸酶基因被翻译,导致宿主细胞死亡,最终筛选出校正aaRS(图4).
如O-甲基酪氨酸(O-Methyl-L-tyrosine)校正MjTyrRS筛选,通过MjTyrRS的X射线晶体结构分析,其识别酪氨酸的活性位点残基为32位酪氨酸、107位谷氨酸、 158位天冬氨酸、 159位异亮氨酸和162位亮氨酸[44];通过对MjTyrRS识别氨基酸的活性位点进行随机突变产生aaRSs文库,再通过上述阳性和阴性筛选,产生了识别O-甲基酪氨酸的校正MjTyrRS,其识别位点为32位谷氨酸、107位苏氨酸、158位丙氨酸、159位异亮氨酸和 162位脯氨酸[22].
由于识别非天然氨基酸的aaRS筛选要产生一个>109的突变体酶库,在通过3轮的阳性和阴性筛选,最后筛选出校正aaRS,其过程极其繁琐和耗时.目前Armen等[45]通过基于分子对接的动力学和自由能计算,产生了一个能识别O-甲基酪氨酸的校正aaRS.
3.2 密码子
3.2.1 三联体密码子
在蛋白质翻译中,UAG终止密码子指导蛋白质合成的终止,但大肠杆菌和酿酒酵母很少用其做终止密码子[10].基于这一现象,将校正tRNA的反义密码子突变为CUA,再利用校正tRNA/aaRS对通读UAG密码子,完成UAA对蛋白质的修饰[19].
3.2.2 四联体密码子
为了减少生活污水悬浮杂质进入处理系统,避免水泵及管线堵塞,同时使中水系统运行处理流量平稳,对沉淀池的出水口及厌氧池的转水进行了改造[4-5]。

3.2.3 五联体密码子

3.3 掺入非天然氨基酸的数目
3.3.1 单个UAA
利用上述方法进行UAA对蛋白质的修饰是十分方便的,且已报道的UAA多达70多种,如对硝基苯丙氨酸[31]、O-甲基酪氨酸[47]、diazirine-赖氨酸[48]等.
3.3.2 两个UAA

3.3.3 多个UAA
Young等[50]发现了一个对氰基苯丙氨酸校正aaRS(p-cyanophenylalanine suppressor aaRS),它有高的底物通透性,在相同条件下可以结合18种UAAs,包括三氟醚酮(trifluoroketone-)、炔基(alkynyl-)和卤素(halogen-)替代氨基酸.这给校正aaRSs的筛选提供了一条新的途径,即筛选出识别某一系列的UAAs,而不是单个的UAA.
4 非天然氨基酸修饰蛋白质的应用现状和前景
4.1 生物催化
4.1.1 提高酶催化活性

4.1.2 增强酶热稳定性
特氟龙能使阻燃和防火氟化高分子材料表面固化,受此启发,纽约大学金·蒙克莱尔研究小组开创了一种能增强蛋白质界面的工艺过程.借助营养缺陷性菌株和在培养基中加入对氟苯丙氨酸,制备了对氟苯丙氨酸磷酸酯酶[52],性能测试显示,这种酶蛋白具有类似于特氟龙的耐热性能,在60 ℃的高温下仍可保持结构稳定,同时活性和功能没有丝毫减弱.在同样温度下,天然蛋白质分子中的氢键会断裂,导致结构改变并发生蛋白质变性.通过此氟化氨基酸对蛋白质的修饰,给蛋白质热稳定研究开辟了新的视野.
4.2 蛋白质结构和功能探针
光诱导化学反应存在自然界中,它能调节许多细胞和生物功能,Wang等[53]用光反应非天然氨基酸对-(2-四唑)苯丙氨酸(p-(2-tetrazole)phenylalanine, (p-Tpa))对肌红蛋白进行修饰,这给用光来调节蛋白质功能提供了可能.Lampe等[54]用[13C]对甲氧基苯丙氨酸([13C]p-methoxyphenylalanine)对P450进行修饰,修饰后P450和其它原子结合,可以用来阐明P450在配体位点的构象改变,同时也可以解释哺乳动物P450的复杂动力学现象.
4.3 药物蛋白

4.4 蛋白质交联反应
蛋白质交联在疫苗开发、药物传递、功能型水合胶方面发挥着重要作用.这些交联虽然发生在自然界中,但实验室很难应用这个方法.Ayyadurai等[58]通过3,4-二羟-L-苯丙氨酸(3,4-dihydroxy-L-phenylalanine)对GFP蛋白进行修饰,从而实现了蛋白质与多聚糖的生物交联,这给蛋白质交联和合成生物学的发展带来了新的希望.Bundy等[59]用对炔丙基氧苯丙氨酸(p-propargyloxyphenylalanine, (pPa))完成了二氢叶酸还原酶和超折叠绿色荧光蛋白的修饰,由于pPa含有酮基,它能在一价铜离子介导下使炔基与叠氮基发生交联反应,同时pPa对UV不敏感,这使异源蛋白质间的交联也成为了可能.
5 展 望
遗传编码UAAs能整合新的化学性质到蛋白质中,比其它蛋白质修饰方法更有优势,因为利用遗传工程方法可以在肽链中选择任意位置掺入非天然氨基酸,避免了普通化学修饰中修饰位点选择的被动性;同时修饰中采用的非天然氨基酸与天然氨基酸结构类似,最大限度地保证了酶蛋白的结构稳定和活性保留;20多种正交tRNA/ aaRS对,使70多种UAAs在无义密码子和四联体密码子下完成了对蛋白质的修饰,其宿主涵盖了大肠杆菌、酵母、哺乳动物细胞.为了进一步满足蛋白质新化学性质需要,还需进行如下探索:1)开发新的tRNA/aaRS对用于识别新的UAA;2)创造新的独特密码子允许蛋白质含多个UAAs;3)进一步优化转移机制,使UAA修饰的蛋白更有效地表达.
[1] Liu C C, Schultz P G. Adding new chemistries to the genetic code[J]. Annu Rev Biochem,2010,79(1):413-444.
[2] Brustad E M, Arnold F H. Optimizing non-natural protein function with directed evolution[J]. Curr Opin Chem Biol,2010,15(2):201-210.
[3] Sletten E M, Bertozzi C R. Bioorthogonal chemistry: fishing for selectivity in a sea of functionality[J]. Angew Chem Int Edit,2009,48(38):6974-6998.
[4] Baslé E, Joubert N, Pucheault M. Protein chemical modification on endogenous amino acids[J]. Chem Biol,2010,17(3):213-227.
[5] Voloshchuk N, Montclare J K. Incorporation of unnatural amino acids for synthetic biology[J]. MolBioSyst.,2009,6(1):65-80.
[6] 刘亚光,方正之,姚文兵.遗传密码扩充技术在蛋白质研究中的应用进展[J].中国生化药物杂志,2011,32(4):328-331.
[7] Young T S, Schultz P G. Beyond the canonical 20 amino acids: expanding the genetic lexicon[J]. J Biol Chem,2010,285(15):11039-11044.
[8] Wang Lei, Xie Jianming, Schultz P G. Expanding the genetic code[J]. Annu Rev Biophys Biomol Struct,2006,35(10):225-249.
[9] 李劼,王杰,陈鹏.基于非天然氨基酸的蛋白质生物正交标记[J].化学学报,2012,70(13):1439-1445.
[10] Wang Lei, Schultz P G. Expanding the genetic code[J]. Angew Chem Int Edit,2005,44(1):34-66.
[11] Hendrickson T L, Crécy-Lagard V D, Schimmel P. Incorporation of nonnatural amino acids into proteins[J]. Annu Rev Biochem,2004,73(1):147-176.
[12] Montclare J K, Son S, Clark G A,etal. Biosynthesis and stability of coiled coil peptides containing (2S, 4R) 5, 5, 5 trifluoroleucine and (2S, 4S) 5, 5, 5 trifluoroleucine[J]. ChemBioChem, 2009, 10(1): 84-86.
[13] Merkel L, Schauer M, Antranikian G,etal. Parallel Incorporation of different fluorinated amino acids: on the way to “teflon” proteins[J]. ChemBioChem, 2010, 11(11): 1505-1507.
[14] Holzberger B, Marx A. Replacing 32 proline residues by a noncanonical amino acid results in a highly active DNA polymerase[J]. J Am Chem Soc, 2010, 132(44): 15708-15713.
[15] de Graaf A J, Kooijman M, Hennink W E,etal. Nonnatural amino acids for site-specific protein conjugation[J]. Bioconjugate Chem, 2009, 20(7): 1281-1295.
[16] Carrico I S, Carlson B L, Bertozzi C R. Introducing genetically encoded aldehydes into proteins[J]. Nat Chem Biol, 2007, 3(6): 321-322.
[17] Ohno S, Matsui M, Yokogawa T,etal. Site-selective post-translational modification of proteins using an unnatural amino acid, 3-azidotyrosine[J]. J Biochem, 2007, 141(3): 335-343.
[18] Noren C J, Anthony-Cahill S J, Griffith M C,etal. A general method for site-specific incorporation of unnatural amino acids into proteins[J]. Science, 1989, 244(4901): 182-188.
[19] Wang Lei, Schultz P G. Expanding the genetic code[J]. Chem Commun, 2002 (1): 1-11.
[20] Furter R. Expansion of the genetic code: site-directed p-fluoro-phenylalanine incorporation in Escherichia coli[J]. Protein Sci, 1998, 7(2): 419-426.
[21] Liu D R, Schultz P G. Progress toward the evolution of an organism with an expanded genetic code[J]. Proc Natl Acad Sci USA, 1999, 96(9): 4780-4785.
[22] Wang Lei, Brock A, Herberich B,etal. Expanding the genetic code of Escherichia coli[J]. Science, 2001, 292(5516): 498-500.
[23] Kowal A K, K hrer C, RajBhandary U L. Twenty-first aminoacyl-tRNA synthetase¨Csuppressor tRNA pairs for possible use in site-specific incorporation of amino acid analogues into proteins in eukaryotes and in eubacteria[J]. Proc Natl Acad Sci USA, 2001, 98(5): 2268-2273.
[24] Anderson J C, Schultz P G. Adaptation of an orthogonal archaeal leucyl-tRNA and synthetase pair for four-base, amber, and opal suppression[J]. Biochemistry, 2003, 42(32): 9598-9608.
[25] Neumann H, Peak-Chew S Y, Chin J W. Genetically encoding N(epsilon)-acetyllysine in recombinant proteins[J]. Nat Chem Biol, 2008, 4(4): 232-234.
[26] Wang Y S, Russell W K, Wang Zhiyong,etal. The de novo engineering of pyrrolysyl-tRNA synthetase for genetic incorporation of l-phenylalanine and its derivatives[J]. Mol BioSyst, 2011, 7(3): 714-717.
[27] Santoro S W, Anderson J C, Lakshman V,etal. An archaebacteria-derived glutamyl-tRNA synthetase and tRNA pair for unnatural amino acid mutagenesis of proteins in Escherichia coli[J]. Nucleic Acids Res, 2003, 31(23): 6700-6709.
[28] Anderson J C, Wu N, Santoro S W,etal. An expanded genetic code with a functional quadruplet codon[J]. Proc Natl Acad Sci USA, 2004, 101(20): 7566-7571.
[29] Beene D L, Price K L, Lester H A,etal. Tyrosine residues that control binding and gating in the 5-hydroxytryptamine3 receptor revealed by unnatural amino acid mutagenesis[J]. J Neurosci, 2004, 24(41): 9097-9104.
[30] Pastrnak M, Magliery T J, Schultz P G. A new orthogonal suppressor tRNA/aminoacyl-tRNA synthetase pair for evolving an organism with an expanded genetic code[J]. Helv Chim Acta, 2000, 83(9): 2277-2286.
[31] Wang Feng, Robbins S, Guo Jiantao,etal. Genetic incorporation of unnatural amino acids into proteins in Mycobacterium tuberculosis[J]. PLoS ONE, 2010, 5(2): e9354.
[32] Chin J W, Cropp T A, Chu S,etal. Progress toward an expanded eukaryotic genetic code[J]. Chem Biol, 2003, 10(6): 511-519.
[33] Wu Ning, Deiters A, Cropp T A,etal. A genetically encoded photocaged amino acid[J]. J Am Chem Soc, 2004, 126(44): 14306-14307.
[34] Hancock S M, Uprety R, Deiters A,etal. Expanding the genetic code of yeast for incorporation of diverse unnatural amino acids via a pyrrolysyl-tRNA synthetase/tRNA pair[J]. J Am Chem Soc, 2010, 132(42): 14819-14824.
[35] Wang Wenyuan, Takimoto J K, Louie G V,etal. Genetically encoding unnatural amino acids for cellular and neuronal studies[J]. Nat neurosci, 2007, 10(8): 1063-1072.
[36] Drabkin H J, Park H J, RajBhandary U L. Amber suppression in mammalian cells dependent upon expression of an Escherichia coli aminoacyl-tRNA synthetase gene[J]. Mol Cell Biol, 1996, 16(3): 907-913.
[37] Sakamoto K, Hayashi A, Sakamoto A,etal. Site-specific incorporation of an unnatural amino acid into proteins in mammalian cells[J]. Nucleic Acids Res, 2002, 30(21): 4692-4699.
[38] Zhang Ziwen, Alfonta L, Tian Feng,etal. Selective incorporation of 5-hydroxytryptophan into proteins in mammalian cells[J]. Proc Natl Acad Sci USA, 2004, 101(24): 8882-8887.
[39] Chen P R, Groff D, Guo Jiantao,etal. A facile system for encoding unnatural amino acids in mammalian cells[J]. Angew Chem Int Edit, 2009, 48(22): 4052-4055.
[40] Hino N, Okazaki Y, Kobayashi T,etal. Protein photo-cross-linking in mammalian cells by site-specific incorporation of a photoreactive amino acid[J]. Nat methods 2005, 2(3): 201-206.
[41] 张春秋, 罗全, 刘俊秋, 等. 蛋白质功能化新策略: 嵌入非天然氨基酸[J]. 化学进展, 2012, 24(4): 576-588.
[42] Wang Lei, Schultz P G. A general approach for the generation of orthogonal tRNAs[J]. Chem Biol, 2001, 8(9): 883-890.
[43] Fang Zhengzhi, Liu Yaguang, Liu Jingxian,etal. Designing and Engineering of a Site-specific Incorporation of a Keto Group in Uricase[J]. Chem Biol Drug Des, 2011, 78(3): 353-360.
[44] Zhang Yan, Wang Lei, Schultz P G,etal. Crystal structures of apo wild-type M. jannaschii tyrosyl-tRNA synthetase (TyrRS) and an engineered TyrRS specific for O-methyl-L-tyrosine[J]. Protein Sci, 2005, 14(5): 1340-1349.
[45] Armen R S, Schiller S M, Brooks III C L. Steric and thermodynamic limits of design for the incorporation of large unnatural amino acids in aminoacyl tRNA synthetase enzymes[J]. Proteins, 2010, 78(8): 1926-1938.
[46] Hohsaka T, Ashizuka Y, Murakami H,etal. Five-base codons for incorporation of nonnatural amino acids into proteins[J]. Nucleic Acids Res, 2001, 29(17): 3646-3651.
[47] Kuhn S M, Rubini M, Fuhrmann M,etal. Engineering of an orthogonal aminoacyl-tRNA synthetase for efficient incorporation of the non-natural amino acid O-methyl-L-tyrosine using fluorescence-based bacterial cell sorting[J]. J Mol Biol, 2010, 404(1): 70-87.
[48] Chou C, Uprety R, Davis L,etal. Genetically encoding an aliphatic diazirine for protein photocrosslinking[J]. Chem Sci, 2011, 2(3): 480-483.
[49] Neumann H, Wang K, Davis L,etal. Encoding multiple unnatural amino acids via evolution of a quadruplet-decoding ribosome[J]. Nature, 2010, 464(7287): 441-444.
[50] Young D D, Young T S, Jahnz M,etal. An Evolved aminoacyl-tRNA synthetase with atypical polysubstrate specificity[J]. Biochemistry, 2011, 50(11): 1894-1900.
[51] Ugwumba I N, Ozawa K, Xu Z Q,etal. Improving a natural enzyme activity through incorporation of unnatural amino acids[J]. J Am Chem Soc, 2011, 133(2): 326-333.
[52] Baker P J, Montclare J K. Enhanced refoldability and thermoactivity of fluorinated phosphotriesterase[J]. ChemBioChem, 2011, 12(12): 1845-1848.
[53] Groff D, Wang F, Jockusch S,etal. A new strategy to photoactivate green fluorescent protein[J]. Angew Chem Int Edit, 2010, 49(42): 7677-7679.
[54] Lampe J N, Brandman R, Sivaramakrishnan S,etal. Two-dimensional NMR and all-atom molecular dynamics of cytochrome P450 CYP119 reveal hidden conformational substates[J]. J Biol Chem, 2010, 285(13): 9594-9603.
[55] 姚文兵, 方正之, 才蕾, 等. 一种定点引入非天然氨基酸的突变尿酸氧化酶及其制备方法:中国,101265467 [P].2008-09-17.
[56] Grünewald J, Hunt G S, Dong L,etal. Mechanistic studies of the immunochemical termination of self-tolerance with unnatural amino acids[J]. Proc Natl Acad Sci USA, 2009, 106(11): 4337-4342.
[57] Hutchins B M, Kazane S A, Staflin K,etal. Site-specific coupling and sterically controlled formation of multimeric antibody Fab fragments using unnatural amino acids[J]. J Mol Biol, 2011, 406(4): 595-603.
[58] Ayyadurai N, Prabhu N S, Deepankumar K,etal. Bioconjugation of L-3, 4-Dihydroxyphenylalanine Containing Protein with a Polysaccharide[J]. Bioconjugate Chem, 2011, 22 (4): 551-555.
[59] Bundy B C, Swartz J R. Site-specific incorporation of p-propargyloxyphenylalanine in a cell-free environment for direct protein- protein click conjugation[J]. Bioconjugate Chem, 2010, 21(2): 255-263.
OntheModificationofProteinsbyUnnaturalAminoAcids
DU Fangchuan1,2, WANG Feng1,3, SHENG Yingqiang1,2, CHEN Canyu1, WANG Anming1
(1.Research Center of Biomedicine and Health, Hangzhou Normal University, Hangzhou 311121, China;(2.College of Biological and Environmental Sciences, Hangzhou Normal University, Hangzhou 310036, China;(3.College of Material, Chemistry and Chemical Engineering, Hangzhou Normal University, Hangzhou 310036, China)
Protein modification is an important method for improving the physicochemical and biological characteristics of protein, which has become a hotspot of bio-technology and bio-catalytic and biomedical field. The unnatural amino acids have an outstanding performance in the protein modification. This paper introduced the type of unnatural amino acid and modification methods, and summarized its application fields to provide references for espending the use of this method.
bioorthogonal reactions; protein modification; unnatural amino acid; codon extension
2013-01-10
国家自然科学基金项目(20906016);浙江省自然科学基金项目 (LY13B060008).;博士后特别资助项目(2013T60606).
王安明(1975—),男,副研究员,博士, 主要从事生物化工研究.E-mail: waming@hznu.edu.cn
10.3969/j.issn.1674-232X.2013.05.011
O629.7;Q51
A
1674-232X(2013)05-0437-09
