超滤膜为分隔膜的双室微生物燃料电池的产电特性
2013-10-27于丰玮郑雅文张晓君廖跃仙
于丰玮 ,王 捷 ,2,郑雅文 ,张晓君 ,廖跃仙
(1.天津工业大学环境与化学工程学院,天津 300387;2.天津工业大学中空纤维膜材料与膜过程省部共建国家重点实验室培育基地,天津 300387)
微生物燃料电池(microbial fuel cell,MFC)是利用微生物作为催化剂将有机物中的化学能直接转化为电能,不但能获得清洁电能,而且可以净化废水,降低污染,是一种全新的废水处理技术,日益受到学术界的关注[1-5].目前关于MFC的研究主要集中在提高功率密度、降低装置成本、提升处理效果以及扩展MFC功能等方面.其中,关于MFC分隔材料的研究与提高产电功率和降低装置成本密切相关.传统双极室MFC由阳极室和阴极室构成,中间通常由质子交换膜(proton exchange membrane,PEM)隔开,膜的主要作用是隔离两级室的溶液,并使电荷以离子形式传递,但由于质子膜价格偏高因而限制了其在MFC中的应用[6-12].超滤(ultrafiltration,UF)膜具有微孔,在一定压力下水流可透过膜片,属低压膜的一种,而在膜两侧相对的静水压下,水几乎不会从UF膜透过.因此,从理论上讲,UF也可用于MFC,且成本较低.Kim等[13]在双室MFC中测试了 3 种截留分子质量(MWCO=0.5、1、3 ku)超滤膜的产电效果,发现截留量为0.5 ku的膜内阻过高,功率密度较低,仅为5 mW/m2,而1 ku和3 ku功率密度略低于PEM膜,在33~38 mW/m2之间.基于上述研究成果,本文将4种廉价超滤膜(MWCO=4、10、30、100 ku)作为分隔材料,进一步考察不同截留分子质量和材料的UF在MFC中的使用效果,并分析膜材料、内阻等参数与产电性能的关系,以寻找一种高效廉价的MFC隔膜材料,降低MFC设备的运行成本.
1 实验部分
1.1 实验材料与仪器
所用原材料包括:KH2PO4,分析纯,天津市福晨化学试剂厂产品;K2HPO4,分析纯,天津市赢达稀贵化学试剂厂产品;NaCl,分析纯,天津市化学试剂三厂产品;NH4Cl,分析纯,天津市风船化学试剂科技有限公司产品;MgCl2·6H2O,分析纯,天津市天大化工实验厂产品;CaCl2,分析纯,天津大学科威公司产品;炭毡,4 cm×4 cm×0.5 cm,北京凤翔科技有限公司产品.
实验所用分隔膜包括:质子交换膜(M0),Nafion 117型,美国杜邦公司产品;聚醚砜(PES)超滤膜(M1、M2、M3),截留分子质量分别为 4 ku、10 ku、30 ku,上海斯纳普膜分离科技有限公司产品;聚偏氟乙烯(PVDF)超滤膜(M4),截留分子质量为100 ku,上海斯纳普膜分离科技有限公司产品.
所用仪器包括:HACH DRB200型快速消解仪,HACH DR2800型分光光度计,美国哈西公司产品;PH-200型便携式pH值测定仪,青岛隆盛希望电子有限公司产品;VICTOR 86E型数显万用表,深圳市胜利高电子科技有限公司产品;XL30ESEM型环境扫描电子显微镜,荷兰菲利普公司产品.
1.2 实验装置
MFC装置由有机玻璃材料制成,阳极室和阴极室的几何体积均为220 mL(实验有效体积为200 mL).阴阳电极均为4 cm×4 cm×0.5 cm的炭毡材料,无任何修饰.阴极室内部设有曝气装置,外接1 kΩ电阻,外电路通过导线与电极相连构成回路.MFC的输出电压由数显万用表记录数据并保存至计算机,采集频率为每5 min一次.本实验启动两组平行装置,分隔膜分别为 M0、M1、M2、M3、M4.其中一组采用 M0即 PEM 膜进行运行对比,另一组采用M1做为分隔膜对MFC装置进行启动后,依次更换超滤膜进行对比实验.
1.3 反应器的接种与运行
试验采用的接种污泥取自天津纪庄子污水处理厂二沉池,厌氧保存,用模拟污水驯化一周后,取50 mL加入阳极室作为MFC反应器的接种污泥,污泥与炭毡接触有利于产电微生物的附着生长.同时,向阳极室加入150 mL营养液,营养液由基质溶液和0.8 g/L葡萄糖构成,基质成分包括KH2PO4(4.4 g/L)、K2HPO4(3.4 g/L)、NaCl(0.5 g/L)、NH4Cl(0.1 g/L)、MgCl2·6H2O(0.05 g/L)、CaCl2(0.05 g/L)和自来水1 L[14-15].溶液 pH 值为 7~7.2,电导率在 5 mS/cm 左右.阳极室添加营养液并严格厌氧,阴极室添加基质溶液并曝气.2组MFC反应器间歇运行,待电压下降至50mV以下时更换阳极室等体积的营养液,开始下一周期运行.至最大电压重复出现,表明反应器启动完成[16].运行几个周期且采集到多组数据后,更换不同的分隔膜,待装置稳定运行后进行另一周期的数据采集.
1.4 性能测试与表征
采用快速消解仪和分光光度计测定溶液COD值;采用便携式测定仪测得pH值;采用环境扫描电子显微镜观察电极表面形貌;通过极化曲线估算内阻,MFC的极化曲线采用稳态放电法绘制,当MFC稳定后依次改变电池的外电阻(10~9999 Ω),记录对应的稳定电压值[17];以饱和甘汞电极(232型,+0.2438 V vs标准氢电极,25℃)作为参比电极,测量阴阳极电势[18];电流密度、功率密度和库伦效率根据下式计算:
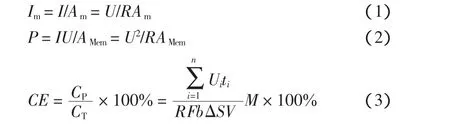
式中:U 为电压(V);R 为电阻(Ω);I为电流(mA);Am为阳极有效面积(m2);AMem为分隔膜有效面积(m2);CP为实际电量;CT为理论电量;Ui为MFC在时间ti时的输出电压;F为法拉第常数,96485 C/mol;b为1 mol COD理论产生电子的摩尔数,按每摩尔COD产生4 mol电子计算;ΔS为实验前后混合液的COD变化(mg/L);V 为 混合液体积(L);M 为 O2分子质量(32 g/mol).
2 结果与讨论
2.1 MFC的启动
首先采用两组平行装置进行MFC的启动研究,一组采用M0(PEM)作为电池分隔膜,另一组采用M1(UF4 ku)作为电池分隔膜.双室MFC在启动期间的电池电压的变化如图1所示.两组MFC反应器间歇运行,待电压下降至50 mV以下更换阳极室等体积的营养液.上下箭头分别代表以UF膜和PEM膜为分隔膜的两组MFC反应器更换营养液.
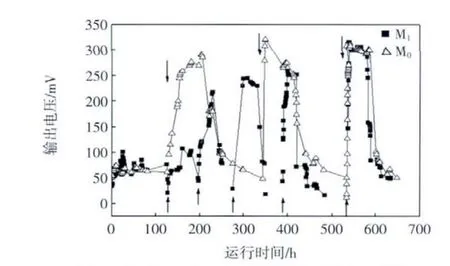
图1 双室MFC在启动期间的电压变化Fig.1 Cell voltage changes of dual-chamber MFC during starting-up period
由图1可以看出,MFC的电压可以分成延滞期、上升期、稳定期3个阶段,在0~120 h内属于延滞期,期间电压没有明显变化;100~450 h内,两组反应器电压逐渐升高,进入上升期;在500~600 h内,超滤膜和质子膜MFC输出电压最大达到0.33 V并维持较长时间,表明启动完成.MFC的启动实质上是对于电场环境的适应性优于其他菌种的产电菌在阳极表面生长、富集形成生物膜的过程,是电极对产电微生物选择的结果.2种膜在启动时,延滞期时间都相对较长,可通过前期污泥的驯化缩短启动时间.第2次更换营养液后,质子膜反应器电压升高比较明显,首次电压峰值达到0.3 V,经过2个周期的换水,达到稳定最高电压.超滤膜反应器在第2次更换营养液后,电压升高不是很明显,表明产电菌还处于与其他种群竞争生长的阶段,经过4个周期的换水,输出电压达到最高.
2.2 扫描电镜SEM分析
MFC运行一段时间后,从反应器中取出少量电极样品,经适当预处理后进行SEM分析[8],如图2所示.
由图2可以清晰看出,空白碳毡纤维丝表面较为光滑;曝气阴极浸入在基质溶液中,表面附着少量盐类结晶;阳极电极表面生长了大量的长链状微生物,微生物形态相对单一,呈多层分布,与大部分报道相同[3].可见两种分离膜启动MFC,阳极表面微生物并无明显差别.结合所得到的电压数据可以初步断定,MFC阳极上已经附着产电菌,可以认为反应器启动成功[19].

图2 电极表面SEM形貌观察Fig.2 SEM morphology of electrode surface
2.3 不同基质浓度下质子膜和超滤膜的产电性能分析
不同基质浓度下M0、M12种分隔膜的MFC其阳极输出电压随时间的变化曲线如图3所示.
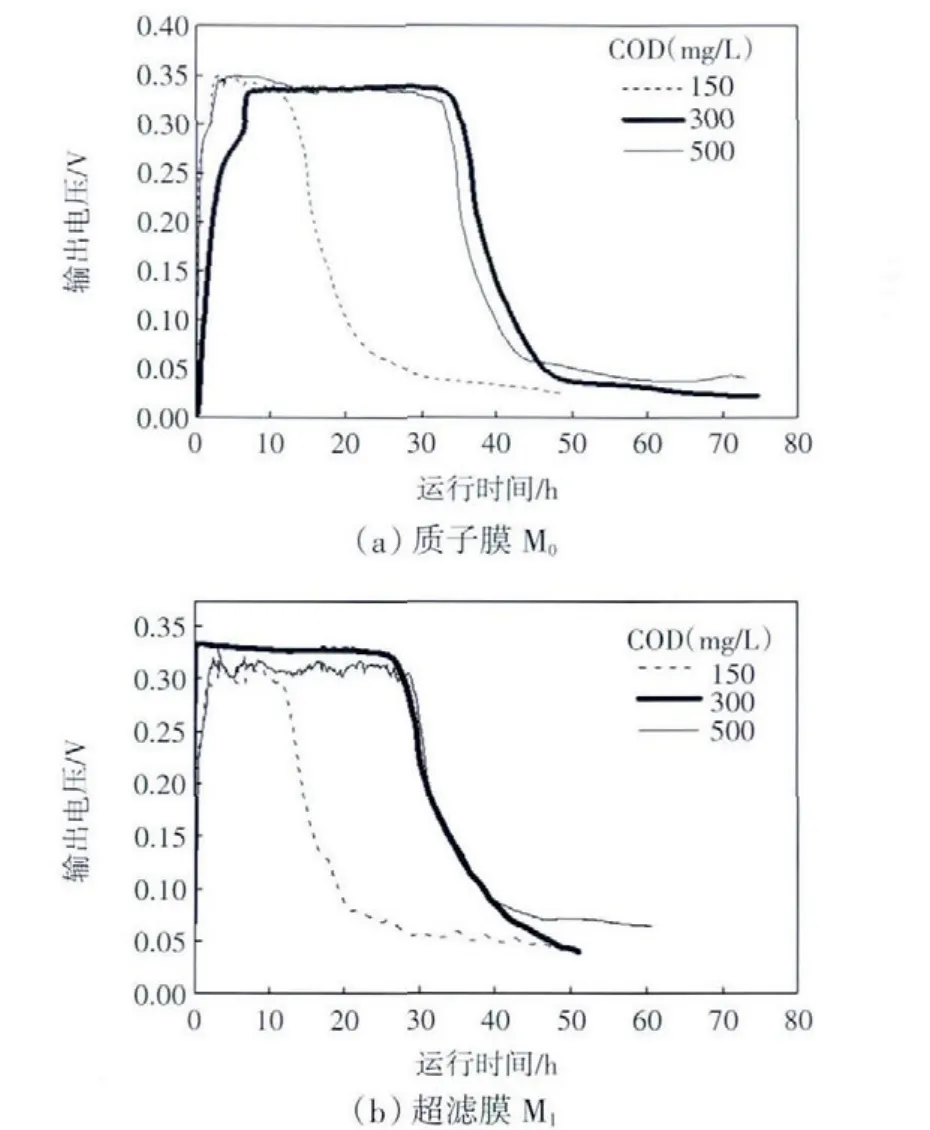
图3 不同基质浓度下MFC的产电性能比较Fig.3 Comparison of electricity production of MFC for different concentrations
由图3可以看出,PEM和UF的产电能力和趋势基本相同,整个产电周期分为上升期、稳定期和衰退期.与微生物代谢相似,MFC的产电实际上是阳极微生物增殖的结果,产电时间与进水COD浓度有关,浓度升高,相应产电时间增长,达到的最大电压基本相同,为0.34 V.PEM是一种选择透过性膜,具有良好的质子传导性,同时能够阻止阴极室中的氧气向阳极传递,保证阳极室的缺氧状态.UF是一种具有超级“筛分”功能的多孔膜,额定孔径范围为0.001~0.02 μm,其孔径只允许水分子、水中的有益矿物质和微量元素通过,而最小细菌的体积都在0.02 μm以上,不能通过.与PEM相比,UF具有良好的通透性,阴极室中小分子的溶解氧可以扩散到阳极室,部分的有机物通过好氧过程降解,从而使转化电能的有机物减少,所以相同浓度的进水COD,UF的产电周期要小于PEM.
试验分别测得两组反应器阳极室3种COD浓度溶液的进出水pH值,如图4所示.
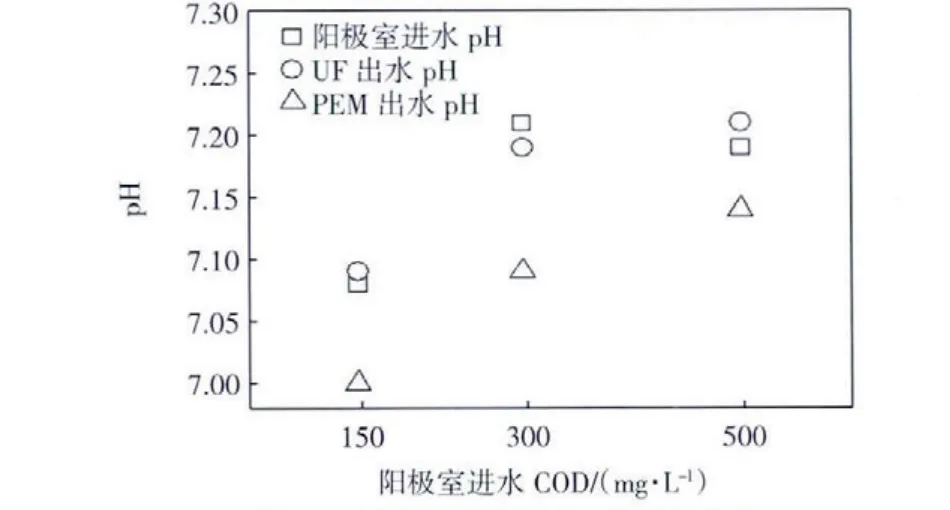
图4 阳极室进出水pH的变化Fig.4 pH changes of inlet and outlet water in anode chamber
由图4可以看出,超滤膜反应器阳极室出水pH值与进水pH变化不大,而质子膜反应器阳极室出水明显低于进水;由于营养液具有缓冲体系,pH均在7左右.在本文实验条件下,质子膜作为分隔膜,阳极出水pH值普遍有所降低,这是因为阳离子(如K+、Na+、Mg2+、Ca2+、NH4+等)的过膜速率是 H+的 105倍,而且质子膜易受NH4+等离子污染[20],再由于质子膜具有非特异选择性,所以大量金属阳离子将取代质子扩散进入阴极,使得MFC阳极室和阴极室的pH发生偏移.与离子交换膜不同,超滤膜进出水的pH值几乎保持不变,这是因为超滤膜不仅能使阴阳离子自由穿透,而且水和其他小分子化合物也能穿透,对于维持阴阳两室的pH值和电导率有着积极的作用.
2.4 不同截留分子质量的超滤膜产电性能分析
考察稳定运行后的MFC在一个反应周期内的电压变化和COD去除规律,以阳极室进水COD质量浓度为500 mg/L为例,如图5所示.COD去除效果及库仑效率如表1所示.
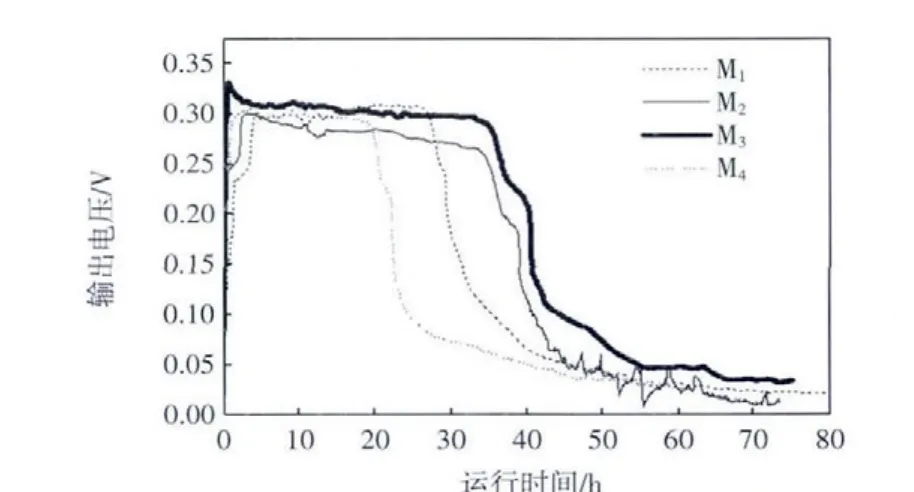
图5 双室MFC电压随时间的变化Fig.5 Voltage changes in dual-chamber MFC with different MWCO UF membranes

表1 COD去除效果及库仑效率Tab.1 COD removal effect and coulomb efficiency
不同超滤膜的孔径大小决定了质子迁移的速率,质子以水合质子的形式进行迁移,产电能力各有差异.将产电周期中稳定期的时间定义为产电时间,则4种超滤膜MFC的产电时间从长到短依次为M335.4 h、M231.3 h、M122.8 h、M417.9 h.UF 膜具有良好的通透性,随着截留分子质量的增大,阳极室中由产电微生物分解有机物生成的氢离子更容易通过分隔膜,到达阴极室,构成回路形成电流;而大部分没有透过分离膜的氢离子则与阳极室内磷酸缓冲体系进行反应消耗,所以4种UF膜的库伦效率都较低.对于M4,阴极室中小分子的溶解氧更容易扩散到阳极室,更多的有机物通过好氧过程降解,使转化电能的有机物减少,所以产电时间最短.产电结束后阳极室出水COD基本低于80 mg/L,阳极室对COD的去除率基本达到85%以上.库伦效率最大为4.15%.
2.5 UF极化曲线和功率密度特征
为进一步考察分隔膜对MFC产电性能的影响,分别对4种超滤膜MFC进行极化特性分析,如图6所示.
MFC有充足基质并处于稳定产电能力时,通过改变外接电阻(9999~1 Ω)来改变电路中的电流,观察电位对电流的响应来获得电池的极化曲线.通常情况下极化曲线可分为3个区域,分别为活化极化区、欧姆极化区和浓差极化区.在欧姆极化区,电池对外输出功率最大,极化曲线呈线性关系,拟合直线斜率即为电池的表观内阻[21].如图6可知,M3体系功率密度最大,为113.3 mW/m2;内阻从小到大依次为M3157 Ω、M1211 Ω、M4241 Ω、M2297 Ω.内阻越低,功率密度越大.离子迁移的阻力不仅受膜孔径影响,而且还与膜材料本身的性质有关.对于PVDF材质体系(M4),膜孔径较大,但内阻明显高于PES材质体系(M3).
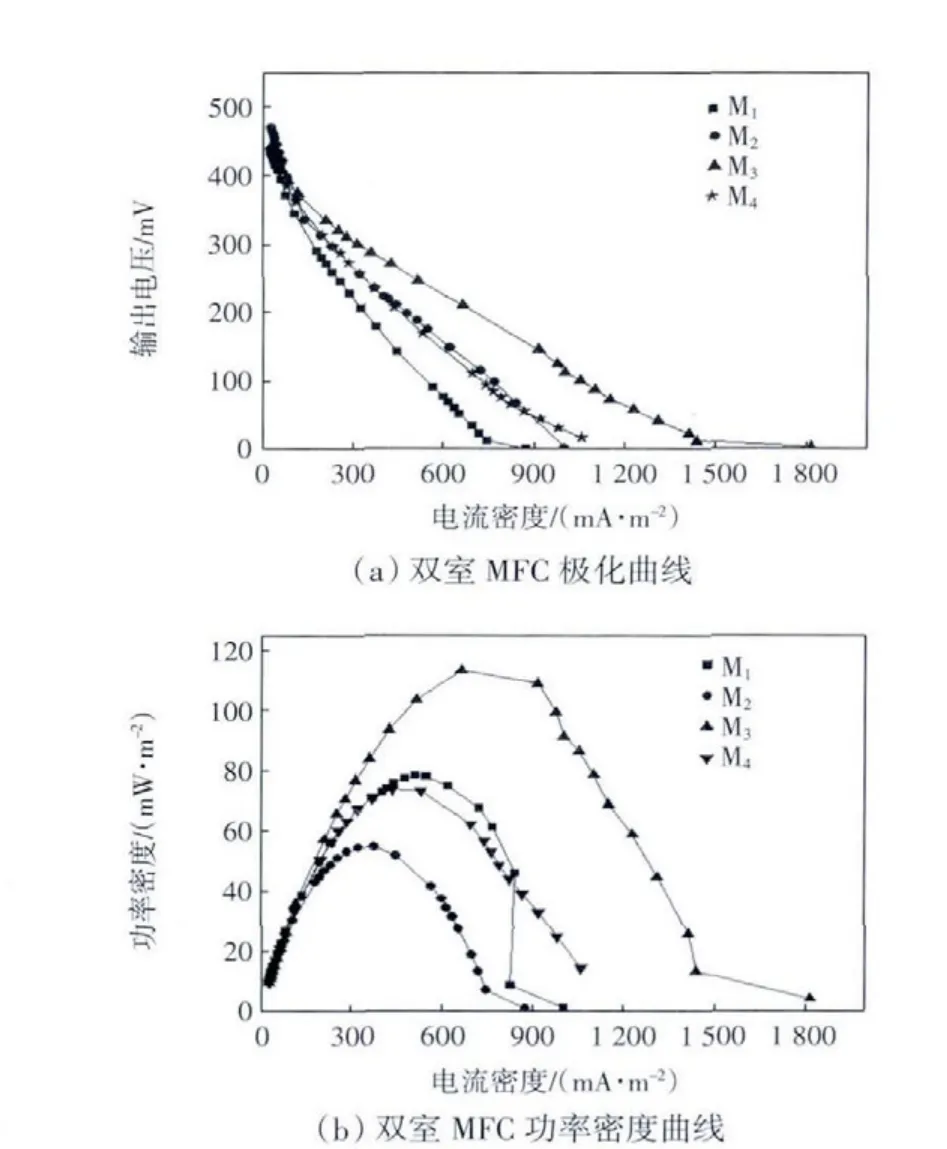
图6 双室MFC的极化曲线和功率密度曲线Fig.6 Polarization curves and power density curves of dual-chamber MFC
3 结论
(1)在双室微生物燃料电池结构中,UF与PEM相比,体现出了相似的产电特征,产电时间随着阳极室进水COD的浓度增大而增加,UF(30 ku)的最大输出电压可以达到0.34 V.由于UF隔膜特有的膜通透性,因此较PEM产电周期略短.
(2)将UF作为隔膜的MFC,产电结束后阳极室出水COD低于80 mg/L,阳极室对COD的去除率达到85%以上,且与PEM隔膜MFC体系相比,pH更为稳定.分析比较4种不同截留分子质量超滤膜的产电特性,截留分子质量为30 ku的超滤膜,具有最低的内阻157 Ω,最大的功率密度113.3 mW/m2.
(3)PES材质超滤膜的内阻小于PVDF材质超滤膜,更适于作为MFC的分隔膜材料.
[1]詹亚力,张佩佩,门光绪,等.微生物燃料电池及其应用研究进展[J].现代化工,2007,27(l):13.
[2]崔康平,金松.微生物燃料电池阳极室内电子受体竞争研究[J].环境科学研究,2010,23(1):90-93.
[3]LIU H,LOGAN B E.Electricity generation using an aircathode single chamber microbial fuel cell in the presence and absence of a proton exchange membrane[J].Environ Sci Technol,2004,38(14):4040-4046.
[4]CHENG S,LOGAN B E.Ammonia treatment of carbon cloth anodes to enhance power generation of microbial fuel cells[J].Electro-Chemistry Communications,2007(9):492-496.
[5]VIRDIS B,FREGUIA S,ROZENDAL R A,et al.Microbial fuel cells[J].Treatise on Water Science,2011,18(4):641-665.
[6]LOGAN B E.Feature article:Biologically extracting energy from wastewater:Biohydrogen production and microbial fuel cells[J].Environ Sci Technol,2004,38:160A-167A.
[7]刘志华,李小明,杨慧,等.不同处理方式污泥为燃料的微生物燃料电池特性研究[J].中国环境科学,2012,32(3):523-528.
[8]尤世界,赵庆良,姜珺秋.废水同步生物处理与MFC发电研究[J].环境科学,2006,27(9):1786-1880.
[9]GEMMA R,KEVIN D M,TEENA M,et al.Extracellular electron transfer via microbial nanowires [J].Nature,2005,435:1098-1101.
[10]郭伟,王艺菲,银晓晴,等.微生物燃料电池在废水处理中的应用研究进展[J].河南师范大学学报,2012,40(1):93-96.
[11]LOGAN B E,JOHNM R.Electricity-producing bacterial communities in microbial fuel cells[J].Trends Microbiol,2006,14:512-518.
[12]LIPING H,JOHN M R,XIE Q.Electron transfer mechanisms,new applications,and performance of biocathode microbial fuel cells[J].Bioresource Technology,2011(102):316-323.
[13]JUNG R K,SHAOAN C,EUN S O,et al.Power generation using different cation,anion,and ultrafiltration membranes in microbial fuel cells[J].Environ Sci Technol,2007,41(3):1004-1009.
[14]XIE Shan,LIANG Peng,CHEN Yang,et al.Simultaneous carbon and nitrogen removal using an oxic/anoxic-biocathodemicrobial fuel cells coupled system[J].Bioresource Technology,2011(102):348-354.
[15]刘晶晶,孙永明,孔晓英,等.不同接种条件下微生物燃料电池产电特性分析[J].中国环境科学,2011,3(10):1651-1656.
[16]LOGAN B E,HAMELERS B,ROZENDAL R,et al.Microbial fuel cells:Methodology and technology[J].Environ Sci Technol,2006,40(17):5181-5192.
[17]黄霞,范明志,梁鹏,等.微生物燃料电池阳极特性对产电性能的影响[J].中国给水排水,2007,23(3):8-13.
[18]曹效鑫,梁鹏,黄霞.“三合一”微生物燃料电池的产电特性研究[J].环境科学学报,2006,26(8):1252-1257.
[19]张金娜.三种不同阴极类型微生物燃料电池产电[D].哈尔滨:哈尔滨工业大学,2009.
[20]RENE A R,HUBERTUS V M,CEES J N.Effects of membrane cation transport on pH and microbial fuel cell performance[J].Environ Sci Technol,2006,40(17):5206-5211.
[21]梁鹏,范明志,曹效鑫,等.微生物燃料电池表观内阻的构成和测量[J].环境科学,2007,28(8):1894-1898.
