甾体生物转化技术研究的现状与进展
2013-10-25许正宏史劲松
许正宏,吴 燕,李 会,李 恒,史劲松
(江南大学 医药学院,无锡 214122)
甾体药物是仅次于抗生素的第二大类药物,具有很强的抗过敏、抗感染、抗病毒等药理活性,已被广泛应用于治疗内分泌失调、心血管、胶原性病症、淋巴白血病、人体器官移植、抗肿瘤、细菌性脑炎、皮肤病、风湿病、老年性疾病等[1-2]。甾体生物转化即利用微生物酶对甾体底物的某一部位进行特定的化学反应来获得一定的产物。与传统的化学合成法相比,甾体生物转化具有反应条件温和、环境友好、高效性和高选择性等优势,还能合成化学合成法所不能合成的一些甾体中间体。近些年来,微生物转化工艺在甾体药物合成路线中的比例迅速增加,形成了一条生物 化学法耦联的甾体药物合成新工艺。最为成功的案例是利用黑根霉Rhizopus nigricans在孕甾酮的C11α引入羟基,解决了皮质激素合成中的关键问题,产品收率大幅度提高,专一性增强,效果远超化学合成法的合成效果,开创了微生物转化甾体化合物的先例[3]。
目前,甾体药物的合成主要集中在以具有甾体母核结构的天然产物为原料、采用化学法和微生物转化法相结合的方式来合成甾体类药物。综合国内外研究,生物转化技术在甾体药物生产中的应用主要分为两大类:①将天然原料转化为生产甾体化合物的普通中间体,如利用生物转化降解植物甾醇(豆甾醇、谷甾醇、麦角固醇)边链生成有用的甾体医药中间体,主要为雄甾-4 -烯,3,17-二酮(AD)及雄甾 -1,4 -二烯,3,17 -二酮(ADD);②对甾体药物的特定位点进行修饰,生成具有生物活性但化学合成法难以合成的化合物,如 9α、11α、11β、7α、15α等位点的羟化,Δ1脱氢及A环的芳香化等[4]。甾体生物转化反应的多样性,不仅解决了化学合成法步骤多、效率低、成本高和污染大的缺点,而且为甾体药物的合成提供了更多的途径。因此,生物转化技术作为甾体药物合成工艺中的补充替代途径,将成为甾体医药工业的关键生产技术。
然而,在甾体类化合物的生物转化过程中,由于甾体底物溶解性差、培养基传质效率低、底物产物的反馈抑制和全细胞生物催化副产物多等原因,菌株的转化能力和甾体的转化效率仍然偏低,是甾体生物转化技术实现工业化的主要瓶颈。笔者精选了近些年生物转化法在合成甾体药物领域的突出成果,从半合成原料、菌种选育及改良、生物转化新工艺及新技术等方面进行综述。
1 半合成原料
中国是甾体激素要素原料及其制剂的主要生产国,原料药年产值近100亿元,其中70%出口,且皮质激素类原料的生产规模已居世界之首。但我国并非甾体激素药物产业的强国,目前主要依赖于单一植源性薯蓣皂素、剑麻皂素及西南山地高原野生的蕃麻皂素为半合成原料,生产以皮质激素为代表的低档次初级产品。国际市场一方面大量吸收我国的低端产品,如氢化可的松、泼尼松等;一方面又利用其技术优势将其高端产品倾销给我国。薯蓣皂素的日渐枯竭造成原料成本价格上升,同时合成的低端产品又缺乏国际竞争力,这给我国甾体药物产业带来了严重的危机。因此,需要积极努力开发新型甾体原料资源,研究收率高、成本低、环境污染小的绿色工艺,迎头赶上世界先进水平,成为甾体激素药物产业的强国。
植物甾醇,包括β -谷甾醇、豆甾醇、油菜甾醇等,主要来自于豆类植物或炼油下脚料,具有甾体化合物的母核结构,将其“变废为宝”能有效解决水解黄姜所带来的环境污染问题。其中,β-谷甾醇、油菜甾醇或其19-羟化的衍生物是目前比较常用的植物甾醇,经 Mycobacterium sp.、Rhodococcus sp.和Fusarium sp.等菌属切除边链后可一步生成 AD、ADD或9α-OH -AD这3类甾体药物中间体[5-7]。AD和ADD是最具有市场价值的甾体药物中间体,对其活性部位进行结构改造,可用于合成多种皮质类固醇,如盐皮质甾醇、口服避孕药等其他甾体药物。2011年,全球AD/ADD的年销售总额高达10亿美元,而且呈逐年递增的趋势。植物甾醇是天然无毒的活性物质,原料来源广泛,价格低廉,其侧链用化学手段难以降解,长期以来被当做废物处理,微生物选择性降解边链技术使得植物甾醇被有效利用,成为薯蓣皂素的替补资源。
胆固醇是近些年另外一种比较受关注的甾体药物新资源,主要是从猪、牛、鱼等动物的脂肪和油中提取所得。关于微生物降解甾醇边链合成重要的甾体激素药物已总结于图1中。胆固醇的边链降解与植物甾醇类似,在C17位断裂氧化形成17 -甾酮[8]。该化合物是合成性激素、糖皮质激素、利尿剂等的关键中间体,年生产量超过1000 t,其中60%都是由生物转化技术生产。在所有的天然甾醇中,β-谷甾醇和胆固醇是最适合生产17-甾酮产品的,但胆固醇比β-谷甾醇的生物利用程度低,因此由胆固醇生产17 -甾酮的成本较高。
其他甾醇原料,如存在于酵母及真菌中的麦角甾醇,又称麦角固醇,是一种重要的医药化工原料,可用于氢化可的松、黄体酮等药物的生产[9]。羊毛固醇及其衍生物经分枝杆菌 Mycobacterium sp.NRRL B -3805降解边链、脱氢作用后均能形成甾体药物的前体化合物。甾体药物原料虽然来源广泛,但是基本上都在C17位上有一个侧链,需要复杂的边链降解反应才能形成药物中间体,因此寻找新型、有效的甾体药物前体原料仍是未来甾体生物转化方向的热点之一。
2 转化菌种选育及改良
生物催化剂的种类不够多、适用的反应类型有限是当前限制甾体生物催化发展的因素之一,因此需要大规模从自然界筛选特定功能的催化剂,或对原有的催化剂进行改造。目前在高产菌株的选育中,诱变育种仍然是普遍应用并十分有效的方法,但由于甾体类微生物的转化菌株大多数为放线菌、霉菌等,相对细菌来讲,这类菌株细胞结构的复杂性和特殊性导致采用菌丝体的诱变方法很难达到预定的诱变效果。因此,在了解菌株细胞结构特征的基础上,采用单孢子或原生质体诱变并结合特定的筛选方法和适当的压力条件进行多轮多次突变选择效果较好。此外,随着基因工程技术的日益完备,采用分子生物学手段对菌种的分子改造也成为比较有效且常用的方法之一。
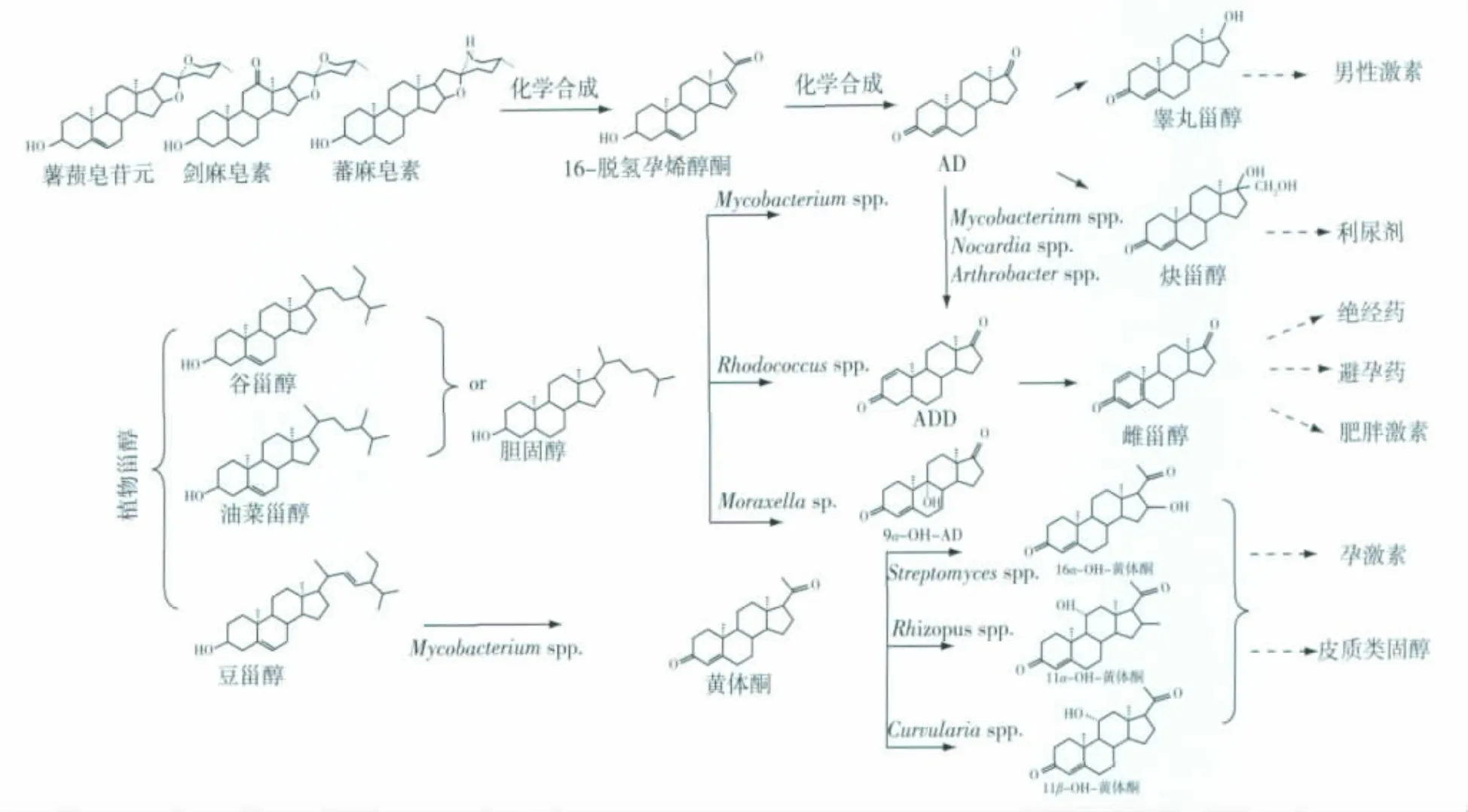
图1 甾醇边链的降解Fig.1 Microbial degradation of sterol side-chains
2.1 原生质体抗药性筛选方法
由于化学或物理诱变方法所产生的突变是随机的,突变无方向性,导致目标菌株筛选工作量大,直接影响了诱变育种的工作效率。细胞色素P450为甾体的微生物羟化反应中起催化作用的酶。而酮康唑等唑类化合物可以通过未共享电子对与P450的血红素铁形成p π -dπ作用键,或将P450保守的半胱氨酸上的巯基(SH)电子密度推向血红素铁,成为血红素优良的配体,从而与P450竞争分子氧或底物,抑制P450活性[10]。因此,可以利用真菌对唑类药物产生的抗药性机制,对真菌类菌株进行抗药性筛选。天津科技大学王敏课题组应用酮康挫抗性筛选法,采用紫外线诱变处理的甾体11β -羟基化菌株——新月弯孢霉的原生质体(有完整核型),获得了氢化可的松转化率为出发菌株1.42倍的遗传稳定突变株[11]。借助丝状真菌的原生质体,结合传统的理化诱变/抗性筛选,再生具有完成核型的细胞克隆,分离选育具有甾体11β -羟基化能力的稳定型菌株可行且有效,该菌种选育方法可对选育其他细胞色素P450催化的羟基化菌株提供借鉴。
2.2 多代压力组合突变法
Donova等[12]报道了由谷甾醇产生9α-OHAD分枝杆菌突变菌株筛选的研究。应用谷甾醇的选择压力,结合传统诱变作用,获得能够转化谷甾醇为9α-OH -AD的菌株,而野生分枝杆菌只能将谷甾醇转化为AD。采用多代压力组合突变法的具体流程:①菌种的驯化诱变,在选择性底物谷甾醇培养基上继代培养10次,获取得到能轻微产生9α-OH -AD的菌株,采用紫外(UV)辐射方法筛选突变菌株,得到既能够切除谷甾醇边链、又能向9α位引入羟基的菌株。继而与底物谷甾醇保温培养。经多批驯化,转化效率由首批的2.7%提高到59.6%的产物积累浓度;②继续采用谷甾醇选择压力,并结合传统的化学诱变剂-甲基磺酸乙酯(EMS)和丝裂霉素C进行UV辐照处理。经由多代的谷甾醇压力组合突变选择,是获得9α-OH -AD菌株的一种有效方法。
2.3 菌株的分子改造
针对在甾体生物转化过程中,会产生产物进一步降解及其他副产物的问题,可采用将引起副产物的关键酶基因敲除的方法。例如Brzostek等[13]在研究Mycobacterium降解植物甾醇时,敲除羟化酶基因后能部分抑制母核的降解,这可能是因为9α -羟化酶具有同工酶,或者编码9α -羟化酶的是一个基因簇,9α羟化是酶共同作用的结果。
为了提高甾体羟基化反应的效率,研究者们将甾体P450酶在工程菌种中进行异源表达。例如,将能够催化甾体17α -羟化和C17,20 -裂解酶反应的全功能人的P45017α(CYP17)在毕赤酵母GS115中表达,表达的酶能够催化黄体酮生成17α -羟基孕酮和16 -羟基孕酮[14]。羟化反应的效率也可以通过辅酶与P450氧化酶共表达来实现。Pertric等[15]将来源于米根霉Rhizopus oryzae的11α -羟化酶(CYP509C12)与依赖于NAD(P)H的P450还原酶在分泌型表达的酵母宿主中共表达,与仅表达11α -羟化酶(CYP509C12)相比,11α羟化反应的速率提高了7倍。
另外,将合成生物学的概念应用于甾体生物转化,将合成甾体化合物的整个代谢途径打通,实现单一微生物的多步转化。一个最为典型的例子是将13个不同来源的基因在酿酒酵母中异源表达,通过对两条线粒体系统的调控和3个编码的非目的反应基因的敲除,使得原本仅产生麦角甾醇的酵母菌能在利用糖和醇的培养条件下产生氢化可的松[16]。该工作证明了由高级真核微生物的复杂代谢途径转移到低等微生物中的可行性。但重组菌种以20 g/L葡萄糖转化时,最高获得氢化可的松的质量浓度仅为(11.5±0.3)mg/L,转化效率较低。
3 甾体生物转化新工艺与新技术
近些年来,虽然在选育甾体有效生物催化剂上取得了一定成效,但甾体的低水溶性(10-6~10-5mol/L)仍是生物转化过程的主要限制因素。由于甾体疏水性强,甾体转化酶为胞内酶,导致底物与全细胞催化剂接触不充分,造成底物的利用率不高,转化时间延长。因此,提高底物在转化体系中的有效反应浓度、加速底物与产物进出胞内外的过程是开发新型转化工艺以提高甾体转化率的核心。目前,针对上述问题,国内外的研究主要集中于三大方向:提高底物溶解性、建立新型转化体系、改善细胞通透性。
3.1 物理、化学助溶法
甾体化合物是脂溶性化合物,在水中溶解度低,故反应过程中以液态形式存在的底物有效浓度偏低,使得反应过程不能有效进行。因此,采用合适的手段改善底物在反应过程中的有效浓度,能提高底物的转化率和缩短转化周期。
3.1.1 底物微粉化
通过物理(如超声波)或机械(如研磨)的方法处理底物使其成为纳米或微米级的微粒,提高底物在水中的分散度和溶解速率,从而增加底物分子与酶的接触机会,反应持续向产物方向移动。比较成功的例子是工业上用气流粉碎的方法粉碎醋酸可的松,加入少量乙醇助溶后直接投料,在底物投料质量分数为7%的条件下可将底物转化率提高到90%。
有机溶剂或表面活性剂预溶底物,即先将底物用乙醇、丙酮、N,N -二甲基甲酰胺等有机试剂或表面活性剂Tween -80、Tween -20预溶,然后再以液体的形式加入到发酵液中进行转化,这是目前比较常用的提高底物溶解度的方法。徐诗伟等[17]研究地塞美松(dexamethasone)中间体的C1,4 -脱氢和11α -羟基化时,采用体积分数为2% ~4%的N,N -二甲基甲酰胺预溶解底物后进行投料,使产物转化率提高约40%。添加有机溶剂在某些转化反应中还能抑制副产物生成,Angelova等[18]在研究有机溶剂对红球菌(Rhodococcus sp.)羟化AD的影响时,发现转化体系中添加邻苯二甲酸酯可以显著抑制AD母核C1,2位的脱氢反应,同时将9α -羟化产物的产量提高到60%。有机试剂能在一定程度上改变底物的溶解度,但对菌体有一定的毒害作用,在特定的生物转化反应过程中,要根据底物特性和菌体的有机溶剂耐受性,通过实验摸索选择合适的有机试剂和相应的浓度。
3.1.2 环糊精包合法
环糊精及其衍生物(如甲基-β -环糊精,羟丙基-β -环糊精)能形成疏水性空腔,通过氢键、分子间作用力、范德华力等可以与甾体类疏水性强的客体分子相互作用而形成包合物。Lu等[19]将环糊精用于Arthrobacter simplex TCCC 11037转化醋酸可的松(CA)为醋酸强的松(PA)的脱氢反应,发现添加环糊精可将底物、产物的溶解度分别提高36.7倍和19.8倍,同时解决了底物溶解度差和产物的反馈抑制问题,从而提高甾体化合物的利用效率。Donova等[20]研究了甲基-β -环糊精(M-β -CD)对AD/ADD的产量、细胞的生长以及细胞膜组成和超微结构的影响,发现在转化培养基中添加M-β -CD后能使AD/ADD的产量提高1.6倍。因此,根据甾体化合物的结构特性,合成新型的环糊精衍生物,同时全面分析甾体底物与环糊精的分子识别机制,将有利于进一步挖掘环糊精在微生物转化甾体领域的潜能。
单一使用某种有机试剂、表面活性剂或环糊精的效果有限,在实验过程中,可以根据各自的优缺点设计“复合配方”,在不影响菌体生长的前体下,到达高底物投料浓度、高转化率、高产物得率的目的。
3.2 建立新型转化体系
生物转化过程可以分为底物分子向胞内的运转、酶促反应和产物分子向胞外分泌3个过程。其中,酶促反应速率主要是由生物酶固有的活性所决定,而底物和产物分子的传递速率是可以通过外界条件来控制的。目前,大部分的研究主要致力于寻找新型转化体系,以提高甾体的转化效率,笔者列举了近年来一些新型的转化体系,并比较各种转化体系的优缺点,总结归纳于表1。

表1 不同甾体微生物转化体系的优缺点Table 1 Advantages and drawbacks of various biotransformation systems
双液相转化体系和双水相转化体系根据底物和产物在两相中分配系数的不同,能较好解决底物、产物水溶性差的问题,而且能随底物的特性改变两相的组分,体系易制备且灵活性较大,故是目前工业上应用得比较多的转化工艺。为解除有机试剂对细胞呼吸链的损害,保证细胞的活性,可以将固定化技术与两相催化技术耦合,通过固定化对生物酶形成保护层,互补缺点,实现生物转化“高速、高效”相统一的方法。
随着人们对转化体系研究的不断深入,新兴的浊点系统、离子液体开始受到广泛的关注。底物在浊点系统的两相中是不均匀分配的,因此能控制底物的扩散速率,保证转化过程中底物始终处于最适浓度,既能解除底物的抑制效应又能提高传质速率,还能原位萃取产物而避免产物的反馈抑制。Wang 等[21]建立了Triton X -100和Triton X -114形成的浊点系统,并将其应用于Mycobacterium sp.降解胆固醇的边链,AD和ADD的产量得到大幅度提高。
另外一种新型转化系统——离子液体,是完全由离子组成的液体,在低温(<100℃)下呈液态的盐,也称为低温熔融盐,它一般由有机阳离子和无机阴离子所组成。最初的离子液体主要用于电化学研究,近年来离子液体作为绿色溶剂在有机及高分子合成领域受到重视。Wu等[22]研究了离子液体对黑根霉(Rhizopus nigricans)11α -羟化 16α,17α-环氧黄体酮的影响,发现[BMIm][PF6]-水组成的两相体系能在底物浓度为18 g/L的条件下将底物转化率提高到90%以上,且转化体系连续利用3个批次后,总转化率仍能达到87%。由于离子液体具有高效、无毒、无污染、回收方便和可重复使用等优势,为全细胞生物催化的大规模应用奠定了基础。
3.3 细胞通透性改良法
甾体转化酶属于胞内酶,甾体分子必须跨过壁膜与酶接触才可参加反应,所以细胞的通透性直接影响甾体化合物的转化。早在1982年,Jawofski等[23]在去氢可的松的 11β -羟化中添加适量的稀KOH溶液、蜗牛酶、乙二胺四乙酸(EDTA)处理真菌Anninghamella属孢子,发现其外形变得膨大,膜上有微孔出现,羟化产量可以提高2~4倍。利用Mycobacterium sp.降解谷甾醇边链时,在其培养基中加入微量青霉素、多粘菌素、杆菌肽和乙胺丁醇等抗生素,可以抑制细胞壁肽聚糖的合成,提高细胞通透性,在一定程度上提高转化产物 AD的产量[24]。随后,利用透射电镜观察了添加杆菌肽和不添加杆菌肽处理的细胞,发现添加杆菌肽后细胞结构出现畸形,推测这种畸形有利于改善细胞壁的通透性和减少底物的跨膜阻力,最终达到提高转化效率的目的。
此外,在菌体培养的过程中加入卵磷脂、鱼精蛋白、聚乙烯亚胺、m -氯苯丙氨酸等试剂也能在一定程度上影响细胞壁的合成或改变细胞壁组成成分,提高甾体的转化率和产物得率。添加细胞壁干预剂来提高细胞膜的通透性,在提高单位菌体量的比酶活上有一定程度的优势,但是对菌体生物量会造成一定的负影响。
制备原生质体用于甾体转化是另一种有效解除细胞壁阻碍作用的方法。王敏等[25]利用新月弯孢霉原生质体对氢化可的松进行11β -羟化,实验结果表明:采用溶壁酶(2.5 mg/mL)和纤维素酶(5 mg/mL)的混合酶液溶解蓝色犁头霉可形成大量原生质体,且其11β-羟化酶活性明显高于完整菌丝体,在底物浓度相等的情况下可将转化周期由48 h缩短至36 h。原生质体转化技术虽然有效改善了底物的传质阻力,但存在稳定性差、再生迅速等问题,严重限制了其在工业上的应用。
4 结语
近年来,生物转化技术显示出化学合成技术所无法取代的优势,吸引了大批国内外研究者对甾体生物转化技术进行研究和改进。虽然在菌种的选育及改良、提高底物溶解性、建立新型转化体系等方面取得了显著的成果,但是大多数菌株的生产力仍未达到工业化水平,造成基础研究与产业化相脱节。甾体生物转化的研究依然任重道远,需要新思路、新思维、新方法进行更深入、更全面的研究,最终达到降低生产成本、提高转化效率、减少有毒有害试剂使用的目的。
生物转化技术在甾体药物合成领域的趋势主要集中在以下几个方面:①菌株方面,利用高通量筛选技术寻找新型高效优良的转化菌株,其中海洋微生物具有很大的潜力;利用组合诱变技术对已有菌株进行改良,提高底物转化率和底物广谱性。②寻找新型甾体药物原材料,如从种类繁多的海洋生物中获得多种多样结构独特的新甾体化合物;采用不同菌株对多种甾体化合物进行转化,以期获得新的甾体衍生物,增加甾体药物前体的品种,为甾体药物的合成提供新途径。③转化新工艺的研究,将固定化技术、混合培养技术、两相催化技术或几种技术的耦合应用于甾体转化过程,以提高转化效率和降低生产成本,提高甾体转化的水平和竞争力。④将基因工程成熟的技术手段应用甾体微生物转化,如采用基因工程技术敲除某些旁路酶基因,切断副产物的形成途径;通过分子生物学手段,获得某个或某些关键酶的基因并在合适的宿主中表达,得到大量的重组蛋白后对酶结构进行解析,再通过理性的定点突变技术或非理性定向进化技术从基因水平上改造酶的特异性、稳定性、高效性。
[1]Fernandes P,Cruz A,Angelova B,et al.Microbial conversion of steroid compounds:recentdevelopments[J].Enzymeand Microbial Technology,2003,32:688-705.
[2]白宝星,王明蓉.甾体药物生物转化体系的研究进展[J].国外医药抗生素分册,2007,28(5):210-214.
[3]Murray H C,Peterson D H.Oxygenation of steroids by mucorales fungi:US,2602769[P].1952-07-08.
[4]Donova M V,Egorova O V.Microbial steroid transformations:current state and prospects[J].Applied Microbiology and Biotechnology,2012,94(6):1423-1447.
[5]Donova M V,Dovbnya D V,Sukhodolskaya G V,et al.Microbial conversion of sterol-containing soybean oil production waste[J].Journal of Chemical Technology and Biotechnology,2005,80(1):55-60.
[6]Perez C,Falero A,Duc H L,et al.A very efficient bioconversion of soybean phytosterols mixtures to androstanes by Mycobacteria[J].Journal of Industrial Microbiology and Biotechnology,2006,33(8):719-723.
[7]Olivares A,Acevedo F.Effect of inoculation strategies,substrate to biomass ratio and nitrogen sources on the bioconversion of wood sterols by Mycobacterium sp.[J].World Journal of Microbiology and Biotechnology,2011,27(11):2513-2520.
[8]Nippon Oil and Fats Co Ltd.Decomposition of cholesterol in fat and oil:JP,01229097[P].1989-09-12.
[9]南春辉.麦角甾醇的研究进展[J].中国新技术新产品,2009,10:6-7.
[10]郭亚文.新月弯孢霉抗性菌株选育及P450酶特性分析[D].天津:天津科技大学,2004.
[11]卢文玉,陈伴成,郭亚文,等.氢化可的松高产菌株新月弯孢霉的选育[J].微生物学通报,2003,30(6):26-29.
[12]Donova M V,Gulevskaya S A,Dovbnya D V.Mycobacterium sp.mutant strain producing 9α-hydroxyandrostenedione from sitosterol[J].Applied Microbiology and Biotechnology,2005,67:671-678.
[13]Brzostek A,SliwinskiT,Rumijowska-GalewiczA,etal.Identification and targeted disruption of the gene encoding the main 3-ketosteroid dehydrogenase in Mycobacterium smegmatis[J].Microbiology,2005,151(7):2393-2402.
[14]Kolar N W,SwartA C,MasonbJI,etal.Functional expressionand characterization of human cytochrome P45017α in Pichia pastoris[J].JournalofBiotechnology,2007,129:635-644.
[15]Petric S,Hakki T,Bernhardt R,et al.Discoveryof a steroid 11αhydroxylase from Rhizopus oryzae and its biotechnological application[J].Journal of Biotechnology,2010,150:428-437.
[16]Szczebara F M,Chandelier C,Villeret C,et al.Total biosynthesis of hydrocortisone from a simpale carben source in yeast[J].Nature Biotechnology,2003,21:143-149.
[17]徐诗伟,徐清,曹桂芳,等.地塞美松中间体进行的C1,4脱氢和11α -羟基化[J].生物工程学报,2000,16(11):763-765.
[18]Angelova B,Fernandes P,Cruz A,et al.Hydroxylation of androstenedione by resting Rhodococcus sp.cells in organic media[J].Enzyme and Microbial Technology,2005,37:718-722.
[19]Lu W,Du L,Wang M,et al.A novel substrate addition method in the 11β-hydroxylation of steroids by Curvularia lunata[J].Food and Bioproducts Processing,2007,85(1):63-72.
[20]Donova M V,Nikolayeva V M,Dovbnya D V,et al.Methyl-βcyclodextrin alters growth,activity and cell envelope features of sterol-transforming Mycobacteria[J].Microbiology,2007,153(6):1981-1992.
[21]Wang Z L,Zhao F S,Chen D J,et al.Cloud point system as a tool to improve the efficiency of biotransformation[J].Enzyme and Microbial Technology,2005(36):589-594.
[22]Wu D X,Guan Y X,Wang H Q,et al.11α-Hydroxylation of 16α,17-epoxyprogesterone by Rhizopus nigricans in a biphasic ionic liquid aqueous system[J].Bioresource Technology,2011,102:9368-9373.
[23]Jawofski A,Sedlaczek L,Sasiak A.Transformation of steroids by fungus spores[J].Applied Microbiolology and Biotechnology,1982,13(3):155-160.
[24]Malaviya A,Gomes J.Enhanced biotransformation of sitosterol to androstenedione by Mycobacterium sp.using cell wall permeabilizing antibiotics[J].Journal of Industry Microbiology and Biotechnology,2008,35(11):1235-1244.
[25]王敏,王春霞,路福平,等.蓝色犁头霉原生质体的制备与再生[J].工业微生物,200l,3l(2):20-22.
