生物催化法合成6-氰基-(3R,5R)-二羟基己酸叔丁酯
2013-10-25王亚军柳志强郑裕国
肖 黎,王亚军,曹 政,柳志强,郑裕国
(浙江工业大学生物工程研究所生物转化与生物净化教育部工程研究中心,杭州 310014)
阿托伐他汀钙对胆固醇合成的关键限速酶3-羟基-3-甲基辅酶A(HMG-CoA)还原酶具有强烈的抑制作用,可抑制胆固醇的合成,是治疗心血管疾病的重要药物[1-2]。6-氰基 -(3R,5R)-二羟基己酸叔丁酯((3R,5R)-2)是阿托伐他汀钙的双手性药效基团、关键手性合成砌块[3]。传统的(3R,5R)-2化学合成法需要深冷条件(反应温度低于-60℃),且反应副产物多、产物光学纯度低,还存在能量和溶剂消耗大等缺陷[4]。理论上,利用氧化还原酶不对称还原6-氰基-(5R)-羟基-3-羰基己酸叔丁酯((5R)-1)合成(3R,5R)-2具有环境友好、条件温和、立体选择性高等技术优势。
在氧化还原过程中,辅酶高效循环十分重要[5-6],Ni等[7]利用 FabG(Bacillus sp.ECU0013)与葡萄糖脱氢酶(GDH)的共表达菌株选择性还原2-氧代-4-苯基丁酸乙酯合成(S)-4-苯基-2-羟基丁酸乙酯,发现最高底物浓度可达到620.0 g/L,e.e.值大于99%。共表达菌株自身含有高效的辅酶再生系统,可解决双菌耦联传质限制问题[8-10],且反应操作简便。基于本课题组前期的菌种选育工作[11],成功构建了羰基还原酶与葡萄糖脱氢酶共表达菌株E.coli BL21/pCDFDuet-gdh-cr-X,笔者将优化 E.coli BL21/pCDFDuet-gdh-cr-X全细胞不对称还原(5R)-1制备(3R,5R)-2,其反应过程见图1。

图1 共表达菌株E.coli BL21/pCDFDuet-gdh-cr-X不对称还原(5R)-1制备(3R,5R)-2Fig.1 Scheme for(3R,5R)-2 synthesis through asymmetric reduction of(5R)-1 with E.coli BL21/pCDFDuet-gdh-cr-X
1 材料与方法
1.1 菌株
E.coli BL21/pET28a-cr-X 与 E.coli BL21/pCDFDuet-gdh-cr-X由浙江工业大学生物工程研究所构建、保藏。
1.2 培养基组成
斜面培养基组成(g/L):蛋白胨10.0,酵母粉5.0,NaCl 10.0,琼脂 20.0。
LB培养基(g/L):胰蛋白胨10.0、酵母粉5.0、NaCl 10.0。E.coli BL21/pET28a-cr-X 培养基灭菌后加入 30 μg/mL 卡那霉素,E.coli BL21/pCDFDuet-gdh-cr-X培养基灭菌后加入终质量浓度50 μg/mL链霉素。
1.3 主要试剂
链霉素、卡那霉素、IPTG等试剂,购自TaKaRa公司;NADP+、NADPH,由百灵威公司提供;(3R,5R)-2,购自Toronto化学制品研究公司;(5R)-1(含量73.5%),由浙江新东港药业股份有限公司馈赠。胰蛋白胨和酵母粉,购自Oxoid公司;其余化学试剂均为国产分析纯。
1.4 培养方法
种子液制备:从斜面培养基中挑取1接种环的菌落接种于装有100 mL种子培养基的500 mL三角瓶中,置于旋转式摇床(37℃、180 r/min)培养10 h。
发酵培养:按体积分数5.0%的接种量接种于装有100 mL发酵培养基的500 mL三角瓶中,置于摇床(37℃、180 r/min)培养2 h后至OD600为0.8左右,加入IPTG诱导剂28℃诱导。
1.5 粗酶液制备及酶活测定
发酵液9000 r/min、4℃离心5 min收集菌体,生理盐水(质量分数0.85%)洗涤菌泥2次,利用100 mmol/L、pH 7.0 K2HPO4-KH2PO4缓冲液分散菌体,超声波破碎20 min(400 W,工作1 s,停顿1 s)。细胞破碎液4℃高速离心5 min,收集上清液用于羰基还原酶与葡萄糖脱氢酶酶活的测定。
在30℃、pH 7.0条件下,每分钟氧化1 μmol NADPH所需的酶量定义为1个羰基还原酶(CRX)酶活单位。相同条件下,每分钟生成 l μmol NADPH所需的酶量定义为1个葡萄糖脱氢酶(GDH)酶活单位。
1.6 E.coli BL21/pET28a-cr-X、E.coli BL21/pCDFDuet-gdh-cr-X全细胞催化制备(3R,5R)-2
发酵液9000 r/min、4℃离心5 min,收集菌体,菌泥采用生理盐水(0.85%)洗涤2次后用于生物催化反应。反应体系选择20.0 mL 100 mmol/L KH2PO4-K2HPO4缓冲液,葡萄糖与底物以质量比1∶1添加,菌体质量浓度 9.70 g/L,380 r/min转化,催化过程中保持pH恒定在7.0左右,定时取样。试样用无水乙醇稀释,离心,上清液采用高效液相色谱分析检测。
分别利用 E.coli BL21/pET28a-cr-X与 E.coli BL21/pCDFDuet-gdh-cr-X全细胞催化合成(3R,5R)-2,并考察生物催化剂采用E.coli BL21/pCDFDuet-gdh-cr-X全细胞时,葡萄糖浓度、pH、温度、底物浓度、NADP+、菌体浓度对(5R)-1转化率及产物(3R,5R)-2 d.e.值的影响。
1.7 分析方法
(5R)-1、(3R,5R)-2及其差向异构体采用岛津HPLC LC-20AD检测,色谱柱选择大连依利特Hypersil ODS2 C18柱(4.6 mm ×250 mm,2.5 μm),流动相为按体积比1∶3配制的乙腈水溶液,流速1.0 mL/min,进样量20 μL,检测波长 210 nm,柱温40℃。
产物(3R,5R)-2 d.e.值按式(1)计算。

式中:A(3R,5R)表示(3R,5R)-2 产物的峰面积;A(3S,5R)表示(3S,5R)-2 构型产物的峰面积。
底物转化率η按式(2)计算。
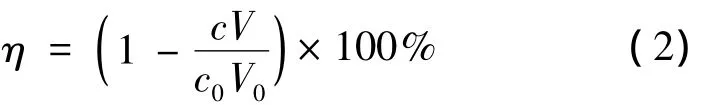
式中:c0表示起始底物(5R)-1浓度,mol/L;c表示反应后(5R)-1浓度,mol/L;V0表示初始反应液体积,L;V表示最终反应值体积,L。
2 结果与讨论
2.1 E.coli BL21/pET28a-cr-X 与 E.coli BL21/pCDFDuet-gdh-cr-X全细胞催化合成(3R,5R)-2
在30℃、pH 7.0条件下,E.coli BL21/pET28a-cr-X与 E.coli BL21/pCDFDuet-gdh-cr-X全细胞催化(5R)-1不对称还原结果见表1。由表1可知,共表达菌株E.coli BL21/pCDFDuet-gdh-cr-X催化效率显著高于单一的羰基还原酶菌株E.coli BL21/pET28a-cr-X,这与葡萄糖脱氢酶参与的辅酶再生密切相关。

表1 不同菌株对(5R)-1不对称还原的影响Table 1 Comparison of(5R)-1 asymmetric reduction efficiency between E.coli BL21/pET28a-cr-X and E.coli/pCDFDuet-gdh-cr-X
2.2 E.coli BL21/pCDFDuet-gdh-cr-X 表达条件的优化
2.2.1 生长曲线的测定
种子37℃下培养10 h后,按体积分数5%的接种量接入LB发酵培养基中,测定菌株的生长曲线,结果如图2所示。由图2可知:菌株经过2 h延迟期后进入对数生长期,培养7 h菌体OD600达到5.8左右。

图2 菌株生长曲线Fig.2 Growth curve for E.coli BL21/pCDFDuet-gdh-cr-X
2.2.2 诱导剂IPTG添加时间
在不同生长阶段分别加入终浓度为0.10 mmol/L的IPTG,28℃诱导10 h。诱导剂IPTG添加时间对酶活的影响见图3。由图3可知:在对数生长前期加入IPTG进行诱导,菌体酶活处于较高水平,因此选择在对数生长前期,接种后培养2 h(相应OD600约0.8),加入IPTG进行诱导。
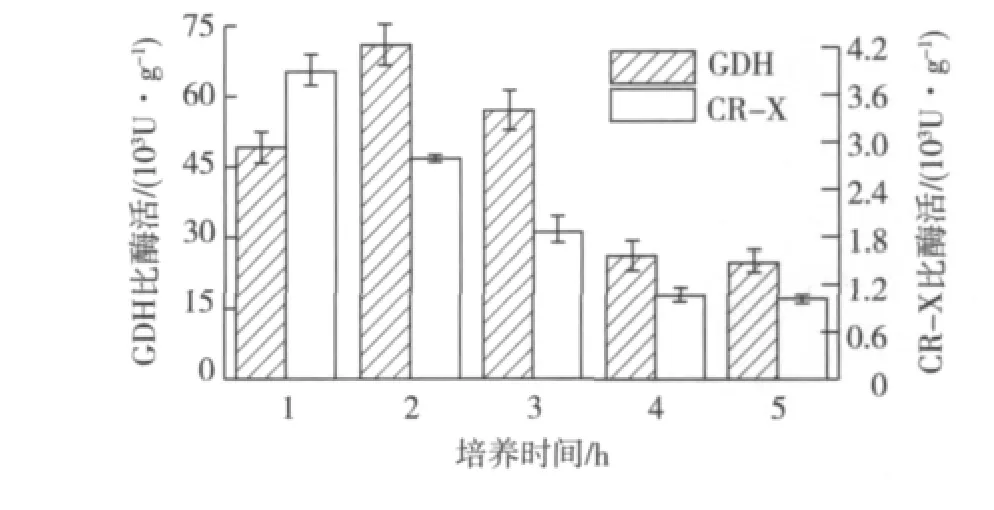
图3 IPTG添加时间对酶活的影响Fig.3 Effects of inducer adding time on CR-X and GDH activities
2.2.3 IPTG用量
重组菌发酵培养2 h,分别加入不同浓度IPTG,28℃诱导10 h。IPTG用量对酶活的影响见图4。由图4可知:IPTG的终浓度在0.30~0.70 mmol/L范围内时,酶活都保持较高水平。因此,确定最适的诱导剂量浓度为0.50 mmol/L。

图4 IPTG用量对酶活的影响Fig.4 Effects of IPTG concentration on CR-X and GDH activities
2.2.4 诱导时间
诱导时间对酶活的影响见图5。由图5可知:诱导7~13 h都具有很高的酶活,但随诱导时间延长,酶活反而降低,这可能是由于时间过长,蛋白质部分分解所致。因此,最佳诱导表达时间为13 h。

图5 IPTG诱导时间对酶活的影响Fig.5 Effects of induction time on CR-X and GDH activities
2.3 E.coli BL21/pCDFDuet-gdh-cr-X 催化(5R)-1不对称还原条件的优化
2.3.1 葡萄糖用量的影响
在50.0 g/L(5R)-1条件下,葡萄糖用量对底物转化的影响见图6。由图6可知:当葡萄糖与底物质量比不低于1∶1时,底物可以完全转化,且高底物浓度的葡萄糖对酶没有明显抑制作用。从经济角度考虑,选用葡萄糖与底物以质量比为1∶1添加。
2.3.2 pH的影响
在50.0 g/L(5R)-1条件下,反应pH对底物转化的影响见图7。由图7可知:在pH 6.0~7.5范围内,转化率大于99.0%,且它的光学选择性并不受pH的影响,d.e.值大于99.5%。当pH为7.0时,(5R)-1转化速度最快,因此,转化pH最终选择7.0。

图6 葡萄糖浓度对(5R)-1不对称还原的影响Fig.6 Effects of glucose concentration on(5R)-1 asymmetric reduction

图7 pH对(5R)-1不对称还原的影响Fig.7 Effects of pH values on(5R)-1 asymmetric reduction
2.3.3 反应温度的影响
在80.0 g/L(5R)-1条件下,反应温度对底物转化的影响见图8。由图8可知:温度不影响羰基还原酶的立体选择性,随着温度的升高,d.e.值始终大于99.5%,在温度为25和28℃时,80.0 g/L的底物可以完全转化,但25℃转化的速度过于缓慢。因此,反应温度选择28℃。
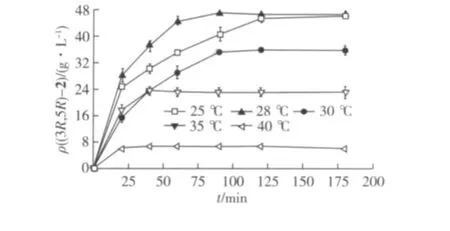
图8 反应温度对(5R)-1不对称还原的影响Fig.8 Effects of conversion temperature on(5R)-1 asymmetric reduction
2.3.4 底物浓度的影响
在菌体浓度9.70 g/L条件下,底物浓度对底物转化的影响见图9。由图9可知:底物质量浓度为80.0和100.0 g/L,反应2 h内,底物可以完全转化,当底物浓度达到120.0 g/L时,随着时间的延长,底物仍有少量残留。同时考察100.0 mg/L的NADP+对反应的影响,发现在静息细胞转化过程中,NADP+是否添加对反应速率的影响不大,这可能与外源性辅酶无法通过细胞膜进入细胞质有关[12-13]。
2.3.5 菌体用量的影响
菌体用量会很大程度影响催化的效率及转化率,在以上实验基础上,选用4.85、9.70、14.55 g/L的菌体浓度,用于不同底物浓度的转化研究,结果见表2。由表2可知:提高菌体的用量,能完全转化的底物浓度也相应地增加。4.85 g/L菌体能在2 h内完全催化80.0 g/L(5R)-1不对称还原,9.70 g/L菌体可以在2 h内完全转化100.0 g/L底物,产物(3R,5R)-2 d.e.值大于99.5%。

图9 底物浓度对(5R)-1不对称还原的影响Fig.9 Effects of substrate concentration on(5R)-1 asymmetric reduction
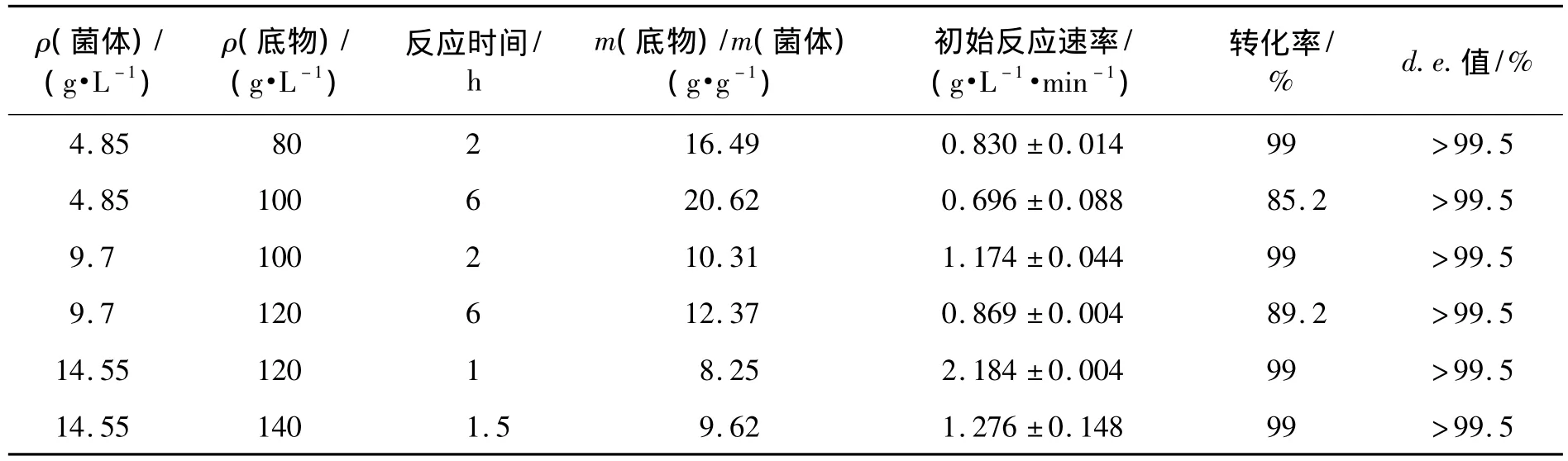
表2 菌体浓度、底物浓度对(5R)-1不对称还原的影响Table 2 Effects of E.coli/pCDFDuet-gdh-cr-X loading size and substrate concentration on(5R)-1 asymmetric reduction
3 结论
羰基还原酶、葡萄糖脱氢酶共表达菌株E.coli BL21/pCDFDuet-gdh-cr-X,能差向选择性还原(5R)-1 合成(3R,5R)-2。在28 ℃、pH 7.0、9.70 g/L菌体、葡萄糖与(5R)-1质量比1∶1的条件下,100.0 g/L(5R)-1在2 h内可完全被转化成(3R,5R)-2,产物d.e.值大于99.5%。与野生型Pichia guilliermondii CCTCC M 2011386 相比,E.coli BL21/pCDFDuet-gdh-cr-X表现出优越的活性和立体选择性,具有重要的工业应用前景。
[1]Pfefferkorn J A,Bowles D M,Kissel W,et al.Development of a practical synthesis of novel,pyrrole-based HMG-CoA reductase inhibitors[J].Tetrahedron,2007,63(34):8124-8134.
[2]Casar Z.Historic overview and recent advances in the synthesis of super-statins[J].Curr Org Chem,2010,14(8):816-845.
[3]Wolberg M,Villela M,Bode S,et al.Chemoenzymatic synthesis of the chiralside-chain ofstatins:application ofan alcohol dehydrogenase catalysed ketone reduction on a large scale[J].Bioprocess Biosyst Eng,2008,31(3):183-191.
[4]Scheffler J L,Bette V,Mortreux A,et al.Preparation and stereoselective hydrogenation of chiral (4-hydroxytetrafuranylidene)carboxylates:a new formal entry to functional anti-and syn-3,5-dihydroxyesters[J].Tetrahedron Lett,2002,43(15):2679-2682.
[5]Xu Z N,Jing K J,Liu Y,et al.High-level expression of recombinant glucose dehydrogenase and its application in NADPH regeneration[J].J Ind Microbiol Biotechnol,2007,34(1):83-90.
[6]Yang W,Xu J H,Pan J,et al.Efficient reduction of aromatic ketones with NADPH regeneration by using crude enzyme from Rhodotorula cells and mannitol as cosubstrate[J].Biochem Eng J,2008,42(1):1-5.
[7]Ni Y,Li C X,Zhang J,et al.Efficient reduction of ethyl 2-oxo-4-phenylbutyrate at 620 g/L by a bacterial reductase with broad substratespectrum[J].Adv Synth Catal,2011,353(8):1213-1217.
[8]Ni Y,Li C X,Wang L J,et al.Highly stereoselective reduction of prochiral ketones by a bacterial reductase coupled with cofactor regeneration[J].Org Biomol Chem,2011,9(15):5463-5468.
[9]Bräutigama S,Dennewalda D,Schürmannb M,et al.Whole-cell biocatalysis:evaluation of new hydrophobic ionic liquids for efficient asymmetric reduction of prochiral ketones[J].Enzyme Microb Technol,2009,45(4):310-316.
[10]Kratzer R,Pukl M,Egger S,et al.Whole-cell bioreduction ofaromatic α-keto esters using Candida tenuis xylose reductase and Candida boidinii formate dehydrogenase co-expressed in Escherichia coli[J].Microbial Cell Fact,2008,7:1-12.
[11]毛芳芳,王亚军,罗希,等.具有非对映选择性还原6-氰基-(5R)-羟基-3-羰基己酸叔丁酯活性的微生物菌株筛选与鉴定[J].化学与生物工程,2012,29(7):12-16.
[12]Zhang J, Witholt B,Li Z.Coupling of permeabilized microorganisms for efficient enantioselective reduction of ketone with cofactor recycling[J].Chem Commun,2006,4:398-400.
[13]Zhang J,WitholtB,LiZ.EfficientNADPH recyclingin enantioselective bioreduction of a ketone with permeabilized cells of a microorganism containing a ketoreductase and a glucose 6-phosphate dehydrogenase[J].Adv Synth Catal,2006,348(4/5):429-433.
