酰基供体结构对褶皱念珠菌脂肪酶(CRL)催化芳香仲醇动力学拆分立体选择性的影响
2013-10-25戴晓庭陈永军吴坚平杨立荣
戴晓庭,徐 刚,陈永军,吴坚平,杨立荣
(浙江大学 化学工程与生物工程系,杭州 310027)
手性仲醇是合成医药、农药化学品、生活用品、信息素和高质量液晶等不可缺少的中间体,也是不对称合成中的重要手性辅剂[1]。获得这些光学纯化合物的主要方法有不对称合成法、化学拆分法、酶拆分法以及色谱拆分法等。其中酶法动力学拆分(kinetic resolution,KR)因其高效、反应条件温和、对环境友好等优点深受人们的青睐,成为近年来的研究热点[2-7]。在以往的酶催化动力学拆分的研究中,所使用的酰基供体只有确定的几种[8],而针对供体改变对动力学拆分影响的报道则未作系统的研究。
研究发现,共价催化是脂肪酶催化手性仲醇实现选择性转酯化反应的典型机制[9-10]。共价催化的最一般形式是催化剂的亲核基团对底物中亲电性的碳原子相互作用。在酶催化的转酯化反应过程中则表现为(图1):脂肪酶活性中心的具有亲核性的氨基酸残基(a 1)与酰基供体中的酰基部分反应,通过氢键作用,形成不稳定的四面体过渡态结构(a 2),当四面体中间体结构中离去一个醇分子后,就形成了带有亲核基团的酰基衍生物(a 3);接着,这种酶的酰基衍生物作为一个共价中间物与被拆分的外消旋体醇起作用;酰基从亲核的催化剂上转移到最终的酰基受体即外消旋体醇的特定的一个异构体上(a 4)。
在共价中间体(a 3)形成的过程中,脂肪酶与酰基供体相互作用,构象双双发生变化,形成了特定的空间结构。这样,只有与之契合的某一构型的底物才能被催化发生酯化反应,从而达到动力学拆分的效果。
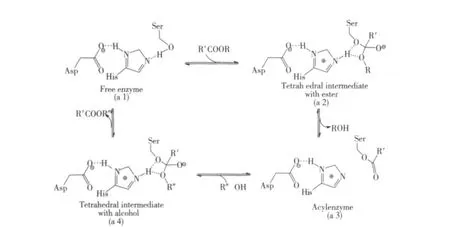
图1 酶催化转酯化反应机制Fig.1 Reaction mechanism of serine hydrolase catalyzed esterification
由图1的机制模型可以看出,在KR过程中,酰基供体对酶的催化选择性具有极大的影响,而供体中酰基部分所起的作用尤为重要,酰基供体中R'的结构将影响共价中间体(a 3)的结空间构象,从而影响到酶的催化选择性,这也是本研究的切入点。
在以往的KR研究过程中,乙酸乙烯酯、乙酸异丙烯酯以及对氯苯酚乙酸酯是最为常见的酶拆分酰基供体[8]。相对于乙酸乙烯酯和乙酸异丙烯酯来说,对氯苯酚乙酸酯在仲醇的酶拆分过程中,表现出更快的反应速率和更好的底物适用性[8]。所以,在本研究过程中,选择对氯苯酚的各种酯作为供体,研究供体酰基改变对酶催化动力学拆分选择性的影响。
1 实验部分
1.1 CRL催化仲醇的KR反应
反应在10 mL的封闭三角瓶中进行。典型反应条件:2 mL溶剂(分析纯,分子筛脱水后使用),100 mmol/L仲醇(购自百灵威化学技术有限公司),300 mmol/L酰基供体,30 mg/mL脂肪酶CRL(Candida rugosa lipase),40℃,转速200 r/min。间隔取样分析。
1.2 放大的1-苯乙醇的KR反应
反应在100 mL的封闭三角瓶中进行。操作条件:3.05 g 1-苯乙醇(购自百灵威化学技术有限公司),2.39 g正戊酸对氯苯酚酯,0.5 g脂肪酶CRL,甲苯定容至80 mL,将反应体系置于40℃、转速200 r/min的摇床中。间隔2 h取样分析,待酰基供体反应完全后,终止反应。过滤、浓缩后,采用正己烷与乙酸乙酯(体积比为10∶1)的展开剂进行柱层析纯化,最终可以得到纯的单一构型的产物。
1.3 分析条件
采用Fuli 9790型气相色谱(温岭福立分析仪器有限公司)分析试样中各组分含量,10%甲基β-环糊精手性柱。色谱条件:汽化温度230℃,检测温度230℃,柱温80℃,载气N2流速为45 mL/min。
底物对映体过量值e.e.S=(cSS- cSR)/(cSR+cSS)×100%,产物的对映体过量值 e.e.p=(cPR-cPS)/(cPR+cPS)×100%,转化率根据底物的减少计算而得。式中cSS、cSR、cPR和 cPS分别为 S醇、R醇、R酯和S酯的含量。
2 结果与讨论
2.1 CRL催化1-苯乙醇在不同供体下的KR反应
将对氯苯酚确定为酰基供体中醇的部分,并针对供体的酰基部分进行规律性的扩展,制备了一系列具有不同碳原子数侧链的酰基供体,并将它们用于1-苯乙醇的动力学拆分过程,结果见表1。

表1 不同供体下1-苯乙醇的KR反应Table 1 KR of 1-phenylethanol with different acyl donors
由表1可知:供体中酰基部分的结构改变对酶催化动力学拆分选择性具有极大的影响。当酰基供体醇的部分不变时,随着酰基部碳原分子数的增加,产物的e.e.p值在不断提高。当选择对氯苯酚丁酸酯作为供体,反应6 h后,底物转化率达到53.2%,产物的e.e.p值只有 87.1%,而选择对氯苯酚戊酸酯作为供体,底物转化率达到50%,产物的 e.e.p值接近100%。如果酰基侧链的碳原子数继续增加,产物e.e.p值也会近于100%。因此可以得知,酰基部分的结构变复杂会使得动力学拆分过程的选择性更高,出现这种现象的原因是复杂的酰基结构会让共价中间物的空间结构更具特异性,对与之契合的底物空间构象要求更严格,从而提高了动力学拆分的选择性。
2.2 CRL催化的1-苯乙醇衍生物的KR反应
长链有机酸的对氯苯酚酯在1-苯乙醇的KR过程中,表现出了优异的性能。为考察这类供体的底物适用性,选择对氯苯酚戊酸酯作为模型供体与不同的仲醇进行反应,结果见表2。
由表2可知,对氯苯酚戊酸酯可以很好的应用于各种仲醇的KR过程。使用对氯苯酚戊酸酯为供体时,能使各种仲醇在50%转化率的情况下,e.e.p值保持近于100%。由表2还可以得知,底物结构同样会对KR过程产生影响。这主要体现在两个方面:一是电子效应,相同位置上的取代基,缺电子取代基的电子效应会减慢KR的反应速率,而且取代基的吸电子能力越强,反应速率受到的影响也就越大。二是位阻效应,在对氯苯酚戊酸酯为供体的动力学拆分过程中,虽然位阻增大,e.e.p值没有明显的变化,但是反应速率却受到比较明显的影响。

?

?
2.3 放大的1-苯乙醇的KR反应结果
当转化率达到43%,停止反应,减压蒸馏后经硅胶层析处理,得到R-1-苯乙醇正戊酸酯1.95 g。经最终检测发现,所得产物为单一构型,测其旋光为=69.1(c 1.00,CH2Cl2)。在此反应中,加入的酰基供体与底物的摩尔比约为0.45∶1,这是因为要保证反应在结束以后,整个体系中没有酰基供体的残余,否则酰基供体会与产物在纯化时,难以分离。
3 结论
通过研究酶催化转酯化反应的机制,明确了酰基供体结构对仲醇动力学拆分选择性的影响,同时参考以前研究中所使用的几种供体,选择对氯苯酚的有机酸酯作为拆分过程中所使用的供体。在此基础上,通过改变供体酰基部分的侧链结构,从而发现对氯苯酚有机酸酯供体中酰基部分碳原子数变化对1-苯乙醇动力学拆分结果有着极大的影响,随着侧链碳原子数增加,产物的e.e.p值会不断地提高。当供体侧链碳原子数大于或等于5时,1-苯乙醇转化率达到50%时,产物的e.e.p值仍能保持近于100%。将对氯苯酚戊酸酯作为供体用于其他仲醇的KR时,也取得了相同的效果,实现了这些仲醇的高效拆分,保证了50%的转化率以及100%的产物e.e.p值。这为使用长链有机酸酯作为供体为提高仲醇动力学拆分的效率提供了一条新思路。
[1]李玉新.动力学拆分:制备光学活性化合物的重要方法[J].新农药,2002(1):11-16.
[2]王雷,薛屏.动态动力学拆分制备手性化合物的研究进展[J].应用化工,2010,39(2):258-263.
[3]马红敏,邵瑞链.动力学拆分法的研究进展[J].有机化学,2000,20(4):454-463.
[4]Fogassy E,Nógrádi M,Kozma D,et al.Optical resolution methods[J].Org Biomol Chem,2006,4(16):3011-3030.
[5]Vedejs E,Jure M.Efficiency in nonenzymatic kinetic resolution[J].Angew Chem Int Ed,2005,44(26):3974-4001.
[6]Breuer M,Ditrich K,Habicher T,et al.Industrial methods for the production of optically active intermediates[J].Angew Chem Int Ed,2004,43(7):788-824.
[7]Robinson D E J E,Bull S D.Kinetic resolution strategies using non-enzymatic catalysts[J].Tetrahedron:Asymmetry,2003,14(11):1407-1446.
[8]Lee J H,Han K,Kim M J,et al.Chemoenzymatic dynamic kinetic resolution of alcohols and amines[J].Eur J Org Chem,2010,6:999-1015.
[9]Raza S,Fransson L,Hult K.Enantioselectivity in Candida antarctica lipase B:a molecular dynamics study[J].Protein Sci,2008,10(2):329-338.
[10]Haeffner F,Norin T,HultK.Molecularmodeling of the enzntioselectivity in lipase-catalyzed transesterification reactions[J].Biophys J,1998,74(3):1251-1262.
