抑制葡糖脑苷脂酶对多巴胺神经细胞内α-突触核蛋白寡聚体形成及细胞自噬功能的影响
2013-10-25刘光伟李尧华
刘光伟 尹 娜 弥 娜 李 昕 李尧华 于 顺*
(1.首都医科大学宣武医院神经生物学研究室,教育部神经变性病重点实验室,北京100053;2.北京市老年病医疗研究中心分子诊断实验室,北京100053)
α-突触核蛋白(α-synuclein,α-Syn)是由 140 个氨基酸组成的酸性蛋白质,其纤维化过程中形成的可溶性寡聚体中间体被认为在帕金森病(Parkinson’s disease,PD)的发病中起着重要作用[1]。然而,导致 α-Syn寡聚体在神经元内积聚的机制仍不十分清楚。近年来的研究表明,α-Syn寡聚体的形成及其在神经元内的积聚与其降解通路发生障碍有关。α-Syn的降解主要通过伴侣分子介导的自噬(chaperone mediated autophagy,CMA)进行[2],而 CMA 对 α-Syn 的降解需要葡糖脑苷脂酶(glucocerebrosidase,GBA)的正常活性[3-4]。GBA的基因突变不仅可以促进溶酶体贮存障碍的疾病——戈谢病(Gaucher’s disease)发生,而且其某些突变(N370S、L444P)可以引起PD以及明显的路易体病变[5-6]。另有证据表明,GBA 突变携带者脑组织中的a-Syn寡聚体含量增加,而PD患者脑组织中的GBA活性和表达均降低[7-9]。这些研究结果提示GBA和α-Syn可能存在某种相互作用。笔者推测,GBA的活性下降很可能是导致神经元内α-Syn寡聚体增加并进一步引起细胞自噬异常的原因,后者可以促进细胞凋亡[10]。
在本研究中,笔者将利用MES23.5多巴胺神经细胞作为研究对象,观察抑制GBA活性后细胞内α-Syn寡聚体含量的变化及其对自噬活性、氧化应激以及细胞凋亡的影响。
1 材料和方法
1.1 材料
MES23.5多巴胺能神经细胞由美国休斯敦Baylor医学院乐卫东教授惠赠。DMEM/F12培养基购自GIBCO Invitrogen公司;胎牛血清购自Berlin公司;重组人α-Syn 蛋白由本室制备[11];环己烯四醇-β-环氧化物(conduritol-β-epoxide,CβE)购自 Calbiochem 公司;GBA活性检测试剂盒购自BioAssay Systems公司;Cyto-ID○R自噬检测试剂盒购自Enzo Life Sciences公司;超氧化物阴离子荧光探针(DHE)购自碧云天生物技术研究所;丫靛橙和碘化丙啶购自Sigma-Aldrich公司。
1.2 方法
1.2.1 MES23.5细胞培养
MES23.5多巴胺能神经细胞接种于铺有多聚-L-赖氨酸的25 cm2培养瓶中,在含有5% 胎牛血清和Sato’s添加液的DMEM/F12培养基中培养[11]。待细胞增生到适当密度后,根据不同实验的需要,接种于铺有多聚-L-赖氨酸的24孔板或35 mm2培养皿中。
1.2.2 培养细胞总蛋白的提取
细胞培养结束后弃培养基,用0.01 mol/L PBS洗3次。收集细胞,4℃、10 000 r/min离心3 min。弃上清,用预冷的0.01 mol/L PBS清洗沉淀,4℃、10 000 r/min离心3 min。弃上清,向细胞沉淀中加入200 μL细胞提取液(50 mmol/L Tris-HCl pH 7.4,150 mmol/L NaCl,2%TritonX-100,1 mmol/L PMSF,2 mmol/L EDTA),混匀后冰上放置40 min。4℃、10 000 r/min离心15 min。将上清转移至一个新的离心管中,-20℃储存备用。
1.2.3 GBA活性的测定
按照GBA酶活性检测试剂盒要求的方法操作。准备一个96孔板,根据实验需要准备相应体积的工作液:200 μL检测缓冲液+8 μL底物液/孔。在96孔板中分别加入超纯水、校准液、样品和准备好的工作液,使用酶标仪测定405 nm处反应前(0 min)的吸光度值。50℃水浴30 min后再次测定405 nm处吸光度值。GBA酶活性=〔(OA 30 min-OA 0 min)/(OA标准液-OA 水)〕×250(U/L)。
1.2.4 细胞内α-Syn寡聚体的检测
依据参考文献[12]所述原理,利用特殊的ELISA方法检测α-Syn寡聚体。首先,用3D5小鼠抗人α-Syn单克隆抗体[13](1 μg/mL)包被酶标板,4 ℃ 过夜。然后用2%牛血清白蛋白封闭,37℃孵育2 h,加入事先制备好的不同质量浓度α-Syn寡聚体及待检测样品,100 μL/孔,于37℃孵育2 h。加入生物素化3D5抗体稀释至1 μg/mL,37℃孵育2 h。加入碱性磷酸酶标记的亲和素抗体(1/20 000),37℃孵育1 h。以上每次反应结束后用PBST洗4次,每次5 min。最后加入对硝基酚磷酸显色液(pNpp),37℃孵育30 min。测定405 nm处吸光度值。
1.2.5 细胞自噬活性的测试
提前20 min从冰箱中取出试剂盒,平衡至室温。按说明配制洗涤液(1×assay buffer)和检测工作液(每1 mL 完全培养基加 2 μL Cyto-ID○R和 1 μL Hoechst 33342 Nuclear Stain)。操作步骤按照 Cyto-ID○R自噬检测试剂盒说明书进行。激光共聚焦显微镜观察结果。
1.2.6 细胞内活性氧(reactive oxygen species,ROS)含量的测试
将DHE溶解于DMSO,配制成适当质量浓度的母液,将其直接添加至细胞培养基中,浓度为10 μmol/L,37℃避光孵育30 min进行荧光探针装载,随后用PBS洗涤3次。在荧光显微镜下(放大200倍)观察结果。每孔随机取3个无重叠视野拍照,观察荧光强度。试验重复3次。
1.2.7 凋亡细胞的检测
应用AO/PI染色法检测凋亡细胞。细胞用96孔板培养。实验结束后,吸弃各孔培养基,用PBS洗净细胞,加入50 μL AO染料,37℃温孵10 min后,再加入50 μL PI染料,继续温孵10 min。每次反应结束后用PBS冲洗3次。在荧光显微镜下(放大200倍)观察结果。每孔随机取至少3个无重叠视野拍照计数。试验重复3次。
1.3 统计学方法
使用SPSS 18.0进行统计分析。计量数据用均数±标准误(ˉx±SE)表示,细胞内活性氧含量的测试以及凋亡细胞的检测使用析因方差分析法进行假设检验,其余数据使用单因素方差(ANOVA)分析法进行组间比较。以P<0.05为差异有统计学意义。
2 结果
2.1 抑制GBA活性对细胞内α-Syn寡聚体形成的影响
首先测试了不同质量浓度(12.5、25.0、50.0和100.0 μmol/L)的 GBA 活性抑制剂——CβE 对 GBA活性的影响。用CβE处理MES23.5细胞48 h后测定GBA活性。结果显示,GBA活性随着CβE质量浓度的增加而下降(图1)。在另一组细胞,观察了CβE对α-Syn寡聚体形成的影响。细胞首先用不同浓度的CβE处理48 h后,然后将 α-Syn单体(1 μmol/L)添加到培养基中继续培养48 h使其进入细胞。然后提取细胞总蛋白,利用ELISA方法检测α-Syn寡聚体的含量。结果显示,12.5 μmol/L的 CβE可以引起细胞内的α-Syn寡聚体显著增加,随着 CβE浓度的加大,α-Syn寡聚体的含量也进一步增多(图2)。

图1 CβE抑制细胞GBA活性Fig.1 CβE Inhibits GBA activity
2.2 抑制GBA活性对细胞自噬活性的影响

图2 抑制GBA活性增加细胞内α-Syn寡聚体含量Fig.2 Inhibition of GBA activity increases the amount of α-Syn oligomers in cells
将细胞分为两组,一组用CβE(100μmol/L)处理48 h后细胞外添加不同浓度(0、1、10 μmol/L)的 α-Syn单体,另一组不用CβE处理,仅在细胞外添加不同质量浓度α-Syn单体。48 h后测定自噬活性。在无 α-Syn 处理细胞,未见自噬活性改变,1 μmol/L α-Syn引起个别细胞出现自噬体,而增加α-Syn至10 μmol/L可以使自噬体数量有所增加。CβE本身可以诱导自噬体的出现,在存在α-Syn的情况下,其诱导的自噬体的数量进一步增多。与没有CβE处理的细胞相比较,CβE处理细胞的自噬体的数量明显增多(图3)。
2.3 抑制GBA活性对细胞氧化应激和凋亡的影响
细胞分组和处理方法同上。细胞内氧化应激水平通过使用DHE活性氧探针检测(图4)。结果显示,在无CβE处理组细胞,随着添加的α-Syn量的增多,氧化应激水平增高,但只有当α-Syn浓度达到10 μmol/L时,氧化应激水平变化才具有统计学意义(P<0.05)。在CβE处理细胞,氧化应激水平也随着α-Syn浓度加大而逐渐加大,但其变化幅度明显大于无CβE处理细胞,具有统计学意义(P<0.01)。
AO/PI染色结果显示,在不做任何处理的正常细胞,所有细胞被染成绿色,没有红染的细胞出现,提示没有产生凋亡细胞。在单纯α-Syn(1 μmol/L和)处理细胞,虽然大多数呈绿色,但可见部分细胞被染成红色,红染的细胞在10 μmol/L α-Syn处理组明显多于1 μmol/L处理组。在单纯CβE处理组也未见明显的呈红染的凋亡细胞,而在CβE和α-Syn双重处理的细胞,红染的凋亡细胞明显增多,其数量在10 μmol/L α-Syn处理组明显多于1 μmol/L处理组(图5)。
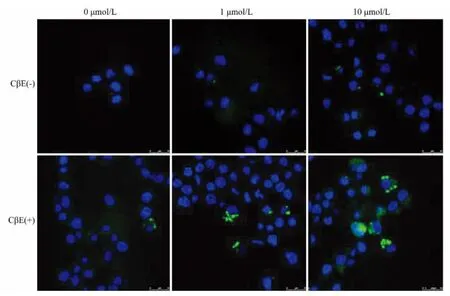
图3 抑制GBA活性对细胞巨自噬活性的影响Fig.3 Effect of GBA activity inhibition on macroautophagic activity

图4 抑制GBA活性对细胞内氧化应激水平的影响Fig.4 Effect of GBA activity inhibition on ROS levels
3 讨论
本研究利用培养MES23.5多巴胺神经细胞研究了抑制GBA活性对细胞内α-Syn寡聚体形成的影响。鉴于MES23.5多巴胺神经细胞是由小鼠神经母细胞瘤和大鼠中脑多巴胺神经细胞杂交而成,表达极少量的鼠源性α-Syn,笔者将重组人α-Syn加入到培养基,利用该蛋白能够迅速以被动扩散方式进入细胞并不被蛋白降解系统分解的特性,使其进入细胞[14]。与基因转染方法相比较,这种方法可以控制细胞内α-Syn的含量,有助于观察在细胞内α-Syn含量不同的情况下,抑制GBA活性对α-Syn寡聚体形成的影响。利用这个细胞模型,笔者首先观察了GBA活性抑制剂CβE对α-Syn寡聚体形成的影响。结果表明,CβE引起浓度依赖的GBA活性下降和细胞内的α-Syn寡聚体增多。这一结果提示,GBA活性下降是细胞内α-Syn寡聚体增多的原因。

图5 抑制GBA活性对细胞凋亡率的影响Fig.5 Effect of GBA activity inhibition on apoptotic rates
已知,细胞内的自噬系统包括微自噬(microautophagy)、巨自噬(macroautophagy)和伴侣分子介导的自噬(CMA)[15]。正常情况下,α-Syn 通过伴侣分子介导的自噬(CMA)降解。抑制GBA活性将削弱伴侣分子介导的自噬(CMA)介导的α-Syn降解,并导致α-Syn寡聚体增加,而聚集的α-Syn寡聚体不能有效地通过伴侣分子介导的自噬(CMA)降解[16]。然而,巨自噬在清除细胞内的 α-Syn寡聚体中发挥重要作用[17]。因此,笔者进一步观察了在GBA活性被抑制的情况下,自噬活性的变化。笔者用100 μmol/L CβE抑制GBA活性。这一浓度的CβE可以使GBA活性下降60%,与GBA突变引起的PD患者黑质GBA活性的下降程度相当[18]。笔者发现,在单纯用α-Syn处理细胞时,细胞内几乎不出现自噬体,而在GBA活性被抑制的情况下用α-Syn处理细胞时,则很多细胞内出现自噬体,并且自噬体的数量随α-Syn浓度的增加而增加。产生这种现象的原因很可能是正常情况下α-Syn在进入细胞后能够迅速而有效地被CMA或泛素-蛋白酶体途径降解,而在GBA活性受抑制时,由于细胞内α-Syn寡聚体含量的增加激活了细胞的巨自噬系统。α-Syn寡聚体含量增加激活巨自噬的机制之一很可能是其引起细胞内的活性氧增加。以往的研究表明,α-Syn寡聚体可以增加细胞内的活性氧,后者被证明对巨自噬具有刺激作用。作为这一推测的证据,笔者发现在用α-Syn和CβE同时处理细胞时细胞内的活性氧增加。
尽管巨噬活性的代偿性增强有助于α-Syn寡聚体的清除,但过度的巨噬活性增强也将对细胞产生破坏作用,引起自噬性细胞死亡(autophagic cell death)。因此,导致α-Syn和CβE处理细胞凋亡的机制之一很可能与过度的巨自噬活性增强有关。本研究结果对揭示自噬功能改变引起PD神经退变的机制具有重要意义。
[1]Danzer K M,McLean P J.Drug targets from genetics:αsynuclein[J].CNS Neurol Disord Drug Targets,2011,10(6):712-723.
[2]Li B,Zhang Y,Yuan Y,et al.A new perspective in Parkinson's disease,chaperone-mediated autophagy[J].Parkinsonism Relat Disord,2011,17(4):231-235.
[3]Cookson M R.A feedforward loop links Gaucher and Parkinson's diseases?[J].Cell,2011,146(1):9-11.
[4]Xilouri M,Vogiatzi T,Vekrellis K,et al.alpha-synuclein degradation by autophagic pathways:a potential key to Parkinson's disease pathogenesis[J].Autophagy,2008,4(7):917-919.
[5]Sidransky E,Lopez G.The link between the GBA gene and parkinsonism[J].Lancet Neurol,2012,11(11):986-998.
[6]Kong B,Yang T,Gu J W,et al.The association between lysosomal protein glucocerebrosidase and Parkinson's disease[J].Eur Rev Med Pharmacol Sci,2013,17(2):143-151.
[7]Choi J H,Stubblefield B,Cookson M R,et al.Aggregation of α-synuclein in brain samples from subjects with glucocerebrosidase mutations[J].Mol Genet Metab,2011,104(1-2):185-188.
[8]Gegg M E,Burke D,Heales S J,et al.Glucocerebrosidase deficiency in substantia nigra of parkinson disease brains[J].Ann Neurol,2012,72(3):455-463.
[9]Goker-Alpan O,Stubblefield B K,Giasson B I,et al.Glucocerebrosidase is present in α-synuclein inclusions in Lewy body disorders[J].Acta Neuropathol,2010,120(5):641-649.
[10]Mak S K,McCormack A L,Manning-Bog A B,et al.Lysosomal degradation of alpha-synuclein in vivo[J].J Biol Chem,2010,285(18):13621-13629.
[11]殷娟娟,韩俊燕,李昕,等.α-突触核蛋白功能片段向多巴胺能神经细胞内的转运及其对细胞增殖的影响[J].首都医科大学学报,2007,28(3):346-349.
[12]Park M J,Cheon S M,Bae H R,et al.Elevated levels of α-synuclein oligomer in the cerebrospinal fluid of drug-naïve patients with Parkinson's disease[J].J Clin Neurol,2011,(4):215-222.
[13]Yu S,Li X,Liu G,et al.Extensive nuclear localization of alpha-synuclein in normal rat brain neurons revealed by a novel monoclonal antibody[J].Neuroscience,2007,145(2):539-555.
[14]Liu G,Wang P,Li X,et al.Alpha-synuclein promotes early neurite outgrowth in cultured primary neurons[J].J Neural Transm,2013,120(9):1331-1343.
[15]Dice J F.Chaperone-mediated autophagy[J].Autophagy,2007,3(4):295-299.
[16]Xilouri M,Brekk O R,Stefanis L.Alpha-synuclein and protein degradation systems:a reciprocal relationship[J].Mol Neurobiol,2013,47(2):537-551.
[17]Yu W H,Dorado B,Figueroa H Y,et al.Metabolic activity determines efficacy of macroautophagic clearance of pathological oligomeric alpha-synuclein[J].Am J Pathol,2009,175(2):736-747.
[18]Gegg M E,Burke D,Heales S J,et al.Glucocerebrosidase deficiency in substantia nigra of parkinson disease brains[J].Ann Neurol,2012,72(3):455-463.
