三角叶黄连内生真菌产物红色色素的稳定性研究
2013-10-25谭友莉马云桐严铸云
谭友莉,马云桐,严铸云,马 庆
成都中医药大学药学院四川省中药资源系统研究与开发利用省部共建国家重点实验室培育基地,成都 611137
天然色素大多具有一定的营养与保健作用,所以在一些西方发达国家天然色素备受青睐,如玉米黄、高粱红等已经普遍使用。课题组前期从三角叶黄连内生真菌中筛选获得一株可产天然红色色素的菌株,该菌株通过固体发酵、提取、分离后得到红色色素。经初步研究证明其具有一定的开发与利用价值。但天然色素存在的显著问题是稳定性差[1-3],着色力不好[4]。而稳定性的好坏直接影响着色物质的色泽和品质[5]。为此本实验开展对此红色素稳定性的研究,为进一步开发利用该红色素提供一定的理论指导。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 材料
来源于毛茛科植物三角叶黄连(Coptis deltoidea C.Y.Cheng et Hsial)中分得的内生真菌,经显微鉴定为半知菌类(Fungi Imperfecti)的无孢菌群(Mycelia Sterilia)[6],并用该菌株采用固体发酵所得菌丝产物,经提取、分离后获得的红色色素作为实验材料。
1.1.2 试剂
CaCl2、A1C13、ZnSO4、FeC13、MgC12、Na2SO4、K2SO4、H2O2、NaOH、Na2SO3;二氯甲烷、柠檬酸、苹果酸、抗坏血酸、山梨酸钾、葡萄糖、明胶、苯甲酸钠、食盐等均为分析纯或食品级(以上化学试剂均购自成都科龙化工试剂厂);维生素A、维生素B、维生素D、维生素E(购自成都锦华药业有限责任公司)。
1.1.3 仪器与设备
JA1003电子天平(上海舜宇恒平科学仪器有限公司);MCD-B161F干燥箱(上海森信实验仪器有限公司);HP8453紫外/可见分光光度计(美国惠普公司);HH-S24数显恒温水浴锅(成都雅荣实验仪器有限公司);KQ-5200E型数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 实验方法
1.2.1 样品处理
称取适量红色素样品和石英砂按1∶5(m/m)的比例置研钵中研磨成粉末。将粉末置于圆底烧瓶中,加入10倍量的二氯甲烷溶液,摇匀后在40℃超声1 h后取出离心,上清液即为红色素提取液。
1.2.2 光谱扫描
取上述样品溶液,置于HP8453紫外/可见分光光度计下,在200~800 nm范围内进行光谱扫描,检测最大吸收峰,测得结果为515 nm,将其作为测定波长。
1.2.3 温度对红色素稳定性的影响
分别取样品溶液 10 mL,置于 40、50、60、70 ℃(沸腾温度)水浴锅中恒温处理1~5 h,每隔1 h取出部分样品,避光静置0.5 h,测定其在515 nm处的吸光度值,并计算色素残存率,并分析不同温度条件对红色素稳定性的影响。
1.2.4 光照对红色素稳定性的影响
分别取样品溶液10 mL,置于暗室、室内散射光、室外日光及紫外光下,每隔5 h测定其在最大吸收波长515 nm处的吸光度值并计算残存率,分析不同光照条件对红色素稳定性的影响。
1.2.5 金属离子对红色素稳定性的影响
分别取等量制备样品,滴加0.01、0.05、0.1 mmol/L 的 CaCl2、A1C13、ZnSO4、FeC13、MgC12、Na2SO4、K2SO4后,并超声30 min使其充分溶解,并与空白组对照,观察红色素溶液颜色变化,在室温下静置24 h后测定其在515 nm处的吸光度值,并计算色素残存率。
1.2.6 氧化剂对红色素稳定性的影响
将过氧化氢(H2O2)溶液分别配成浓度为0.5%、1.5%和3%的红色素溶液,以不加H2O2为对照组(0%)。并于2、4、8 h测定其在515 nm处的吸光度值,计算色素残存率并分析不同浓度下氧化剂对样品红色素稳定性的影响。
1.2.7 还原剂对红色素稳定性的影响
将抗坏血酸和亚硫酸钠(Na2SO3)分别配成浓度为0%、0.02%、0.06%和0.10%的红色素溶液,置于暗室中放置,并于2、4、8 h测定其在515 nm处的吸光度值,计算色素残存率并分析不同还原剂对样品红色素稳定性的影响。
1.2.8 酸度调节剂对红色素稳定性的影响
将柠檬酸、氢氧化钠、苹果酸和柠檬酸钠分别配成浓度均为2%的红色素溶液,以纯的红色素提取液为对照。置于室内暗处放置,每隔5 h测定其在515 nm处的吸光度值,计算色素残存率并分析不同酸度调节剂对样品红色素稳定性的影响。
1.2.9 维生素对红色素稳定性的影响
将VA、VB、VD和VE分别配成浓度均为0.1%的红色素溶液,作定性考察,以纯的红色素提取液为对照。置于室内暗处放置,每隔5 h测定其在515 nm处的吸光度值,分析不同维生素试剂对样品红色素稳定性的影响。
1.2.10 常用食品添加剂对红色素稳定性的影响
分别将葡萄糖、氯化钠、明胶和苯甲酸钠配成浓度均为3%的红色素溶液,作定性考察。另将苯甲酸钠分别配成浓度为0.1%、0.5%、1.0%、1.5%、2.0%的红色素溶液,观察不同浓度苯甲酸钠对红色素的影响,以纯的红色素提取液为对照。置于室内暗处放置,每隔5 h测定其在515 nm处的吸光度值,分析不同食品添加剂对样品红色素稳定性的影响。
1.2.11 防腐剂山梨酸钾对红色素稳定性的影响
将山梨酸钾分别配成浓度为0.01%、0.05%、0.1%、0.15%、0.2%的红色素溶液,以纯的红色素提取液为对照,置于室内暗处放置,每隔5 h测定其在515 nm处的吸光度值,计算色素残存率并分析不同防腐剂对样品红色素稳定性的影响。
2 结果与分析
2.1 温度对色素稳定性的影响
当温度在40℃~70℃条件下的红色素吸光值变化如图1所示。由图1可知该红色色素在不同水浴温度条件下的有效含量相差不大,并且随着水浴时间的延长其含量依然稳定,吸光度无明显变化,表明该红色素的耐热性较好。


图3 紫外线对红色素稳定性的影响Fig.3 Effect of Ultrariolet rays on the stability of the red pigment
2.2 光照对红色素稳定性的影响
经测定在避光、室内散射光、室外直射光和紫外灯下样品的吸光度值(OD515)结果:如图2、3。
由图2、3可知其吸光度值随存放时间的延长几乎无变化,表明三角叶黄连内生真菌的这种红色素具有较强的光适应性。
2.3 金属离子对红色素稳定性的影响
经测定样品在不同浓度的金属离子的吸光度值(OD515)结果见表1。

表1 金属离子对红色素稳定性的影响Table 1 Effect of metal ions on the stability of the red pigments
由表1可知不同浓度的金属离子Na+、Mg2+、A13+、Ca2+、K+对红色素提取液具有一定增色作用,使天然红色色素提取液的红色加深;不同浓度梯度的Fe3+和Zn2+可使红色色素溶液颜色变成深黄色,说明此红色素提取物可能对Fe3+和Zn2+较敏感。由此可知,除Fe3+和Zn2+外的其他多种常见金属离子在不同浓度下对红色素影响较小。
2.4 氧化剂对红色素稳定性的影响
经测定含不同浓度的双氧水(H2O2)的样品吸光度值(OD515)结果见图4。

图4 双氧水对红色素稳定性的影响Fig.4 Effect of hydrogen peroxide on the stability of the red pigment
由图4中可知,在2 h内,不同浓度双氧水处理处理,色素OD值变化不显著;当时间增加至4 h,红色素的OD值明显降低;继续延长时间至8 h,红色素的OD值无明显下降。因此,红色素对氧化剂双氧水在一定的时间范围内呈时间依赖性,处理时间越长,残留量越少。说明该色素对氧化剂的稳定性较差。
2.5 还原剂对红色素稳定性的影响
经测定含不同浓度的亚硫酸钠和抗坏血酸的样品吸光度值(OD515)结果见图5、6。
由图5可知,随着亚硫酸钠(Na2SO3)的浓度和时间的增加,对红色素有增益作用,对其稳定性影响不明显,说明该色素对亚硫酸稳定性较好。由图6可知,红色素溶液中加维生素C后在处理2~4 h,其吸光度明显下降,随维生素C浓度的增加红色素吸光度呈现下降趋势。表明该色素不耐受还原剂抗坏血酸。由图5、6可知,红色色素对不同种类的还原剂的适应性不同。

图5 亚硫酸钠对红色素稳定性的影响Fig.5 Effect of sodium sulfite on the stability of the red pigment

图6 抗坏血酸对红色素稳定性的影响Fig.6 Effect of ascorbic acid on the stability of the red pigment
2.6 酸度调节剂对红色素稳定性的影响
经测定含2%的(柠檬酸钠、苹果酸和氢氧化钠)样品溶液吸光度值(OD515)结果见图7。

图7 酸度调节剂对红色素稳定性的影响Fig.7 Effect of acidity regulator on the stability of the red pigment
加入柠檬酸钠后,处理25 h,溶液颜色几乎不变,吸光度值变化不明显;加入氢氧化钠处理5 h,其吸光度值显著下降42.04%,25 h时变为吸光度值趋近于0,并出现红色沉淀。加入柠檬酸处理5 h后,吸光度值显著下降为初始值的12.8% ,延长至25 h时,吸光度值未继续下降,溶液变成亮黄色;加入苹果酸处理5 h,吸光度值显著下降为初始值的11.23%,延长至25 h时,吸光度值未继续下降,溶液变成亮黄色。由此表明,柠檬酸钠能够维持三角叶黄连内生菌的红色天然色素的稳定性,而柠檬酸、苹果酸和氢氧化钠对红色素有某种破坏或者螯合作用。
2.7 维生素对红色素稳定性的影响
在红色素提取液中加入浓度为0.1%的维生素后,其吸光度与色素溶液存放时间的关系曲线如图7所示。

图8 维生素对红色素稳定性的影响Fig.8 Effect of vitamin on the stability of the red pigment
由图8可以看出加入Va、Vb、Vd和Ve试剂后随着时间的延长,红色素溶液的吸光度值几乎没有变化,表明该红色素具有多种维生素的耐受性。
2.8 常用食品添加剂对红色素稳定性的影响
在红色素提取液中加入浓度为3%的葡萄糖、明胶、氯化钠和苯甲酸钠等常用食品添加剂后,其吸光度与色素溶液存放时间的关系曲线如图8、9所示。

图9 常用食品添加剂对红色素稳定性的影响Fig.9 Effect of common food additives on the stability of the red pigment
由图9可知加入高浓度3%葡萄糖、氯化钠和明胶后,随时间的延长红色素OD值基本没有变化;加入3%的苯甲酸钠,随时间的延长,OD值显著下降,处理5 h,红色素OD值为0。

图10 苯甲酸钠对红色素稳定性的影响Fig.10 Effect of sodium benzoate on the stability of the red pigment
由图10显示不同浓度的苯甲酸钠对红色素OD值的影响,低浓度(<0.5%)苯甲酸钠对此红色素OD值基本没有影响,随着浓度的升高,吸光度值显著下降,加入1.0%的苯甲酸钠处理5 h,红色素OD值为初始的35.82%,25 h后,红色素OD值为初始的5.7%;1.5%的苯甲酸钠混合溶液5h后红色素OD值为初始的26.78%,处理15 h后吸光度值降为0;2.0%苯甲酸钠的混合溶液在5 h后最大吸光值即降为0,表明大于0.5%的苯甲酸钠对此红色素OD值影响显著。
2.9 防腐剂山梨酸钾对红色素稳定性的影响
为检测防腐剂对三角叶黄连内生菌的红色色素稳定性影响,测定了含不同浓度山梨酸钾的色素提取液的吸光度值,如图11所示。
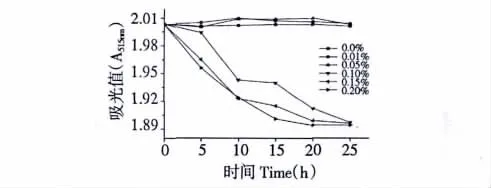
图11 山梨酸钾对红色素稳定性的影响Fig.11 Effect of potassium sorbate on the stability of the red pigment
由图11可知,色素液中加入不同浓度的山梨酸钾以后,当浓度小于0.05%时,吸光度几乎不变;在0.1% ~0.2%范围内,吸光度值略有下降,在25 h以后红色素残存率维持在95%左右,说明此红色素对山梨酸钾有较好的稳定性。
3 结论
本文使用分光光度法,检测了三角叶黄连的内生菌发酵物中提取色素对多种日常生活成分的适应性,发现其对这些物质的耐受程度存在较大差异,此结果有利于合理地开发、贮存这种新型的天然色素,为后续的深入研究奠定基础。此红色素在70℃下,具有较好的稳定性,在加工、使用过程中,可一定程度上避免高温加热,保护其色泽。温度、光照、维生素以及常用食品添加剂等对红色素影响很小。此红色素溶液在Fe3+和Zn2+的影响下变成黄色,有可能是红色素和Fe3+和Zn2+络合生成其它物质,也可能由于直接和红色素反应引起色变;此红色素对金属离子Fe3+和Zn2+敏感,在生产、加工和储存过程中应避免与铁器、铝器接触。氧化剂和还原剂抗坏血酸对此红色素稳定性影响明显,避免混用;酸度调节剂中柠檬酸,苹果酸和氢氧化钠对红色素溶液稳定性影响大,该红色素适合在中性或弱酸性条件下使用。此红色素对苯甲酸钠很敏感,苯甲酸钠浓度不同时,对红色素的影响差异很大,在使用时要特别注意。该红色色素由多种成分混合而成,需进一步经过成分分离,结构鉴定来研究证明,另一方面可以进一步优化其生产和提取工艺,筛选出保护色泽的最佳条件,以确保该色素能应用于生产生活中,提高其应用价值。
1 Qiu WF(邱伟芬),Wang HF(汪海峰).Natural lycopene stability in different conditions of environmental.J Food Sci(食品科学),2004,25(2):56-60.
2 Jiao ZG(焦中高),Liu JC(刘杰超),Wang EX(王恩新),et al.Extraction and stability of red pigment from Black Berry preliminary study.J Food Sci(食品科学),2006(3):154-157.
3 Ouyang J(欧阳杰),Zhao JL(赵佳丽),Chen XH(陈旭华).Natural edible pigment stabilization technologies.Food Sci Tech(食品科技),2006(8):182-184.
4 Lu XH(卢雪华),Cheng J(成坚),Bai WD(白卫东).China's edible pigment industry present situation and countermeasure.China Condiment(中国调味品),2010(5):35-39.
5 Zhang AM(张爱梅),Liu SQ(牛世全),Da WY(达文燕),et al.A strain of green pigment preliminary identification of Actinomyces and detection of pigment stability.J Northwest Normal Univ,Nat Sci(西北师范大学学报,自科版),2010,46(3):89-93.
6 Ma Q(马庆),Ma YT(马云桐),Tan YL(谭友莉),et al.Optimizing of fermentation condition of the endophytic fungi in Coptis deltoidea C.Y.Cheng et Hsiao which produces red pigment.Pharm Clinic Chin Mater Med(中药与临床),2012,3(2):12-13.
