响应面分析法优化超声提取蓖麻碱工艺
2013-10-25陈永胜穆莎茉莉李国瑞
邱 靖,陈永胜 ,穆莎茉莉,李国瑞
1内蒙古民族大学农学院;2内蒙古民族大学生命科学院;3内蒙古自治区高校蓖麻产业研究中心,内蒙古自治区通辽028000
蓖麻碱是蓖麻中主要毒素之一,主要存在于蓖麻的茎叶和种子中,在幼嫩的子叶中含量较高,在植株不同的部位其含量有所不同,籽壳中含1.5%,幼嫩绿叶中含0.7% ~1.0%,种子中含0.1% ~0.2%,未脱毒的蓖麻饼中含 0.3% ~0.4%[1,2]。蓖麻碱为白色针状或棱柱状结晶体,其学名为3-氰基-4-甲氧基-1-甲基-2-吡啶酮,分子式为 C8H8N2O2,分子量为164.17,熔点为201.5℃,在170~180℃、2667kPa 20S时有升华[3]。蓖麻碱是一种中性的生物碱,其水溶性呈中性,与酸反应不易形成盐,碱性溶液能使高锰酸钾还原,同时还生成氢氰酸,因为蓖麻碱分子中含有氰基,其毒性很大,对人可引起呕吐、恶心,严重时呼吸衰竭而死,对家禽毒性作用较强,是一种能导致甲状腺肿大的潜在因子[4,5]。蓖麻碱有一定的杀虫和镇痛作用,对天幕毛虫、小菜蛾、桃蚜等害虫有不同程度的杀灭[6]。
超声提取原理是利用超声波在液体中产生的空化效应、热效应和机械作用。当大能量的超声波作用于介质时所产生的大气压的瞬间压力破坏液体中植物细胞和细胞膜结构,从而增加细胞内溶物通过细胞膜的穿透能力,有助于蓖麻碱的释放和溶出;超声波使提取液不断震荡,有助于溶质扩散,缩短了破碎提取时间,同时超声波产生的振动作用加强了胞内物质的释放、扩散和溶解,提高了有效成分的提取率和原料的利用率[7,8]。
本试验研究了以新鲜绿叶为提取原料,采用响应面方法优化超声波提取蓖麻碱的工艺条件。目前国内对蓖麻碱提取主要以蓖麻饼粕原料,然而至今还未有以新鲜的绿叶为原料的相关报道,在此方法的提取过程中工艺及处理方法有所不同。以绿叶为原料时,必须对绿叶中叶绿素进行处理,避免叶绿素对蓖麻碱含量测定的干扰。而国内对蓖麻碱的提取常用方法有回流提取法、微波提取法,以超声波辅助提取蓖麻碱的工艺尚无报道。因此本文采用响应面分析法优化超声波提取蓖麻碱,并通过实验获得最佳提取工艺参数能,够取得较好的效果。此方法测定蓖麻叶、茎、中蓖麻碱的含量为今后的研究提供参考,从而为进一步开发利用蓖麻碱提供理论依据。
1 材料与方法
1.1 材料与试剂
通蓖6嫩叶(大田采样);蓖麻碱标准样品(实验室自制,经过高效液相色谱,核磁共振检验纯度为99.8%);甲醇、乙醇、三氯甲烷均为国产分析纯;蒸馏水。
1.2 仪器与设备
VCX130型超声波仪,美国Sonics&Materials公司;紫外分光光度计,北京普析通用仪器有限责任公司;DHG-9240型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;旋转蒸发仪,上海亚荣生化仪器厂;TDL-5低速台式大容量离心机,珠海黑马医学仪器有限公司。
1.3 方法
1.3.1 蓖麻碱提取工艺
蓖麻叶→擦净→去除叶脉→85%丙酮溶液浸泡(除叶绿素)→烘干→粉碎→溶剂超声提取→离心→旋转蒸发→蓖麻碱。
1.3.2 蓖麻碱标准曲线的绘制
按照参考文献[9]的方法精密称取蓖麻碱标准品10 mg,置10 mL容量瓶中,用甲醇溶解,并稀释定容后得到1 mg/mL蓖麻碱标准溶液。从标准溶液中准确吸取蓖麻碱标准溶液 0、200、400、600、800、1000 μL分别置100 mL容量瓶中,加甲醇定容至刻度,摇匀,使其浓度分别为 0、2、4、6、8、10 μg/mL的蓖麻碱溶液,室温下静置30 min;用紫外分光光度计,以甲醇为空白对照品,在波长314 nm处测定吸光度,以吸光度为横坐标,蓖麻碱浓度为纵坐标作标准曲线,得线性回归方程:Y=0.0593X-0.0044,R2=0.9991。
1.3.3 蓖麻碱提取率的计算
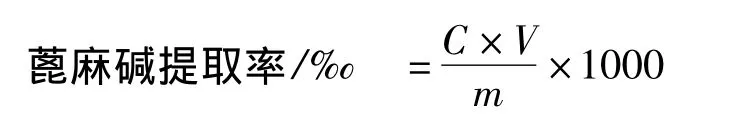
式中:C:提取液中蓖麻碱浓度;V:溶解蓖麻碱所用甲醇体积;m:蓖麻叶粉末质量。
1.3.4 单因素实验
1.3.4.1 提取溶剂对提取率的影响
准确称取蓖麻叶粉末1 g,放入烧杯中,设定超声温度为60℃,时间为120 min,提取料液比为1∶20 g/mL,功率600 W。分别以甲醇、乙醇、三氯甲烷、水为提取溶剂。提取后离心,5000 rpm,离心20 min。取上清液,旋转蒸发蒸干溶剂后,用甲醇溶解并稀释到刻度定容于100 mL容量瓶中,测定吸光度,确定最佳提取溶剂。
1.3.4.2 提取料液比对提取率的影响
准确称取蓖麻叶1 g,加甲醇进行提取,以超声功率为600 W、温度为60℃,时间为120 min,在不同料液比(1∶10、1∶15、1∶20、1∶25、1∶30 g/mL)的条件下进行提取,同上1.3.4.1步骤操作,测定吸光度,确定最佳提取料液比。
1.3.4.3 超声提取时间对提取率的影响
准确称取蓖麻叶1 g,以甲醇为提取溶剂,提取料液比为1∶20 g/mL、超声功率为600 W、温度为60℃,在不同提取时间(30、60、90、120、150 s)的条件下进行提取。同上1.3.4.1操作测定吸光度,确定最佳超声时间。
1.3.4.4 超声提取温度对提取率的影响
准确称取蓖麻叶1 g,以甲醇作为溶剂,提取料液比为1∶20 g/mL、超声功率600 W、在不同提取温度(30、40、50、60、70 ℃)的条件下提取120 min。同上1.3.4.1操作,测定吸光度,确定最佳超声温度。
1.3.4.5 超声提取功率对提取率的影响
准确称取1 g蓖麻叶,以甲醇为溶剂,提取料液比为1∶20 g/mL,超声温度为60℃,时间为 120 min,在不同超声功率(400、500、600、700、800 W)的条件下进行提取。同上1.3.4.1操作,测定吸光度,确定最佳超声功率。
1.3.5 响应面试验设计
响应面设计[10],在单因素实验的基础上,以蓖麻碱提取率为响应值Y,选出影响最显著的因素:料液比、超声时间、超声功率,进行三因素三水平的响应面试验。实验因素与水平见表1。
2 结果与分析
2.1 单因素实验结果
2.1.1 提取溶剂对蓖麻碱提取率的影响分析

表1 响应面试验因素水平及编码表Table 1 Level and code of response surface experiments
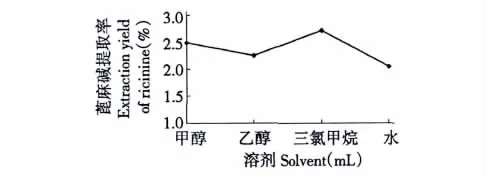
图1 提取溶剂(甲醇、乙醇、三氯甲烷、水)对蓖麻碱提取率的影响Fig.1 Effects of extraction solvent(methanol,alcohol,chloroform,H2O)on the extraction yield of ricinine
由图1可知,在相同提取条件下,三氯甲烷为溶剂所得到的蓖麻碱提取率为最高;而以甲醇为提取溶剂所到的蓖麻碱提取率略低于三氯甲烷;乙醇为提取溶剂所得到的蓖麻碱提取率低于三氯甲烷;以水为提取溶剂所得到的蓖麻碱提取率最低。因三氯甲烷是有毒气体,且甲醇提取率略低于三氯甲烷,故选择甲醇最适宜。
2.1.2 提取料液比对蓖麻碱提取率的影响分析

图2 料液比对蓖麻碱提取率的影响Fig.2 Effects of ratio of sample to solvent on extraction yield of ricinine
由图2可知,料液比为1∶20 g/mL时,蓖麻碱提取率达到最高。蓖麻碱提取率随着提取溶剂的增加而增加,料液比增加,细胞内外浓度差增加,内扩散速度增加,有利于蓖麻碱的溶出。但当溶剂用量达到一定程度时,蓖麻碱的提取率开始减小,此时如果继续增加提取溶剂的用量,提取溶剂过多,提取液浓度会随之下降,提取率就会减小。因此提取料液比以1∶20 g/mL为最佳。
2.1.3 超声时间对蓖麻碱提取率的影响分析
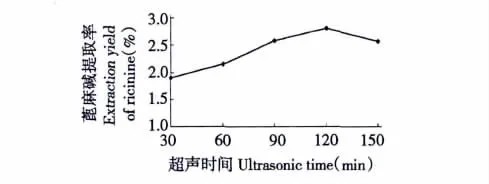
图3 超声时间对蓖麻碱提取率的影响Fig.3 Effects of ultrasonic time on extraction yield of ricinine
由图3可知,随着超声时间的增加,蓖麻碱的提取率也随之增加,当超声时间为120 min时提取率达到最高。其原因是超声波的空化效应。空化效应造成细胞壁的破坏,蓖麻碱等物质向溶液中扩散,蓖麻碱提取率此时达到最高值。因此超声时间为120 min为最佳提取。
2.1.4 超声提取温度对蓖麻碱提取率的影响
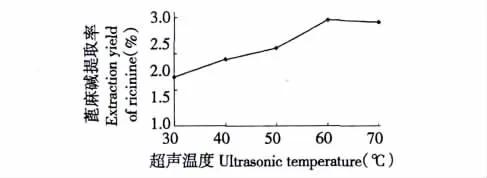
图4 超声波温度对蓖麻碱提取率的影响Fig.4 Effects of ultrasonic temperature on extraction yield of ricinine

图5 超声波功率对蓖麻碱提取率的影响 Effects of ultrasonic power on extraction yield of ricinine
由图5可知,随着超声功率的增加,蓖麻碱的提取率增加,当功率增加至600 W时,蓖麻碱的提取率达到最大值。而后又随超声功率的增加,蓖麻碱提取量随之缓慢减少。因此,超声功率为600 W为宜。
2.2 响应面试验结果
2.2.1 回归方程及方差分析
CCD实验设计结果见表2,利用Design Expert 8软件对实验数据进行回归分析,得到蓖麻碱提取率与各因素变量的二次回归方程:


表2 CCD实验设计及结果Table 2 Design and results of CCD tests
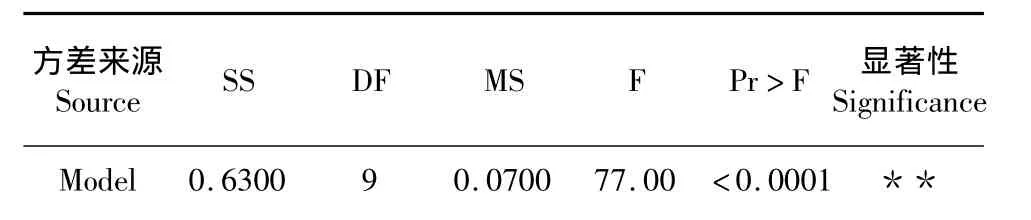
表3 回归方程模型方差分析Table 3 Analysis variance for regression equation model
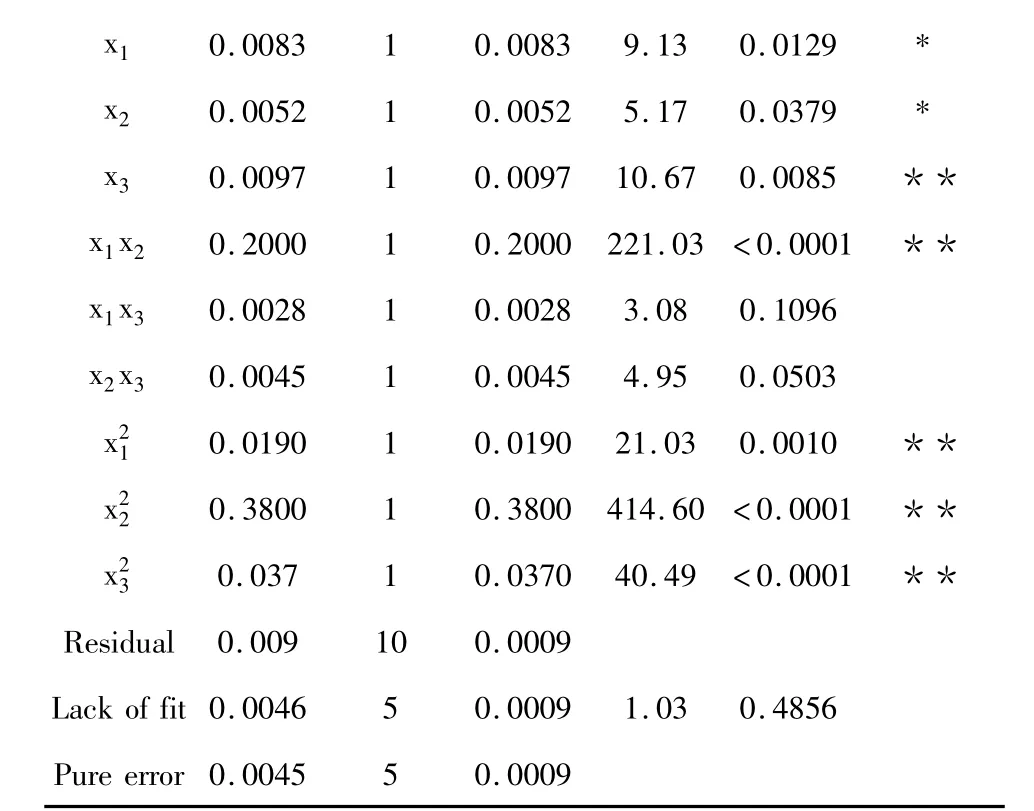
注:**P <0.001,very significant;*P <0.050,statistical significance;P>0.050 non-significant。
由回归方程模型方差分析表3可知,模型P<0.0001,回归模型极显著。模型中一次项x3极显著,x1、x2显著;互交项 x1x2显著;二次项极显著;结果表明,各因素对蓖麻碱提取率的影响不是简单的线性关系。失拟项P=0.4856>0.05,不显著,相关系数R2=0.9858,说明模型拟合程度良好,该模型可以较好的分析超声法提取蓖麻碱提取率。
2.2.2 响应曲面分析
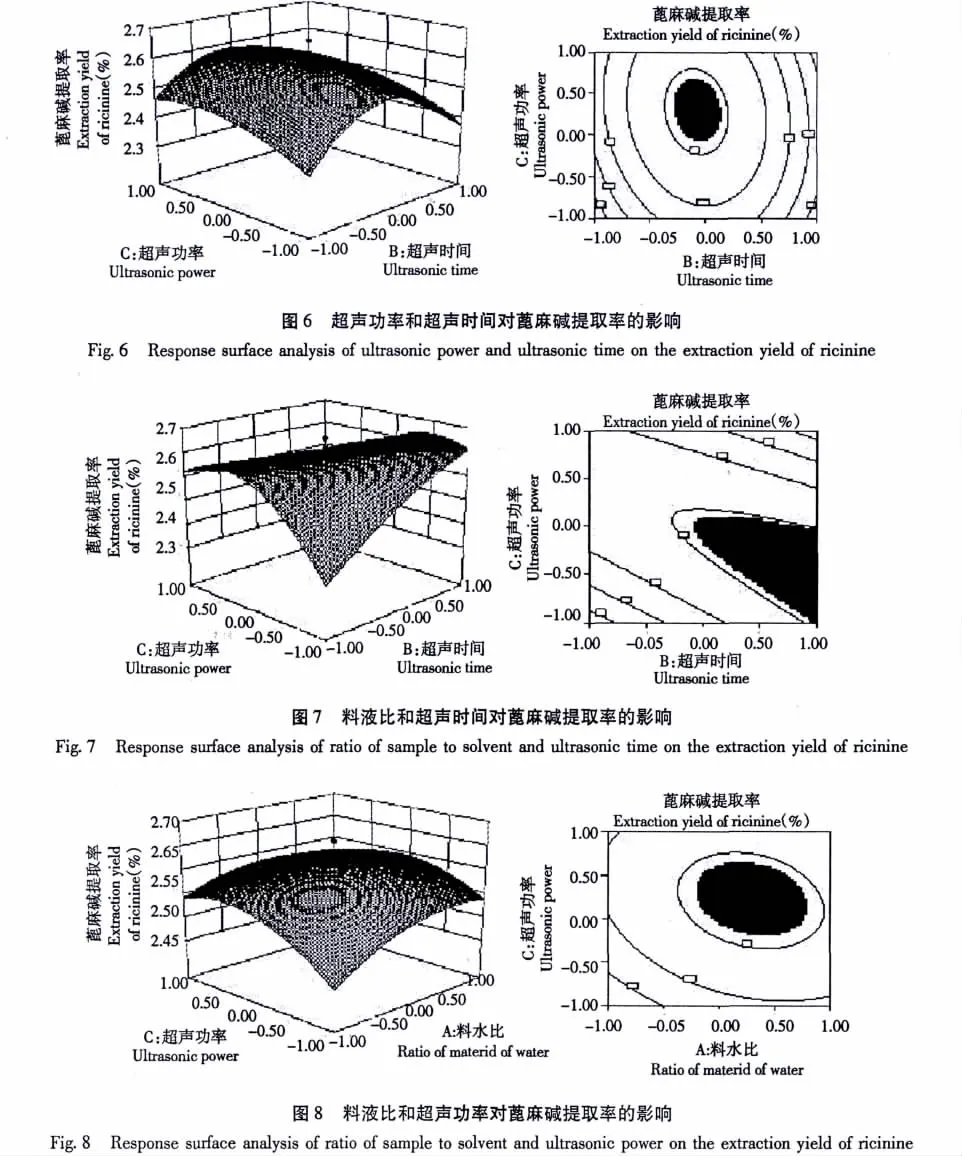
通过响应面图可以直观的看出各因素和各因素之间的交互作用对蓖麻碱提取率的影响,根据回归方程做响应面三维图,比较响应面三维图可看出,在所选范围之内存在着极值,即为响应面最高点;等高线的形状反映交互作用的大小,圆形表示两因素的交互作用不显著,椭圆形则表示两因素交互作用显著。比较3组响应面及等高线分析图可知:超声时间和料液比对蓖麻碱提取率的交互作用极显著;其次超声功率和超声时间、料液比和超声功率对蓖麻碱提取率对蓖麻碱提取率的交互作用显著。
2.2.3 提取工艺条件的确定与验证
提取工艺的优化与实验验证为确定超声波提取灵芝的最佳工艺参数,对拟合的回归方程分别求3个变量的一阶偏导,并令其值为0,可得到个因素的编码值:x1=0.99,x2=-0.57,x3=0.21,转换后得到最佳提取工艺条件为:超声时间103.03 min、超声功率621.05 W、料液比1∶25 g/mL,理论预测提取率为2.65‰。为了检验响应面法优化超声波提取蓖麻碱工艺结果的可靠性,根据得到的优化条件进行3次验证实验,结果显示,实验平均值为2.63‰,与预测的最大响应值相对标准偏差为0.02‰。说明该方程与实验情况拟合很好,响应面法对蓖麻碱超声波提取工艺的优化是可行的。
3 结论
本实验在单因素实验的基础上,将响应面分析法应用于优化超声波提取蓖麻碱的条件。回归方程模型方差分析结果表明超声时间和料液比对蓖麻碱提取率的交互作用极显著;其次超声功率和超声时间、料液比和超声功率对蓖麻碱提取率对蓖麻碱提取率的交互作用显著,这3个因素对蓖麻碱提取率的影响不是简单的线性关系。
蓖麻碱提取率的响应曲面的回归方程模型方差分析和验证实验表明此方法可行。所得超声波法提蓖麻碱的最佳工艺为:以甲醇为提取溶剂,超声时间103.03 min、超声功率621.05 W、料液比1∶25 g/mL,蓖麻碱的理想预测值为 2.65‰,验证值为2.63‰,与预测值的相对误差为0.02‰。
1 Wen YM(温燕梅),Feng YF(冯亚非),Zheng MZ(郑明珠),et al.Extraction and content of the ricinine for different parts of Ricinus communis.Agrochemicals,2008,47:584-606.
2 Zheng C(郑成),Xu LZ(许丽珠),Gao XM(高晓明),et al.Study on the extraction,purification,and recomposition of the ricinine and its insecticidal effects.Nat Prod Res Dev,2007,19:785-790.
3 Zhang XH(张小红),Li CL(李翠丽),Yu JJ(于俊杰),et al.Separation and determination of ricinine from Ricinus Semen.Chin J New Drugs,2011,20:1741-1744.
4 Yuldashev PKh.Ricinine and its transformation.Chem Nat Comp,2001,27:274-275.
5 Jiang XH,Song GQ.The comprehensive development and utilization of castor bean meal.J Zhongkai Agrotech College,2001,14:54-59.
6 Zhao ZL(赵增林),Zhao W(赵伟),Zhang HY(张海悦),et al.Biological activity of ricinine.China Brew,2009,207(6):13-14.
7 Park SY,Chang SY,Oh OJ,et al.Nor-oleanene type triterpene glycosides from the leaves of Acanthopanax Japonicas.Phytochemistry,2002,59:379-384.
8 Wei LY,Wang JH,Zheng XD,et al.Studies on the extracting technical conditions of inulin from Jerusalem artichoke tubers.J Food Eng,2007,79:1087-1093.
9 Xu WQ(徐文清),Chen A(陈艾),Zhuang XL(庄湘莲),et al.Quantity determination of ricinine in Castor Pomace by ultroviolet spectrometry method.China Oil,2001,26(2):45-46.
10 Gupta S,Manohar CS.An improved response surface method for the determination of failure probability and importance measures.Structural Safety,2004,26:123-132.
