有氧运动对Ⅱ型糖尿病大鼠结肠肌间神经丛及结肠功能障碍的影响*
2013-10-24郝选明王松涛
覃 飞, 郝选明△, 王松涛, 李 翰
(1华南师范大学,广东 广州 510631; 2国家体育总局体育科学研究所,北京 100061)
有氧运动对Ⅱ型糖尿病大鼠结肠肌间神经丛及结肠功能障碍的影响*
覃 飞1, 郝选明1△, 王松涛1, 李 翰2
(1华南师范大学,广东 广州 510631;2国家体育总局体育科学研究所,北京 100061)
目的观察有氧运动结合不同饮食方式对2型糖尿病大鼠结肠功能的影响,并从肠神经的角度探讨其神经生物学机制,进而为糖尿病胃肠功能紊乱的运动疗法提供理论和实验依据。方法雄性SD大鼠45只,除正常对照组外其余大鼠经高脂饲养和链脲佐菌素注射建立2型糖尿病大鼠模型,再随机分为普通饲料安静组、普通饲料运动组、高脂饲料安静组和高脂饲料运动组。运动组进行8周无负重游泳训练(60 min/d,5 d/week)。采集血清测口服葡萄糖耐量,结肠组织进行肠张力测试、HE染色以及蛋白基因产物9.5(PGP9.5)、P物质(SP)和血管活性肠肽(VIP)免疫组化检测。结果(1)糖尿病大鼠结肠肌间神经丛萎缩,神经元数目明显减少,有氧运动在一定程度上抑制上述病理改变;(2)有氧运动结合合理饮食可明显升高糖尿病大鼠结肠SP含量,而高脂膳食结合运动干预未见SP含量明显改善;(3)不同膳食方式结合运动,均能显著提高糖尿病大鼠结肠VIP含量;(4)运动干预后糖尿病大鼠结肠平滑肌萎缩减轻,肌纤维增粗,肠张力显著升高。结论糖尿病可导致结肠平滑肌萎缩,肠张力下降;有氧运动可通过重塑结肠肌间神经丛而发挥对糖尿病机体结肠结构和功能的适度改善作用。
糖尿病; 肌间神经丛; 有氧运动; 高脂饮食; 胃肠道功能紊乱
糖尿病胃肠功能紊乱是糖尿病常见的慢性并发症之一,流行病学调查显示糖尿病患者出现胃肠道症状者高达75%,表现为肠动力不足,消化和吸收机能障碍,习惯性便秘或腹泻等,并可产生特征性的病征——胃轻瘫和巨结肠等。其发病机制可能与自主神经失衡、肠神经病变和平滑肌变性等因素有关[1]。
肠神经是肠壁内相对独立于外源性自主神经支配的内源性神经系统,具有完整而复杂的神经网络结构,因此又称为“肠脑”。肠神经不仅在胃肠道平滑肌的运动和腺体分泌等方面发挥重要的调节作用,而且是机体神经-内分泌-免疫调控网络的重要组成部分[2]。大量运动干预的研究已证实,长期有氧运动对糖尿病患者具有良好的整体调节作用[3]。但是,运动对于糖尿病胃肠功能和肠神经影响的相关研究还鲜见报道。运动是否有助于改善和预防糖尿病患者胃肠功能紊乱?运动对糖尿病胃肠功能的影响与肠神经系统的关系如何?针对这些问题,目前我们还不能提供清晰的解答。基于此,本研究通过建立2型糖尿病大鼠模型,观察有氧运动结合不同饮食方式对结肠平滑肌功能的影响,并分析结肠肌间神经丛形态学和胃肠肽含量的变化,旨在以肠神经为切入点较为深入地探讨有氧运动调整糖尿病胃肠功能紊乱的神经生物学机制,并在实践上为糖尿病运动处方提供理论基础和实验依据。
材 料 和 方 法
1材料
1.1动物 SPF级雄性SD大鼠45只,8周龄,体重(220±20)g,许可证号为SCXK(粤)2011-0020,购自中山大学实验动物中心。
1.2主要试剂 链脲佐菌素(streptozotocin,STZ)(Sigma);蛋白基因产物9.5(protein gene product 9.5,PGP9.5)、P物质(substance P,SP)和血管活性肠肽(vasoactive intestinal peptide,VIP)抗体(北京博奥森生物技术有限公司);SP Rabbit HRP Kit (DAB)(北京康为世纪生物科技有限公司);氯化乙酰胆碱(上海源叶生物科技有限公司)。
1.3主要仪器 JPS-5型血糖仪(北京怡成);16导生物信息采集系统(Power lab);多导离体器官水平浴槽及配套器材(成都泰盟);石蜡包埋机、脱水机、染色机和石蜡切片机(Leica);显微镜(Olympus)。
2方法
2.1模型构建与分组 大鼠适应性喂养1周,随机分为正常对照组(normal control, NC,8只,普通饲料)和模型组(37只,高脂饲料)。喂养5周后,模型组大鼠禁食12 h后腹腔注射STZ(30 mg/kg),正常对照组注射同剂量溶剂(柠檬酸-柠檬酸三钠缓冲液)。3 d和7 d后分别尾部静脉取血测血糖,以空腹血糖浓度≥6.7 mmol/L,随机血糖浓度≥16.7 mmol/L为造模成功标准。剔除不达标大鼠5只,将糖尿病模型组大鼠随机分为:普通饲料安静组(diabetes control, DC)、普通饲料运动组(exercise, E)、高脂饲料安静组(high-fat diet,HFD)、高脂饲料运动组(exercise combined with high-fat diet,E+HFD),每组8只。
2.2运动方案 采用无负重游泳训练[3][水深60 cm;水温:(32±2)℃;活动面积:200 cm2]。适应性训练1周,初始训练时间为10 min,随后每天递增10 min,最终增加至60 min/d,5 d/week,共8周。
2.3口服葡萄糖耐量试验(oral glucose tolerance test,OGTT) 各组大鼠禁食12 h,尾部静脉取血检测空腹血糖,随后分别在灌服葡萄糖(2 g/kg)后30 min、60 min和120 min检测血糖水平[4]。
2.4结肠张力实验 大鼠处死后,迅速取出约2 cm长的近端结肠(自盲肠与结肠交界处2 cm以下),4 ℃台氏液中清洗。剪取1.5 cm的肠段,无弹性细线结扎,置于37 ℃的恒温灌流浴槽内(持续通入95% O2和5% CO2混合气体)。肠段一端固定在平滑肌槽反应室的下端,另一端与张力传感器相连,张力传感器给予1 g负荷,多导生理记录仪采集肠段平滑肌机械收缩活动信号。待肠段自发收缩活动平稳后,记录结肠平滑肌自发收缩和1×10-7mol/L乙酰胆碱处理后的收缩曲线。MedLab分析软件处理数据。
2.5结肠形态光学显微镜观察 于回盲部向远心端1 cm处切取结肠组织后,冰生理盐水冲洗肠腔,10%中性甲醛溶液进行固定48 h后,常规乙醇梯度脱水,石蜡包埋连续切片, 片厚5 μm,HE染色, 中性树脂封片, 镜下观察结肠纵形肌和环形肌厚度、平滑肌肌纤维、肌间神经丛形态结构及有无出血、炎症等现象。
2.6结肠神经PGP9.5、VIP和SP免疫组化染色检测 采用SP法进行免疫组化染色,DAB显色,常规脱水、透明、封固。在100和400倍的光镜视野下,分别对相邻切片的PGP9.5、VIP和SP染色阳性细胞进行统计。显微镜下胞浆有棕色颗粒者为阳性细胞,运用Image-Pro Plus软件进行阳性面积定量分析,得出积分吸光度(IA),每张切片中采集5个视野。
3统计学处理
数据用均数±标准差(mean±SD)表示,用SPSS Statistics 17.0统计软件处理;组间比较采用单因素方差分析(One-way ANOVA),方差一致时采用LSD进行两两多重比较,方差不一致时,采用Tamhane’s T2进行两两多重比较,以P<0.05为差异有统计学意义。
结 果
1口服葡萄糖耐量试验
如图1所示,与正常对照组(NC)相比,糖尿病对照组(DC)和糖尿病高脂膳食组(HFD)的空腹血糖和OGTT各时点血糖值均显著升高(P<0.01)。糖尿病运动各组与糖尿病对照组(DC)和糖尿病高脂膳食组(HFD)相比,OGTT各时点的血糖值均显著降低(P<0.05或P<0.01)。
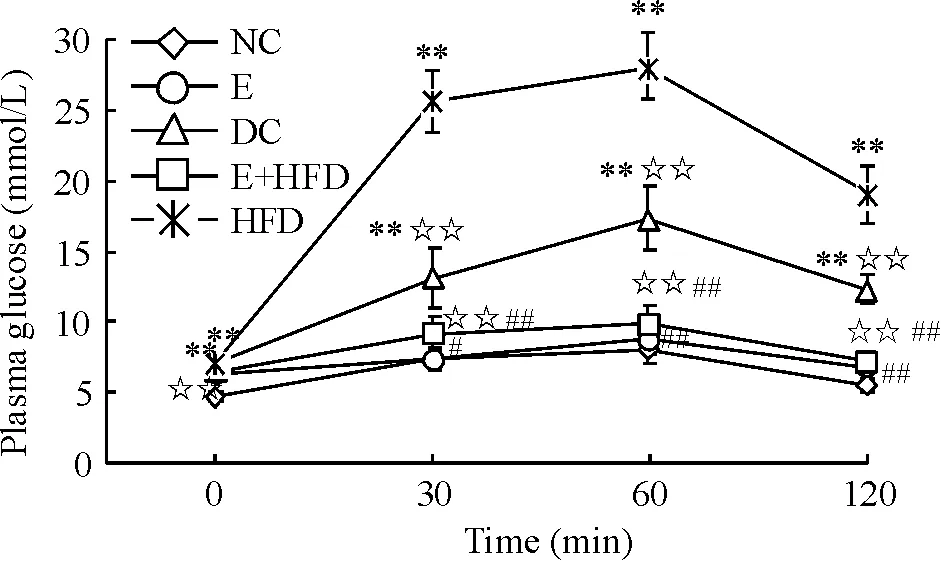
Figure 1. Changes of plasma glucose in oral glucose tolerance test in different groups. Mean±SD.n=8.**P<0.01vsNC;☆☆P<0.01vsHFD;#P<0.05,##P<0.01vsDC.
图1各组大鼠口服糖耐量试验的血糖变化
2结肠张力测试
如表1所示,正常对照组(NC)乙酰胆碱刺激下肠张力与静息肠张力相比显著升高(P<0.05)。糖尿病各组与正常对照组(NC)相比,各状态下肠张力及肠张力变化率均显著下降(P<0.01)。糖尿病高脂膳食组(HFD)与糖尿病对照组(DC)相比,各状态下肠张力显著下降(P<0.05)。糖尿病运动组(E)与其它糖尿病各组相比,各状态下肠张力显著升高(P<0.05)。
表1结肠张力试验结果
Table 1. The tension of smooth muscle in colon (Mean±SD.n=8)

GroupBasictension(g)Tensionwithacetylcholine(g)Changerateoftension(%)NC1.04±0.251.37±0.23*32.32±4.31DC0.52±0.17##0.62±0.17##19.51±7.54##E0.75±0.27#&△0.92±0.22##&△23.24±6.56#HFD0.33±0.19##&&0.38±0.21##&15.18±4.10##E+HFD0.39±0.21##0.43±0.19##15.76±5.17##
*P<0.05vsbasic tension;#P<0.05,##P<0.01vsNC;&P<0.05,&&P<0.01vsDC;△P<0.05vsE+HFD.
3结肠平滑肌组织结构观察(图2)
3.1正常对照组(NC) 平滑肌排列紧密,肌纤维呈梭形平行排列,细胞核呈椭圆形位于中央,肌间存在少量结缔组织纤维。
3.2糖尿病对照组(DC) 环形肌变薄,肌纤维变细,部分萎缩。胞浆呈现空泡样变性,部分胞核固缩,肌层胶原纤维增生。
3.3糖尿病运动组(E) 纵、环肌均变厚,肌纤维增粗,同时出现胶原纤维,细胞核固缩现象减少,肌纤维萎缩得到一定程度改善。
3.4糖尿病高脂膳食组(HFD) 环形肌及纵形肌变薄, 以纵形肌厚度变薄为著,肌纤维萎缩程度加剧,胞浆空泡样变性, 甚至塌陷,大量胞核固缩,肌层胶原纤维增生。
3.5糖尿病高脂膳食运动组(E+HFD) 纵形肌变厚,环形肌厚度、肌纤维萎缩程度、肌纤维组织结构与糖尿病高脂膳食组 (HFD)相比无明显变化,平滑肌纤维化改变加重。
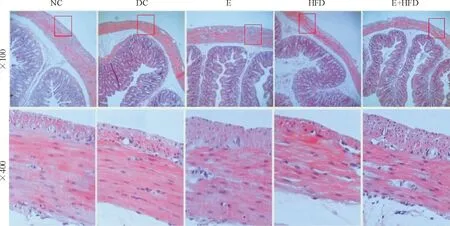
Figure 2. The histomorphology of smooth muscle in colon (HE staining).
图2结肠平滑肌组织形态学观察
4大鼠结肠肌间神经丛PGP9.5免疫表达
如图3所示,PGP9.5阳性表达主要分布在结肠肌间神经丛神经元胞浆内。正常对照组(NC)大鼠可见PGP9.5阳性表达深且分布均匀。糖尿病对照组(DC)PGP9.5阳性表达染色下降,神经元细胞减少,且存在变性、坏死和空泡样改变。糖尿病运动组(E)PGP9.5阳性表达加深,但仍存在少量神经丛空泡样改变。糖尿病高脂膳食组 (HFD) 呈现PGP9.5低阳性表达,神经元细胞变性、坏死和空泡样改变程度加重。糖尿病高脂膳食运动组(E+HFD)与糖尿病高脂膳食组 (HFD)相比虽有部分神经元细胞PGP9.5阳性表达上升,但神经元细胞变性、坏死和空泡样改变程度并无明显改善。
如图4所示,糖尿病各组与正常对照组(NC)相比,大鼠结肠肌间神经丛PGP9.5阳性表达均极显著降低(P<0.01)。糖尿病高脂膳食组 (HFD)和糖尿病高脂膳食运动组(E+HFD)与糖尿病对照组(DC)相比,PGP9.5阳性表达均极显著下降(P<0.01)。而糖尿病运动组与其它糖尿病各组相比,肌间神经丛PGP9.5阳性表达均极显著升高(P<0.01)。

Figure 3. The expression of PGP9.5 in colon (immunohistochemical staining,×400).A:NC; B:DC; C:E; D:HFD; E: E+HFD.
图3各组大鼠结肠PGP9.5的阳性表达

Figure 4. The expression of PGP9.5 in colon.Mean±SD.n=8.**P<0.01vsNC;#P<0.05,##P<0.01vsDC△△P<0.01vsE.
图4各组大鼠结肠PGP9.5的阳性表达量
5结肠组织胃肠肽VIP、SP含量检测
如图5、6所示,糖尿病各组与正常对照组(NC)相比,结肠SP和VIP阳性表达显著降低(P<0.01)。糖尿病运动组(E)与其它糖尿病组相比,SP和VIP阳性表达均显著升高(P<0.01或P<0.05)。糖尿病高脂膳食运动组(E+HFD)与糖尿病对照组(DC)、糖尿病高脂膳食组(HFD)比较,结肠肌间神经丛SP表达无显著变化。而糖尿病高脂膳食组(HFD) 肌间神经丛VIP阳性表达显著低于糖尿病对照组(DC)和糖尿病高脂膳食运动组(E+HFD)(P<0.05)。

Figure 5. The expression of SP in colon. Mean±SD.n=8.*P<0.05,**P<0.01vsNC;△P<0.05,△△P<0.01vsE.
图5各组大鼠结肠SP的阳性表达量

Figure 6. The expression of VIP in colon. Mean±SD.n=8.**P<0.01vsNC;#P<0.05vsDC;△△P<0.01vsE;&P<0.05vsE+HFD.
图6各组大鼠结肠VIP的阳性表达量
讨 论
1有氧运动对2型糖尿病大鼠血糖水平的影响
既往研究证明:长期处于胰岛素抵抗的高糖状态将导致机体稳态失衡、代谢紊乱继而引起组织病变和功能受损等代谢综合征[5]。本研究发现,运动可使正常饮食和高脂饮食的糖尿病大鼠的空腹血糖和OGTT血糖明显改善,说明中等强度的有氧运动可改善糖尿病大鼠的糖代谢功能。这可能是由于运动可以使胰岛素信号转导途径中关键蛋白的表达和活性增高,在一定程度上增强了胰岛素的信号传递,使糖尿病下降的胰岛素敏感性回升所致[6]。
2有氧运动对Ⅱ型糖尿病大鼠结肠肌间神经丛的影响
肠神经系统(enteric nervous system,ENS) 是胃肠道内一套独特的壁内局部神经系统,在肠壁内形成黏膜下丛(Meissner plexus)和肌间丛(Auerbach plexus),控制胃肠道的运动、分泌、血流和物质转运等功能,并把胃肠与中枢神经系统及自主神经系统联系起来。肌间神经丛位于大部分消化道纵形肌和环形肌之间,其神经元释放的递质主要调控平滑肌固有电活动和机械舒缩[2]。
PGP9.5是由212个氨基酸组成的胞浆蛋白,特异性地存在于神经节及弥散分布的神经内分泌细胞中,可作为神经元和神经纤维的特异性标志物[7]。本研究结果表明糖尿病对照组(DC)PGP9.5阳性表达减弱,神经元细胞数目减少,存在变性、坏死和空泡样改变。已有研究证实代谢紊乱与微血管损害在糖尿病神经病变中起着重要作用,其中多元醇、晚期蛋白糖基化终末产物、蛋白激酶C、氨基已糖等途径是经典的发病途径,它们均与高糖状态下产生的氧化应激有关[8]。研究表明糖尿病机体的还原型辅酶II(NADPH)大量消耗加重了氧化应激引起的神经组织损伤。高血糖时活性氧簇(reactive oxygen species,ROS)产生过多,抑制了GAPDH的活性,导致6-磷酸葡萄糖的累积,引起神经组织对肌酸摄取减少,神经能量供应降低,致使细胞的结构和功能受损[9]。本研究发现,糖尿病运动组(E)与糖尿病对照组(DC)相比 PGP9.5 阳性表达明显增强(P<0.01),神经丛空泡样改变得以改善,分析其机制可能是有氧运动在降低血糖的同时,提高了糖尿病机体的抗氧化能力。研究已证实适量有氧运动可启动机体抗氧化系统,通过升高机体超氧化物歧化酶Mn(Mn-SOD)、超氧化物歧化酶Cu/Zn(Cu/Zn-SOD)和过氧化氢酶(CAT),提高谷胱甘肽(GSH)和NADPH氧化酶的表达水平而适度提高机体的抗氧化能力[10]。因此,本研究中糖尿病运动组大鼠结肠神经丛呈现的良好改善,提示有氧运动可提高机体的抗氧化能力、增强抗氧化酶活性,进而通过多条途径发挥对肠神经组织的保护作用。
3有氧运动对Ⅱ型糖尿病大鼠结肠神经肽P物质和血管活性肠肽的影响
胃肠道平滑肌的功能受肌间神经丛释放的神经递质调节,其中兴奋性神经递质有SP、乙酰胆碱、5-羟色胺等;抑制性神经递质有VIP、一氧化氮等[2]。这些神经递质以协调对抗的关系发挥着对胃肠道功能的调节作用。
SP是兴奋性运动神经元递质,能抑制胃肠道黏膜分泌,刺激肠道运动。本研究显示糖尿病各组与正常对照组相比,SP阳性表达均呈现极显著降低(P<0.01),同时伴有肠道运动功能减弱(表1),提示SP含量下降可能是导致糖尿病大鼠结肠传输功能减弱的原因之一。糖尿病高脂膳食运动组(E+HFD)与糖尿病对照组(DC)、糖尿病高脂膳食组(HFD)比较,肌间神经丛SP表达无明显改变。说明糖尿病机体在高脂饮食状态下施加运动疗法,SP含量未出现明显改善。糖尿病运动组与其它糖尿病各组比较,SP阳性表达均显著升高(P<0.01或P<0.05),但仍然显著低于正常对照组(P<0.05)。说明长期有氧运动结合合理饮食,对结肠SP含量虽有一定程度的改善,但与正常机体仍有差距。因此,糖尿病肠动力障碍病人在结合运动训练的同时,建议辅以药物等其它治疗手段,以改善或恢复肠道的动力机能。
VIP是抑制性肠运动神经元递质,能促进肠道平滑肌舒张,抑制收缩。本研究中,糖尿病各组大鼠结肠VIP含量与正常大鼠相比均显著降低(P<0.01),有氧运动结合合理饮食干预后结肠VIP阳性表达虽明显提高,但与正常组仍有显著差距。值得注意的是,在高脂饮食状态下,糖尿病大鼠通过运动后VIP含量升高非常显著,但SP变化不明显,说明糖尿病高脂膳食运动组(E+HFD)大鼠的结肠SP和VIP分泌量失衡,相对增多的VIP将导致结肠过度松弛和肠动力下降。提示,在高脂饮食状态下,进行运动可能会进一步促使结肠SP/VIP的失衡,进而影响肠道的功能。
4高脂饮食对Ⅱ型糖尿病大鼠ENS的影响
合理饮食控制是Ⅱ型糖尿病治疗的关键,近年流行病和临床研究表明:糖尿病患者的脂肪摄入量有增多趋势,高脂会加重脂质代谢紊乱导致血管病变,进而引发视网膜病变[11]、糖尿病肾病[12]、心血管疾病[13]等多种并发症。Ohtsubo等[14]揭示了高脂肪饮食与糖尿病分子信号通路改变之间的关系,高脂通过激活胰腺β细胞内信号通路而引起其它器官和组织的代谢缺陷,这些受影响的器官和组织包括肝脏、肌肉和脂肪,它们共同导致了糖尿病及其并发症的发生和发展。
本实验构建Ⅱ型糖尿病大鼠模型后对2组大鼠继续进行高脂喂养,结果表明:对不改变高脂饮食习惯的糖尿病大鼠辅以运动干预,结肠ENS无法达到预期改善,且更容易出现结肠平滑肌纤维化和肠动力紊乱等并发症。
5有氧运动对Ⅱ型糖尿病大鼠结肠平滑肌结构及肌间神经丛功能的影响
肠神经系统病变可以影响胃肠道的功能,尤其是肌间神经丛及其释放递质的变化与肠平滑肌动力紊乱存在紧密联系。本研究各项指标显示,各组糖尿病大鼠的结肠肌间神经丛均出现不同程度的PGP9.5阳性表达下降,神经元细胞变性、坏死和空泡样改变(P<0.05或P<0.01),且SP和VIP阳性表达极显著降低(P<0.01)。肠神经系统不仅可作为“肠脑”调节胃肠道平滑肌的动力,同时也是胃肠道平滑肌的“营养能源库”,为其提供养分[2]。因此,本研究中糖尿病大鼠肠神经出现的病理改变可能是其肠动力下降、环形肌变薄、肌纤维变细萎缩和肌层胶原纤维增生的主要原因之一。
与糖尿病对照组(DC)相比较,糖尿病运动组(E)的肠张力显著升高,肌层变厚,肌纤维增粗,细胞核固缩现象减少,肌纤维萎缩得到一定程度改善,同时肌层胶原纤维增生增多。说明伴随肌间神经元结构、数目、神经肽(SP、VIP)含量的明显改善,结肠平滑肌处于修复状态。但值得注意的是,结肠平滑肌组织在修复过程中伴随胶原纤维的生成,肌层胶原纤维的过度增生是否会对肠道平滑肌运动功能产生负面影响,则需要实验研究进一步去观察。此外,糖尿病高脂膳食运动组(E+HFD)与糖尿病高脂膳食组(HFD)比较,虽纵形肌变厚,但环形肌厚度、肌纤维萎缩程度、肌纤维组织结构、肠张力无明显变化,同时平滑肌纤维化严重。上述发现提示:在不改变高脂饮食的情况下,运动对肠道平滑肌和肠神经系统结构和功能的良好作用将受到抑制。
综上所述,本研究提示,合理饮食结合有氧运动可在一定程度上通过促进糖尿病机体的“肠神经系统”重塑,使SP和VIP等肠神经肽的合成与分泌发生良好改变,进而改善肠道平滑肌萎缩现象和提高肠动力功能,这些作用对于防治糖尿病胃肠功能紊乱具有重要的意义。但上述变化伴随肠壁胶原纤维生成增多现象,在糖尿病患者长期运动干预的过程中需要继续观察和评价肠平滑肌纤维化对肠道功能及其整体健康水平的影响。
[1] 金启辉,管文花,王 辉,等. 氧化应激在糖尿病大鼠胃动力变化中的意义[J]. 中国病理生理杂志,2012,28(12):2238-2243.
[2] 周 吕,柯美云.神经胃肠病学与动力基础与临床[M].第1版. 北京:科学出版社,2005:31-143.
[3] Ploug T, Stallknecht BM, Pedersen O, et al. Effect of endurance training on glucose transport capacity and glucose transporter expression in rat skeletal muscle[J]. Am J Physiol, 1990, 259(6 Pt 1):E778-E786.
[4] Franconi F, Seghieri G, Canu S, et al. Are the available experimental models of type 2 diabetes appropriate for a gender perspective?[J]. Pharmac Res, 2008, 57(1): 6-18.
[5] Forbes JM, Cooper ME. Mechanisms of diabetic complications[J]. Physiol Rev, 2013,93(1):137-188.
[6] Wojtaszewski JF,Nielsen JN,Riehter EA. Invited review: effect of acute exercise on insulin signaling and action in humans[J]. J Appl Physiol,2002,93(1):384-392.
[7] Blair PJ, Bayguinov Y, Sanders KM, et al . Relationship between enteric neurons and interstitial cells in the primate gastrointestinal tract[J]. Neurogastroenterol Motil, 2012,24(9): e437-e449.
[8] Gundogdu BM. Diabetic peripheral neuropathy: an update on pathogenesis and management[J]. Curr Neurol Neurosci Reports, 2006, 6(1):1-4.
[9] Cheung AK, Fung MK, Lo AC, et al.Aldose reductase deficiency prevents diabetes-induced blood-retinal barrier breakdown, apoptosis, and glial reactivation in the retina ofdb/dbmice[J]. Diabetes,2005,54(11):3119-3125.
[10] Gomez-Cabrera MC, Domenech E, Via J.Moderate exercise is an antioxidant:upregulation of antioxidant genes by training[J]. Free Radic Biol Med,2008, 44(2):126-131.
[11] 陈燕铭, 王一娜,钟毅敏. 2型糖尿病视网膜病变患者血清炎症因子和脂联素水平的变化[J]. 中国病理生理杂志, 2011,27(6):1154-1158.
[12] 杜月光,钱俊文, 宋光明,等. LOX-1在2型糖尿病大鼠肾小管间质中的表达及其意义[J].中国病理生理杂志,2013,29(1):50-55.
[13] 王 宁, 伊力多斯, 谢自敬,等. 高脂饮食在糖尿病大鼠心肌细胞凋亡中的作用及机理探讨[J]. 华西医学,2006,21(4):765-766.
[14] Ohtsubo K,Chen MZ,Olefsky JM,et al. Pathway to diabetes through attenuation of pancreatic beta cell glycosylation and glucose transport[J]. Nat Med,2011,17(9):1067-1075.
Effectofaerobicexerciseonmyentericplexusandcolonicdysfunctionintype2diabeticrats
QIN Fei1, HAO Xuan-ming1, WANG Song-tao1, LI Han2
(1SouthChinaNormalUniversity,Guangzhou510631,China;2ChinaInstituteofSportScience,Beijing100061,China.E-mail:hxm@scnu.edu.cn)
AIM: To observe the effect of aerobic exercise and dietary patterns on the colonic function of type 2 diabetic rats and the enteric nervous mechanism.METHODSThe rat model of type 2 diabetes was induced by high-fat diet (HFD) and streptozotocin (30 mg/kg, ip) injection, and the rats were divided into diabetes control (DC) group, HFD group, exercise (E) group and exercise combined with high fat diet (E+HFD) group. Some other healthy rats were arranged into normal control (NC) group. The rats in E group and E+HFD group
8-week swimming training (5 d/week, 60 min/d). The colon samples were collected at the end of the 8th week for observation of the pathological changes by HE staining and for detection of colonic tension and expression of protein gene product 9.5(PGP9.5), substance P(SP) and vasoactive intestinal peptide (VIP).RESULTSDiabetes induced significant myenteric plexus damages and marked reduction of neurons, while exercise protected the enteric nervous system from injuries. The expression of SP significantly increased in the rats with long-term aerobic exercise combined with a reasonable diet. However, high-fat diet combined with exercise did not obviously up-regulate SP. The positive expression of VIP in the colon significantly increased in both E group and E+HFD group. Aerobic exercise attenuated the atrophy and increased the tension in colonic smooth muscles.CONCLUSIONDiabetes induces muscular atrophy and tension attenuation in colonic smooth muscle, which can be reversed in some extent by aerobic exercise through the remolding of enteric nervous system.
Diabetes mellitus; Myenteric plexus; Aerobic exercise; High-fat diet; Gastrointestinal disorder
R875
A
10.3969/j.issn.1000- 4718.2013.06.018
1000- 4718(2013)06- 1059- 06
2012- 12- 06
2013- 04- 01
华南师范大学研究生科研创新基金资助项目(No.2012kyjj116)
△通讯作者 Tel: 020-39310230; E-mail: hxm@scnu.edu.cn
