抑制小鼠HL-1心肌细胞桥粒斑蛋白基因表达对缝隙连接蛋白 43结构和功能的影响*
2013-10-24张黔桓邓春玉刘晓颖麦丽萍朱杰宁谭虹虹吴书林
张黔桓, 邓春玉, 饶 芳, 刘晓颖, 麦丽萍, 朱杰宁, 谭虹虹, 吴书林
(广东省人民医院心内科, 广东省心血管病研究所,广东 广州 510080)
抑制小鼠HL-1心肌细胞桥粒斑蛋白基因表达对缝隙连接蛋白 43结构和功能的影响*
张黔桓, 邓春玉, 饶 芳, 刘晓颖, 麦丽萍, 朱杰宁, 谭虹虹, 吴书林△
(广东省人民医院心内科, 广东省心血管病研究所,广东 广州 510080)
目的采用基因沉默技术抑制小鼠HL-1心肌细胞桥粒斑蛋白(DSP)基因表达以明确DSP与缝隙连接蛋白43(Cx43)的结构和功能关系。方法用基因沉默技术抑制DSP基因的表达,Western blotting和流式细胞术检测HL-1细胞DSP和Cx43蛋白的表达,用双免疫荧光方法检测DSP与Cx43蛋白的表达与定位情况,并用划痕标记染料示踪技术检测细胞缝隙连接通讯状况。结果与空白组和对照组相比,siRNA-DSP组的DSP和Cx43蛋白表达量降低(P<0.05)。免疫荧光检测发现空白组和对照组DSP与Cx43蛋白存在共定位情况,而siRNA-DSP组DSP和Cx43蛋白共定位遭到破坏,Cx43蛋白出现再分布,在细胞内检测到Cx43蛋白,并且划痕标记染料示踪技术检测发现siRNA-DSP组Lucifer yellow通过HL-1细胞缝隙连接的传输功能降低。结论DSP表达抑制不仅使Cx43出现再分布,而且影响缝隙连接传导功能。
缝隙连接蛋白 43; 桥粒斑蛋白; 基因沉默; HL-1细胞
桥粒是心肌闰盘的主要成份,与中间丝共同维持着心肌细胞之间的结构稳定性。桥粒斑蛋白(desmoplakin,DSP)是最大的桥粒蛋白,其N末端与其它桥粒蛋白如plakophilin-2(PKP2)和plakoglobin(PG)相连,C末端则与中间丝相连,在维持心肌细胞之间的结构和功能完整性方面发挥重要的作用。致心律失常性右室心肌病(arrhythmogenic right ventri-cular cardiomyopathy,ARVC)是一种遗传性心肌病,其主要的特征是起源于右室的致命性室性心律失常。约有40%的ARVC患者有一个或多个编码桥粒蛋白的基因发生突变,且桥粒突变的患者室性心律失常的发生率较高[1-2],但桥粒基因突变导致患者发生室性心率失常的确切机制并不清楚。缝隙连接蛋白43(connexin 43,Cx43)是人类心脏缝隙连接的主要亚型,在一些桥粒基因突变的患者中Cx43信号出现减弱[3]。Cx43是否参与和介导了桥粒基因突变致心律失常的分子机制并不清楚,需要进一步的研究来阐明。本研究采用基因沉默技术抑制HL-1心肌细胞DSP基因表达以明确DSP与Cx43的结构和功能关系。
材 料 和 方 法
1细胞
HL-1 细胞来源于小鼠的心肌细胞系AT-1,传5代以上,由王志国教授惠赠(加拿大Mcgill大学)。
2主要试剂
Claycomb培养基和新鲜牛血清购自Biosciences;0.05%typsin-EDTA购自Gibco;LipofectamineTM2000和荧光标记的Ⅱ抗(Alexa Flour® 488,羊抗兔)购自Invitrogen; Hoechst 33258和Lucifer yellow 荧光染料购自Sigma;ALL-in-OneTMQ-PCR Primer购自广州复能公司;PrimeScriptTMRT reagent Kit购自大连TaKaRa ;GoTaq® Green Master Mix试剂盒购自Promega;desmoplakinⅠ/Ⅱ多克隆抗体(兔来源)和GAPDH多克隆抗体(兔来源)购自Santa Cruz,desmoplakinⅠ/Ⅱ单克隆抗体(鼠来源)购自Abcam;HRP标记的Ⅱ抗(羊抗兔) 和HRP标记的Ⅱ抗(羊抗鼠)购自KPL;PE标记的Ⅱ抗(羊抗鼠)IgG购自杭州联科生物;荧光标记的Ⅱ抗(Alexa Flour® 647,羊抗鼠)和RIPA购自Cell Signaling Technology。DAPI购自Roche。
3主要方法
3.1HL-1细胞培养 向T25培养瓶中加入Claycomb培养基,每24~48 h更换。细胞长至完全融合后分瓶,0.05% trypsin-EDTA(37 ℃)冲洗,然后将液体去除。每个培养瓶另加1.3 mL trypsin-EDTA液,37 ℃孵化,加相同量的大豆胰蛋白酶抑制剂中和消化酶,将细胞转移到离心管中。用5 mL冲洗培养基(Claycomb培养基含5%胎牛血清和青/链霉素)冲洗空培养瓶,然后加到上述15 mL离心管中,500×g离心5 min,同时去除培养瓶中的凝胶/纤维结合素液,加入4 mL Claycomb培养基到每个瓶中。取出离心管,去上清,加入3ml Claycomb培养基,混匀。
3.2siRNA转染
3.2.1siRNA的合成 由上海吉玛公司合成针对小鼠DSP mRNA的siRNA 寡核苷酸,共有3对阳性序列,1对阴性对照,序列见表1。为检测siRNA 的转染效率,同时合成1对带荧光标记的阴性对照(FAM-siRNA)。
3.2.2siRNA转染 装有siRNA oligo的EP管离心(10 000 r/min、4 ℃)1 min,加入DEPC水配置成20 μmol/L的溶液,振荡溶解,4 ℃保存。转染前1 d,胰酶消化细胞并计数,细胞铺在24孔板上,使其在转染日密度为50%~70%。每孔细胞加入500 μL不含抗生素但含有血清的培养基。对于每孔细胞,使用50 μL Opti-MEMTM培养基稀释不同浓度梯度的siRNA溶液,再用50 μL Opti-MEMTM培养基稀1 μL LipofectamineTM2000试剂,分别装入2个EP管,室温下孵育5分钟后混合,孵育20 min。更换细胞培养基,加入无血清培养基500 μL,再加入上述siRNA和LipofectamineTM2000混合物,摇动混匀,在37 ℃、5% CO2的培养箱中孵育,6 h后更换含血清的生长培养基。以上操作均在超净工作台上完成,所有EP管和枪头均是RNase-free。转染FAM-siRNA时需要避光。
3.2.3Real-time PCR检测siRNA转染效率 HL-1细胞接种于6孔板,将实验分为6组:siRNA-DSP-Ⅰ组、siRNA-DSP-Ⅱ组、siRNA-DSP-Ⅲ组、空白组、脂质体组和siRNA-DSP-control组,转染48 h后提取细胞总RNA,real-time RT-PCR法检测各组细胞中 DSP mRNA的表达情况,方法如下:Trizol法提取细胞总RNA,配置逆转录反应液,反应条件为37 ℃ 15 min,85 ℃ 5 s,-20 ℃保存。PCR扩增的反应体系为:正义引物 (20 μmol/L) 1 μL,反义引物 (20 μmol/L) 1 μL,模板 DNA 2 μL,RNase-free dH2O 6 μL,ALL-in-OneTMQ-PCR Primer 10 μL。扩增条件为:预变性95 ℃ 10 min,95 ℃ 10 s,60 ℃ 20 s,72 ℃ 15 s。
3.2.4引物设计 从PubMed GenBank中获取小鼠DSP基因(NM_0238422)全序列,Primer Primier 5.0软件设计引物,广州复能公司合成引物,GAPDH作为内参照,各引物序列见表2。

表2 引物序列
3.3Western blotting检测DSP和Cx43蛋白的表达 HL-1细胞接种于6孔板,细胞转染120 h弃去培养基,预冷的PBS冲洗,每孔加入100 μL RIPA裂解液,同时加入蛋白酶抑制剂,冰上裂解30 min,收集裂解液,12 000 r/min离心20 min,去上清,分装后储存于-80 ℃。采用BCA蛋白定量中的标准液制定标准曲线,分光光度计测定细胞蛋白样本吸光度值,与标准曲线比较计算总蛋白含量。按照分子克隆第2版配方分别配制相应的浓缩胶和5%分离胶;取30 μg蛋白样本,加入4×SDS 上样缓冲液,总体积40 μL, 煮沸5 min变性后上样(35 μL),于Tris-甘氨酸电泳缓冲液中以120 V积层胶、180 V分离胶电泳至分离胶底端。然后将蛋白质从SDS聚丙烯酰胺凝胶转移至硝酸纤维膜,洗膜,封闭后,将硝酸纤维膜放入杂交袋中,加入以封闭液稀释至适当浓度的Ⅰ抗工作液(抗体以1∶200稀释),4 ℃过夜。TBST漂洗,加以TBST-M至适当浓度的辣根酶标记的相应Ⅱ抗工作液(1∶2 000),室温平缓摇动孵育2~3 h;漂洗后ECL Plus 检测。Western blotting结果扫描后用Quantity One软件分析,与内参照GAPDH相比较。
3.4双免疫荧光检测DSP和Cx43蛋白的定位和表达 多聚赖氨酸处理过的玻片,烘干后,高温消毒,放于6孔板中,HL-1细胞种植于6孔板的玻片上。细胞转染后120 h弃去培养基,用双免疫荧光方法检测DSP与Cx43的蛋白表达与定位情况。用冷PBS冲洗,甲醇-20 ℃固定,用0.5%Triton X-100透化;5%BSA室温封闭;PBS冲洗后先后加鼠DSP单克隆抗体(Ⅰ抗)和兔多克隆Cx43抗体(第2种Ⅰ抗),室温2 h或4 ℃过夜;然后冲洗后先后加荧光Ⅱ抗Alexa Flour® 647(羊抗鼠)和荧光Ⅱ抗Alexa Flour® 488(羊抗兔),37 ℃、60 min孵育;PBS冲洗,DAPI染核5 min,抗荧光衰减剂封片,在激光共聚焦显微镜下观察。
3.5划痕荧光实验检测缝隙连接功能 用划痕标记染料示踪技术(scrape loading and dye transfer,SLDT)检测细胞缝隙连接通讯状况。HL-1细胞接种于6孔板,转染后120 h弃培养基,用无血清培养基洗涤细胞,用手术刀轻轻划痕2~3 条,迅速滴加含0.05% Lucifer yellow的0.33 mol/L的Licl溶液2 mL,标记细胞3 min,用无血清培养基洗涤细胞3次,立即在荧光显微镜下观察细胞间荧光传输情况。有缝隙连通讯功能的细胞其标记染料可沿划痕区向外扩散,通过观察荧光染料扩散的距离或划痕区的荧光强度,即可直接反映细胞的缝隙连接功能状况。
4统计学处理
数据用均数±标准差(mean±SD)表示,多组间比较用One-way ANOVA方法检验。用SPSS 11.0统计软件分析,检验为双侧,以P<0.05为差异有统计学意义。
结 果
1FAM-siRNA转染效率的检测
不同浓度siRNA转染HL-1细胞,在激光共聚焦显微镜下观察,出现的绿色荧光强度不一,其中以FAM-siRNA终浓度为50 nmol/L时细胞中出现的绿色荧光最强,转染效率最高,因此选择50 nmol/L为本实验进行siRNA转染的终浓度。
2筛选最佳干扰效能的siRNA-DSP
HL-1细胞转染siRNA-DSP后24 h进行real-time PCR分析显示,siRNA-DSP-I组、siRNA-DSP-II组和siRNA-DSP-III组DSP mRNA表达抑制率分别为26%、24%和76%,表明siRNA-DSP-III具有明显的干扰作用,故选择siRNA-DSP-III进行后续实验。
3转染siRNA-DSP对HL-1细胞DSP蛋白表达的影响
HL-1细胞转染siRNA-DSP 48、72、96和120 h,siRNA-DSP组的DSP蛋白表达量降低,而空白组和siRNA-DSP-control组DSP蛋白表达量无明显改变,见图1。
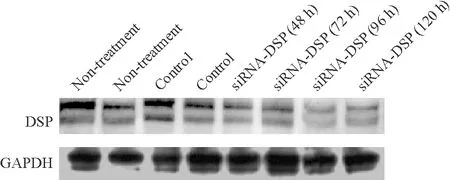
Figure 1. Western blotting assay for DSP and APDH (internal control) expression in HL-1 cells.
图1Westernblotting检测各组DSP蛋白的表达
4DSP基因沉默影响Cx43蛋白表达和定位
HL-1细胞转染siRNA-DSP 120 h后采用免疫荧光技术在激光共聚焦显微镜下观察DSP与Cx43蛋白的定位和表达,结果发现未处理组和对照组DSP与Cx43蛋白存在共定位情况,而siRNA-DSP组DSP和Cx43蛋白共定位则遭到破坏,Cx43蛋白出现再分布,并在细胞内检测到Cx43蛋白,见图2。
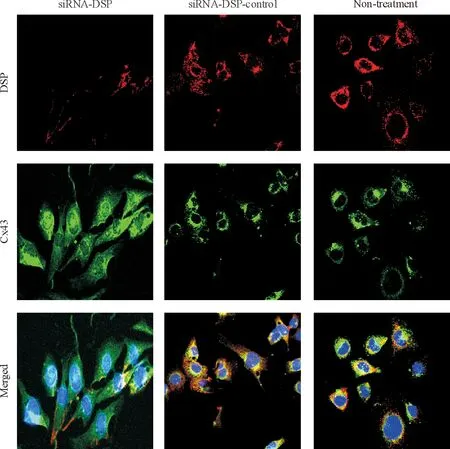
Figure 2. Immunofluorescence microscopy (×400) of HL-1 cells treated for 120 h with siRNA-DSP, non-targeting siRNA (siRNA-DSP-control), or without any siRNA(non-treatment).
图2HL-1转染siRNA-DSP120h后激光共聚焦显微镜下观察沉默DSP基因对Cx43蛋白分布的影响
HL-1细胞转染siRNA-DSP 120 h后用Western blotting检测DSP和Cx43蛋白的表达,与空白组和siRNA-DSP-control组相比,siRNA-DSP组的DSP和Cx43蛋白表达量降低,见图3。
5转染siRNA-DSP后HL-1细胞缝隙连接通讯功能的降低
HL-1细胞转染siRNA-DSP 120 h后发现与对照组和未处理组相比,Lucifer yellow通过HL-1细胞缝隙连接的传输功能降低,提示沉默DSP基因不仅使Cx43蛋白再分布,而且影响其组成的缝隙连接的功能。
讨 论
缝隙连接通过调节细胞间离子转运实现电偶联和机械信号的传递,而黏附连接和桥粒则为缝隙连接提供机械稳定性,它们三者位于心肌细胞闰盘中[4]。缝隙连接由2个半通道或连接子(connexons)组成,位于邻近细胞的胞质膜,该连接子是由6个亚基组成,其中Cx43是人类心脏的主要亚型,但是Cx40和Cx45也有较低水平的表达。
桥粒结构完整性遭到破坏会影响缝隙连接的结构和功能。最初在Naxos病和Carvajal综合征患者中发现Cx43在缝隙连接处的表达减少[5-6],而这些患者除了心脏结构改变外,还伴有皮肤和毛发的改变。最近,Filder等[7]在PKP2突变(R635W)患者的心肌组织中发现Cx43信号减弱,而Oxford等[8]则在体外培养的心肌细胞中证实PKP2表达的抑制可以减少Cx43蛋白的表达。
目前研究表明Cx43直接或间接地与β-catenin、p120-catenin和位于心肌闰盘的钠通道复合物等之间有关联[9],虽然这些蛋白之间的相互作用不清楚,但Cx43可能在细胞间的信号传递中起作用。Ai等[10]研究发现经典信号通道上的Wnt-1蛋白可调节Cx43 的表达,缝隙连接的重塑可使Wnt-1和Cx43表达下调,而在Cx43表达缺陷的小鼠易发生室性心律失常,Cx43表达完全丧失的小鼠则可导致右室流出道梗阻和围产期死亡。此外,Cx43与HSP90(与心肌细胞凋亡有关)之间有交互作用[11]。由于心肌细胞的传导速度部分是由缝隙连接的功能完整性决定的,Cx43的分布不均衡可能会导致传导速度的异质性,这有利于折返形成从而导致心律失常。本实验发现沉默HL-1细胞的DSP基因,不仅使Cx43蛋白出现再分布,而且影响其组成的缝隙连接功能。本研究首次证明了DSP蛋白的表达抑制与Cx43的再分布及细胞间通讯传导功能异常有关。

Figure 3. Western blotting for DSP and Cx43 expression in HL-1 cells treated for 48 and 120 h with siRNA-DSP, non-targeting siRNA (control), or without any siRNA (non-treatment).Mean±SD.n=3.*P<0.05vscontrol group.
图3Westernblotting检测各组细胞DSP和Cx43蛋白的表达
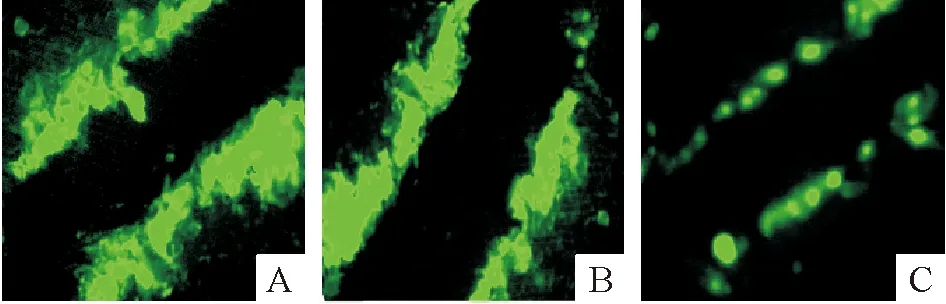
Figure 4. Scrape loading and dye transfer analysis of the coupling between cultured HL-1 cells(×400).A:non-treatment;B:siNA-DSP-control;C:siRNA-DSP.
图4荧光显微镜下观察LuciferYellow通过HL-1细胞缝隙连接的传输情况(5min)
DSP在维持桥粒结构的稳定性中起着重要作用,其由3部分组成:球状头部、螺旋状的中间部分和尾部。球状头部与其它桥粒蛋白如PKP2和PG相连,在蛋白之间相互作用方面起着关键作用。在敲除DSP蛋白球状头部的转基因小鼠中发现心肌细胞凋亡、纤维化和脂肪累积,同时心室腔扩大[12],这与人类ARVC的表现一致。目前有关DSP与Cx43相互作用的研究很少,Czyz等[11]发现 Cx43与PKP2共同存在一个大分子的复合物中,而在Carvajal综合征的患者中证实DSP基因突变可能会导致DSP与其它蛋白如PKP2和PG之间的相互作用发生改变,尽管需要进一步的研究来证实,但由此可以推论PKP2是连接DSP与Cx43的关键结构,DSP与Cx43也可能存在于一个大分子复合物中,它们共同维持着心肌闰盘结构和功能的稳定。
本实验用免疫荧光技术证实在HL-1细胞中DSP和Cx43能共定位,但如果DSP表达下调,这种共定位特征就会丧失,Cx43出现再分布,并在HL-1细胞内检测到Cx43信号。目前尚不清楚在细胞内的Cx43其成分是否与位于缝隙连接的成分一致,细胞内的Cx43与其它闰盘结构成分的关系如何并不得而知,而且在心肌细胞中Cx43有磷酸化和非磷酸化结构,两者与DSP的关系如何也尚不明确,因此这需要进一步的研究来阐明DSP与Cx43两者的关系。
本实验采用划痕标记染料示踪技术检测细胞缝隙连接通讯状况,结果发现沉默HL-1细胞DSP基因,Lucifer Yellow通过缝隙连接的传输功能降低,提示DSP表达抑制不仅使Cx43出现再分布,而且影响其传导功能。虽然目前尚不能明确缝隙连接传导功能的破坏就一定会导致心律失常,但既往的研究表明Cx43的结构受损会导致传导速度减慢,如在缺血情况下就会导致心律失常[13]。缝隙连接不仅是电传导的主要结构,而且还具有分子信号转导功能[14],其结构和功能的完整性在维持心肌细胞整体平衡方面起着重要作用,如遭到破坏可能会导致心肌细胞凋亡和纤维化。动物模型的研究证实室壁心肌复极时间和不应期离散度与心律失常发生有关[15]。本研究只是对缝隙连接功能的初步探索,而位于心肌细胞闰盘结构的离子通道是否也有改变则需要进一步研究证实。
Cx43可能参与了ARVC发病机制的多个环节:缝隙连接的结构破坏、电偶联机制的丧失和影响Wnt/β-caternin信号转导通路。本研究证实了DSP的表达抑制使Cx43再分布,缝隙连接的转导功能受损,因此对Cx43在ARVC中致病作用的研究需要进一步的探索。
[1] Watkins DA, Hendricks N, Shaboodien G, et al. Clinical features, survival experience, and profile of plakophylin-2 gene mutations in participants of the Arrhythmogenic Right Ventricular Cardiomyopathy Registry of South Africa[J]. Heart Rhythm, 2009,6(11 Suppl):S10-S17.
[2] Xu T, Yang Z, Vatta M, et al. Compound and digenic heterozygosity contributes to arrhythmogenic right ventricular cardiomyopathy[J]. J Am Coll Cardiol, 2010,55 (6):587-597.
[3] Asimaki A, Tandri H, Huang H, et al. A new diagnostic test for arrhythmogenic right ventricular cardiomyopathy[J]. N Engl J Med, 2009,360(11):1075-1084.
[4] Li K, Chi Y, Gao K, et al. Connexin43 hemichannel-mediated regulation of connexin43[J]. PLoS One, 2013,8 (2):e58057.
[5] Norgett EE, Hatsell SJ, Carvajal-Huerta L, et al. Recessive mutation in desmoplakin disrupts desmoplakin-intermediate filament interactions and causes dilated cardiomyopathy, woolly hair and keratoderma[J]. Hum Mol Genet, 2000,9(18):2761-2766.
[6] Kaplan SR, Gard JJ, Protonotarios N, et al. Remodeling of myocyte gap junctions in arrhythmogenic right ventricular cardiomyopathy due to a deletion in plakoglobin (Naxos disease)[J]. Heart Rhythm, 2004,1(1):3-11.
[7] Fidler LM, Wilson GJ, Liu F, et al. Abnormal conne-xin43 in arrhythmogenic right ventricular cardiomyopathy caused by plakophilin-2 mutations[J]. J Cell Mol Med, 2009,13(10):4219-4228.
[8] Oxford EM, Everitt M, Coombs W, et al. Molecular composition of the intercalated disc in a spontaneous canine animal model of arrhythmogenic right ventricular dyspla-sia/cardiomyopathy[J]. Heart Rhythm, 2007,4(9):1196-1205.
[9] Noorman M, Hakim S, Kessler E, et al. Remodeling of the cardiac sodium channel, connexin43, and plakoglobin at the intercalated disk in patients with arrhythmogenic cardiomyopathy[J]. Heart Rhythm, 2013,10(3):412-419.
[10] Ai Z, Fischer A, Spray DC, et al. Wnt-1 regulation of connexin43 in cardiac myocytes[J]. J Clin Invest, 2000,105(2):161-171.
[11] Czyz J, Guan K, Zeng Q, et al. Loss of beta 1 integrin function results in upregulation of connexin expression in embryonic stem cell-derived cardiomyocytes[J]. Int J Dev Biol, 2005,49(1):33-41.
[12] Noorman M, van der Heyden MA, van Veen TA, et al. Cardiac cell-cell junctions in health and disease: Electrical versus mechanical coupling[J]. J Mol Cell Cardiol, 2009,47(1):23-31.
[13] Thomas SP, Kucera JP, Bircher-Lehmann L, et al. Impulse propagation in synthetic strands of neonatal cardiac myocytes with genetically reduced levels of connexin43[J]. Circ Res, 2003,92(11):1209-1216.
[14] Goldberg GS, Valiunas V, Brink PR. Selective permeability of gap junction channels[J]. Biochim Biophys Acta, 2004,1662(1-2):96-101.
[15] 谭含旋,初红霞,樊静静,等. 心力衰竭犬跨室壁心肌复极时间和不应期离散度的致心律失常机制研究[J]. 中国病理生理杂志,2011,27(3):417-424.
Inhibitionofdesmoplakinexpressioninducesconnexin43remodelinginmouseHL-1myocardialcells
ZHANG Qian-huan, DENG Chun-yu, RAO Fang, LIU Xiao-ying, MAI Li-ping, ZHU Jie-ning, TAN Hong-hong, WU shu-lin
(DepartmentofCardiology,GuangdongGeneralHospital,GuangdongCardiovascularInstitute,Guangzhou510100,China.E-mail:wushulind@gmail.com)
AIM: To evaluate the content, distribution, and function of connexin 43 (Cx43) gap junctions in mouse HL-1 myocardial cells under the condition of desmoplakin (DSP) silencing.METHODSThe technique of RNA interference was used to inhibit the protein expression of DSP in HL-1 cells. The protein expression of DSP and Cx43 was analyzed by Western blotting and flow cytometry. The immunofluorescence staining was used to detect the distribution and co-localization of DSP and Cx43. The techniques of scrape loading and dye transfer were also used to determine the function of Cx43 gap junctions.RESULTSCompared with non-treatment group and negative control group, the protein expression of DSP and Cx43 was reduced (P<0.05). Co-localization to the site of cell-cell contact was apparent in untreated and control conditions, but loss of DSP expression induced by siRNA-DSP correlated with a drastic redistribution of Cx43. Instead, Cx43 was found mostly within the intracellular space. The results of dye transfer assay indicated a significant decrease in the function of Cx43 gap junctions of the cells treated with siRNA-DSP.CONCLUSIONInhibition of DSP expression induces redistribution of Cx43 and decrease in dye coupling between cells.
Connexin 43; Desmoplakin; Gene silencing; HL-1 cells
R542.2
A
10.3969/j.issn.1000- 4718.2013.06.004
1000- 4718(2013)06- 0982- 06
2013- 03- 22
2013- 05- 15
广东省自然科学基金资助项目(No. 10151008002000011)
△通讯作者 Tel: 020-83827812; E-mail: wushulind@gmail.com
