脂肪间充质干细胞对野百合碱诱发的肺动脉高压大鼠肺动脉钙离子通道的影响*
2013-10-24郑苏梨谢良地李宏亮梁敏烈许昌声
郑苏梨, 谢良地, 李宏亮, 梁敏烈, 许昌声
(福建医科大学附属第一医院,福建省高血压研究所,福建 福州 350005)
·论著·
脂肪间充质干细胞对野百合碱诱发的肺动脉高压大鼠肺动脉钙离子通道的影响*
郑苏梨, 谢良地△, 李宏亮, 梁敏烈, 许昌声
(福建医科大学附属第一医院,福建省高血压研究所,福建 福州 350005)
目的探讨脂肪间充质干细胞(adipose tissue-derived mesenchymal stem cells,ADMSCs)移植对野百合碱(monocrotaline,MCT)诱发的肺动脉高压(pulmonary arterial hypertension,PAH)大鼠肺动脉钙离子通道的影响。方法胶原酶消化法分离培养ADMSCs。雄性SD大鼠24只,分为正常对照组(Ctr组)、PAH组和ADMSCs组,每组8只。右心导管法测定大鼠的平均肺动脉压(MPAP);称重法测右心室肥厚指数(RVHI);分别用RT-PCR及Western blotting法测定大鼠肺动脉干电压门控性钙离子通道α1c亚基(CaVα1c)肌浆/内质网Ca2+ATP酶2a(SERCA-2a)、三磷酸肌醇受体1(IP3R-1)、瞬时受体电位通道1(TRPC1)和TRPC6 mRNA和蛋白的表达水平。结果(1)MCT注射4周后,与Ctr组相比, PAH组大鼠MPAP和RVHI均显著升高(P<0.05);ADMSCs移植2周后,与PAH组相比,ADMSCs组MPAP和RVHI均明显降低(P<0.05)。(2)与Ctr组相比,PAH组大鼠肺动脉CaVα1c、TRPC1和TRPC6 mRNA及蛋白表达水平均明显增强(P<0.05),SERCA-2a 和IP3R-1 mRNA及蛋白表达水平均明显降低(P<0.05);与PAH组相比,ADMSCs组CaVα1c、TRPC1和TRPC6的表达均明显降低(P<0.05),SERCA-2a 和IP3R-1的表达均明显增强(P<0.05)。结论ADMSCs能有效地降低MCT诱发的PAH大鼠的肺动脉压力,减轻右心室肥厚。ADMSCs降低肺动脉压力可能与钙离子通道变化有关。
脂肪间充质干细胞; 肺动脉高压; 钙通道
肺动脉高压(pulmonary arterial hypertension,PAH)是一种难治性疾病,以肺动脉压力和肺血管阻力升高为主要特点,可逐渐进展为右心室衰竭,甚至死亡。肺血管重构,最终导致肺小动脉管腔的阻塞,是肺动脉高压的主要发病机制[1]。肺动脉平滑肌细胞内游离Ca2+浓度(intracellular free calcium,[Ca2+]i)升高是引起肺血管收缩的重要因素。电压门控性钙离子通道α1c亚基(voltage-gated calcium channel α1c subunit, CaVα1c)、肌浆/内质网Ca2+ATP酶 2a(sarcoplasmic/endoplasmic reticulum cal-cium ATPase 2a,SERCA-2a)、三磷酸肌醇受体 1(inositol 1,4,5-triphosphate receptor 1, IP3R-1)和瞬时受体电位通道[2](transient receptor potential channel,TRPC)是调节[Ca2+]i的重要钙离子通道亚基。我们先前的研究证实[3],PAH大鼠肺动脉存在CaVα1c、SERCA-2a和IP3R-1的表达异常。目前用于治疗PAH的药物主要有钙离子通道阻滞剂、前列腺素类、内皮素受体拮抗剂、磷酸二酯酶抑制剂等,但疗程长,费用昂贵,而且疗效有限。近年来,国内外一些研究表明移植干细胞有助于改善肺血管的内皮功能,降低肺动脉压力并且改善肺小动脉的重构[4-6]。脂肪间充质干细胞(adipose tissue-derived mesenchymal stem cells,ADMSCs)是从脂肪组织中分离出的多潜能干细胞,具有促进血管生成、抑制炎症等特性[7-8]。而且,ADMSCs来源丰富,易获取,无伦理学上的限制,具有良好的应用前景。本文主要研究ADMSCs移植对野百合碱(monocrotaline,MCT)诱导的PAH大鼠肺动脉钙离子通道的影响,探讨ADMSCs治疗PAH的可能性及其机制。
材 料 和 方 法
1脂肪间充质干细胞的培养
无菌条件下取雄性SD大鼠(100~150 g,上海斯莱克实验动物有限责任公司)双侧腹股沟皮下脂肪,参照文献[9-10]报道的方法分离培养ADMSCs。取生长良好的第3代ADMSCs,融合达50%时,加入感染复数为100的Ad5-EGFP重组腺病毒感染ADMSCs。
2动物分组及肺动脉高压模型建立
雄性SD大鼠24只(200~230 g,上海斯莱克实验动物有限责任公司),随机分为3组,每组8只:正常对照组(Ctr组)、MCT诱导组(PAH组)和MCT诱导+ADMSCs治疗组(ADMSCs组)。PAH组和ADMSCs组均按文献报道[11-12]的方法配制MCT(Sigma),予腹腔一次性注射40 mg/kg,正常对照组给予等体积生理盐水腹腔注射。
3脂肪间充质干细胞移植
MCT注射后2周,胰酶消化绿色荧光标记的ADMSCs,调整细胞悬液密度为1×109cells/L,ADMSCs组经颈外静脉移植ADMSCs细胞1 mL,链霉素1×105U肌肉注射预防感染。Ctr组及PAH组给予等体积生理盐水。实验结束后,取ADMSCs组肺组织行冰冻切片,观察绿色荧光标记细胞在肺组织中的定植。
4血流动力学检测
按孙波等[13]的报道,在本实验室建立测定大鼠平均肺动脉压(mean pulmonary arterial pressure, MPAP)的方法,MCT注射4周后测量各组MPAP。
5肺组织HE染色切片制作
血流动力学检测后,打开胸腔取出整个心肺,肺动脉干保存在液氮罐内,右肺中叶组织块以10%甲醛溶液固定1 d。常规石蜡包埋,沿右肺门水平横切,片厚5 μm。切片进行HE染色,制成病理切片。光镜下观察肺小动脉病变。
6右心室肥厚指数(rightventricularhypertrophyindex,RVHI)的测定
取出整个心脏,沿房室沟剪去心房及大血管根部,用剪刀沿后室壁间沟将右心室切下,滤纸吸水后称右心室游离壁(right ventricular,RV)及左心室+室间隔(left ventricular and ventricular septum,LV+S)的重量,并计算RVHI:RVHI=RV/(LV+S)。
7RT-PCR检测
从液氮中取出肺动脉干,采用Invitrogen公司Trizol试剂盒提取总RNA,752-C紫外分光光度计测定其纯度及含量。按照Promega公司试剂盒说明书进行cDNA第1链的合成,采用Primer 3.0软件设计PCR引物(表1),进行扩增(MyGene 32 Thermal Block PCR仪)。以大鼠GAPDH mRNA为内参照,进行半定量分析,比值表示其相对含量。

表1 RT-PCR引物序列
8Westernblotting检测
提取总蛋白后,Bradford法测定各样品蛋白质浓度,经SDS-PAGE分离,1 mA/cm2转膜,5%脱脂奶粉中室温下封闭1 h,抗CaVα1c抗体(1∶200,Alomone Labs)和抗SERCA-2a抗体(1∶1 000,Abcam)、抗IP3R-1抗体(1∶1 000,Millipore)、抗TRPC1抗体(1∶200,Alomone Labs)和抗TRPC6抗体(1∶200,Alomone Labs)4 ℃孵育过夜。加入辣根过氧化物酶(HRP)标记的Ⅱ抗(1∶2 000,北京中杉金桥生物技术有限公司),37 ℃孵育1 h,电化学发光法(ECL)显影。以β-actin作为内参照,进行半定量分析,比值表示其相对含量。
9统计学处理
数据以均数±标准差(mean±SD)表示。采用SPSS 11.5统计软件分析。组间均数比较采用One-way ANOVA检验。以P<0.05为差异有统计学意义。
结 果
1ADMSCs治疗对MCT诱发的PAH大鼠血流动力学的影响
与Ctr组相比,PAH组的MPAP及RVHI均明显升高(P<0.01);与PAH组相比,ADMSCs组MPAP及RVHI均显著降低(P<0.01),见表2。
表2ADMSCs治疗对大鼠血流动力学的影响
Table 2. Effects of ADMSCs transplantation on mean pulmonary arterial pressure (MPAP) and right ventricular hypertrophy index (RVHI) of rats (Mean±SD.n=8)

GroupMPAP(mmHg)RVHICtr15.03±0.8725.67±1.26PAH32.22±0.71**53.44±2.13**ADMSCs21.87±0.78△△38.97±1.59△△
**P<0.01vsCtr group;△△P<0.01vsPAH group.
2肺小动脉显微结构观察
Ctr组大鼠肺小动脉管壁厚薄一致,管腔内膜结构完整,血管周围仅有少量结缔组织,见图1A;PAH组大鼠肺小动脉管壁增厚、管腔缩小,管腔内膜结构不完整或断裂,血管周围有大量结缔组织增生,管壁有大量细胞浸润,见图1B;ADMSCs组大鼠肺小动脉管壁厚度轻度增加,较均匀,管腔缩小不明显,见图1C。
3ADMSCs在大鼠肺组织定植
冰冻切片荧光观察, ADMSCs组大鼠的肺组织血管中可见绿色荧光细胞分布,Ctr组大鼠的肺组织未见绿色荧光信号,见图2。
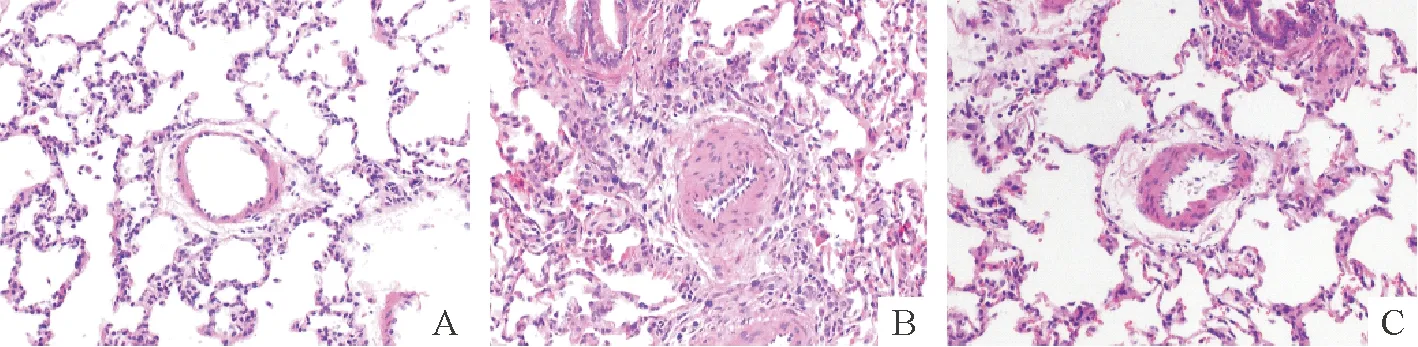
Figure 1. Effects of ADMSCs on histological changes of small pulmonary arteries (HE staining,×100). A: Ctr group;B: PAH group;C: ADMSCs group.
图1大鼠肺小动脉组织学改变

Figure 2. GFP-labeled ADMSCs were observed in pulmonary tissues (×200).A,B:Ctr group;C,D:ADMSCs group.A,C:phase-contrast images;B,D:fluorescence images.The white arrow indicates GFP-labeled ADMSCs.
图2GFP标记的ADMSCs定植于肺组织的荧光显微镜观察
4ADMSCs治疗对MCT诱发的PAH大鼠肺动脉钙离子通道mRNA及蛋白的影响
4.1ADMSCs对PAH大鼠肺动脉CaVα1c表达的影响 与Ctr组相比,PAH组肺动脉CaVα1c mRNA及蛋白表达明显增强(P<0.01)。ADMSCs组的CaVα1c表达水平较PAH组明显降低(P<0.05),见图3。
4.2ADMSCs对PAH大鼠肺动脉SERCA-2a表达的影响 与Ctr组相比,PAH组肺动脉SERCA-2a mRNA及蛋白表达明显降低(P<0.05)。与PAH组相比,ADMSCs组的SERCA-2a表达水平明显增高(P<0.05),见图4。
4.3ADMSCs对PAH大鼠肺动脉IP3R-1表达的影响 与Ctr组相比,PAH组肺动脉IP3R-1 mRNA及蛋白表达明显降低(P<0.05)。与PAH组相比,ADMSCs组的IP3R-1表达水平明显增高(P<0.05),见图5。
4.4ADMSCs对PAH大鼠肺动脉TRPC1表达的影响 与Ctr组相比,PAH组肺动脉TRPC1 mRNA及蛋白表达明显增高(P<0.05)。与PAH组相比,ADMSCs组的IP3R-1表达水平明显降低(P<0.05),见图6。
4.5ADMSCs对PAH大鼠肺动脉TRPC6表达的影响 与Ctr组相比,肺动脉高压组肺动脉TRPC6 mRNA及蛋白表达明显增高(P<0.05)。与PAH组相比,ADMSCs组的TRPC6表达水平明显降低(P<0.05),见图7。
讨 论
本研究采用MCT成功诱导了PAH模型,PAH组MPAP和RVHI均明显高于Ctr组,HE染色可见肺小动脉管壁增厚、管腔缩小,管腔内膜结构破坏,血管周围结缔组织增生。本研究发现,移植绿色荧光蛋白标记的ADMSCs后,大鼠肺组织血管中可检测到荧光,说明ADMSCs定植在大鼠的肺组织内。陈明等[14]利用腺病毒感染标记ADMSCs,经静脉移植后可归巢于宿主特定组织并分化为内皮细胞,并认为ADMSCs对血管内皮有修复功能。本研究移植ADMSCs后,发现MPAP和RVHI较PAH组明显降低,肺小动脉管壁结构改善,内膜完整,管腔面积扩大,说明ADMSCs可能通过定植并分化为内皮细胞,修复血管内皮屏障而起到延缓肺动脉高压进展的作用。何志旭等[15]经静脉移植骨髓间充质干细胞后发现,其可定植于肺间质,通过形成新生血管建立侧枝循环,有效减轻MCT诱导的肺动脉高压和肺组织病变程度。Liu等[16]研究也发现,移植自体脂肪间充质细胞可降低PAH大鼠平均肺动脉压,改善肺小血管重构,同时肝细胞生长因子及一氧化氮合酶表达增加,进而促进肺血管再生。近年来对脂肪干细胞分泌蛋白质组的研究也发现[17-19],脂肪干细胞可分泌血管内皮生长因子、转化生长因子、肝细胞生长因子等多种可溶性因子,在血管生成、组织修复过程中发挥了重要作用。

Figure 3. Effects of ADMSCs transplantation on CaVα1c mRNA (A) and protein (B) levels in pulmonary hypertensive rats. Mean±SD.n=5.**P<0.01vsCtr group;△P<0.05vsPAH group.
图3ADMSCs对PAH大鼠肺动脉CaVα1cmRNA及蛋白表达水平的影响

Figure 4. Effects of ADMSCs transplantation on SERCA-2a mRNA (A) and protein (B) levels in pulmonary hypertensive rats. Mean±SD.n=5.*P<0.05vsCtr group;△P<0.05vsPAH group.
图4ADMSCs对PAH大鼠肺动脉SERCA-2amRNA及蛋白表达水平的影响
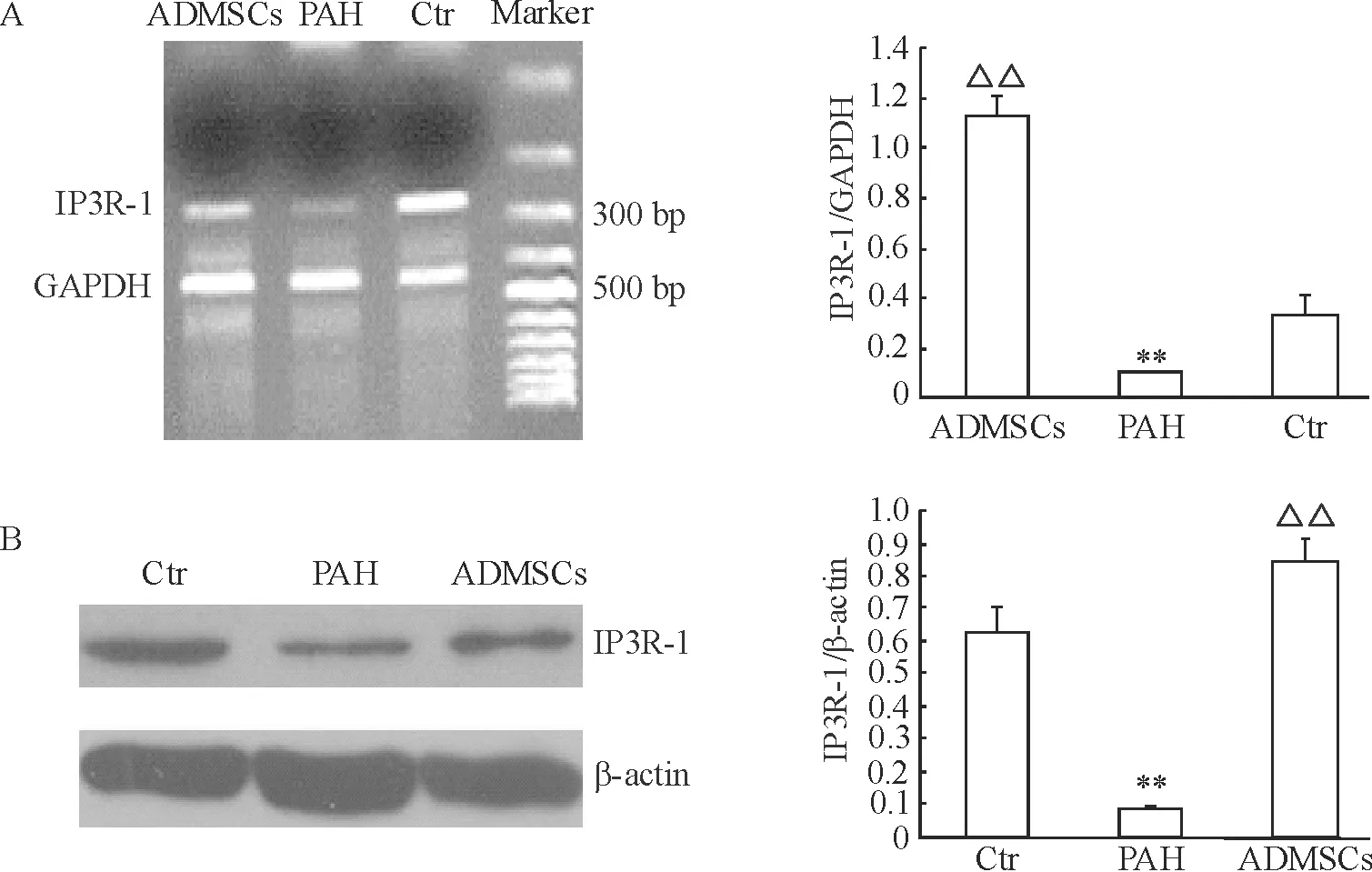
Figure 5. Effects of ADMSCs transplantation on IP3R-1 mRNA (A) and protein (B) levels in pulmonary hypertensive rats. Mean±SD.n=5.**P<0.01vsCtr group;△△P<0.01vsPAH group.
图5ADMSCs对PAH大鼠肺动脉IP3R-1mRNA及蛋白表达水平的影响

Figure 6. Effects of ADMSCs transplantation on TRPC1 mRNA (A) and protein (B) levels in pulmonary hypertensive rats. Mean±SD.n=5.*P<0.05vsCtr group;△P<0.05vsPAH group.
图6ADMSCs对PAH大鼠肺动脉TRPC1mRNA及蛋白表达水平的影响

Figure 7. Effects of ADMSCs transplantation on TRPC6 mRNA (A) and protein (B) levels in pulmonary hypertensive rats. Mean±SD.n=5.*P<0.05vsCtr group;△P<0.05vsPAH group.
图7ADMSCs对PAH大鼠肺动脉TRPC6mRNA及蛋白表达水平的影响
目前研究认为PAH引起MPAP增高与肺血管痉挛收缩及重构密切相关[20],也有研究认为血管壁增厚、血管重构与平滑肌细胞钙离子通道表达异常有关[21]。Roberto等[22]研究发现,增殖型平滑肌细胞中IP3R、TRPC1、TRPC6等钙离子通道蛋白表达明显升高;Liu等[23]研究还发现,PAH大鼠肺动脉TRPC1和TRPC6表达明显升高;Dinesh等[24]研究发现CaVα1c表达上调与RVHI增加及管壁增厚有关;Katharina等[25]认为SERCA表达下调导致平滑肌细胞过度增殖。本研究发现,与Ctr组相比,PAH组CaVα1c、TRPC1和TRPC6表达明显增高,SERCA-2a和IP3R-1表达明显降低。IP3R可引起肌浆网及内质网中钙离子释放,并通过“钙诱导钙释放”途径使得钙离子持续释放,亦诱导其它钙离子通道的开放,另外细胞膜上CaVα1c、TRPC1和TRPC6等钙离子通道表达的增加,可引起细胞外钙离子内流增加,导致细胞内游离钙离子浓度升高。而肌浆网及内质网上的SERCA-2a表达减少,导致钙离子泵回减少,使得细胞内游离钙离子浓度进一步升高。本实验中,随着肺动脉高压的进展,细胞内游离钙离子浓度处于持续高浓度状态,反而抑制了IP3R的表达,Haeri等[26]也认为,IP3R与钙离子浓度间存在非线性关系,高浓度的钙离子对IP3R有抑制作用。同时,我们还发现,与PAH组相比,ADMSCs组CaVα1c、TRPC1和TRPC6表达明显降低(P<0.05),SERCA-2a 和IP3R-1表达较PAH组明显增强(P<0.05),提示ADMSCs可调节钙离子通道的表达。遗憾的是,本实验没有动态观察肺动脉高压进展过程中钙离子通道的变化及细胞内游离钙离子浓度的变化。
总之,本研究证实肺动脉高压时存在钙离子通道表达异常,可导致细胞内游离钙离子浓度升高促进肺血管收缩。我们推测ADMSCs通过调节钙离子通道表达,进而调节细胞内游离钙离子浓度而延缓肺动脉高压的进展。但本研究中ADMSCs对钙离子通道的影响是由于其组织修复作用还是继发于肺动脉压力下降后的作用仍未明确,有待进一步深入研究。
[1] Yi ES, Kim H, Ahn H,et al. Distribution of obstructive intimal lesions and their cellular phenotypes in chronic pulmonary hypertension: a morphometric and immunohistochemical study[J]. Am J Respir Crit Care Med, 2000,162(4 Pt 1):1577-1586.
[2] Guibert C,Ducret T,Savineau JP.Expression and physiological roles of TRP channels in smooth muscle cells[J]. Adv Exp Med Biol,2011,704:687-706.
[3] Xie LD, Lin PS, Xie H, et al. Effects of atorvastatin and losartan on monocrotaline- induced pulmonary artery remodeling in rats [J]. Clin Exp Hypertens, 2010,32 (8): 547-554.
[4] Zhao Q,Liu Z,Wang Z,et al.Effect of prepro-calcitonin gene-related peptide-expressing endothelial progenitor cells on pulmonary hypertension[J]. Ann Thorac Surg,2007, 84(2):544-552.
[5] Raoul W,Wagner-Ballon O,Saber G,et al.Effects of bone marrow-derived cells on monocrotaline- and hypoxia-induced pulmonary hypertension in mice[J].Respir Res,2007,8:8.
[6] Zeng C, Wang X, Hu X,et al. Autologous endothelial progenitor cells transplantation for the therapy of primary pulmonary hypertension[J].Med Hypotheses, 2007,68(6):1292-1295.
[7] Loche M, Feisst V, Dunbar PR, et al.Human adipose-derived stem cells: separating promise from clinical need[J].Stem Cells,2011,29(3):404-411.
[8] Mizuno H,Tobita M,Uysal AC.Adipose-derived stem cells as a novel tool for future regenerative medicine[J].Stem Cells,2012,30(5):804-810.
[9] 庄 伟,谢良地,黄 杰,等.人脂肪组织基质血管组分的分离培养[J].福建医科大学学报,2008, 42(3): 256-258.
[10] 连 帆,王 于,范文哲,等.经肝动脉同种异体脂肪干细胞移植治疗小鼠自身免疫性肝炎的实验研究[J].中国病理生理杂志,2011,27(7):1389-1392.
[11] 刘 斌,王献民,魏 丽,等.4种肺动脉高压动物模型肺血管重构模式的差异研究[J].中国病理生理杂志,2008,24(2):289-293.
[12] 林培森,谢良地,许昌声. 地尔硫卓及贝那普利对野百合碱诱发的肺动脉高压大鼠肺动脉重构的影响[J].中华高血压杂志,2011, 19(7):636-641.
[13] 孙 波,刘文利.右心导管测定大鼠肺动脉压的实验方法[J].中国医学科学院学报,1984,6(6):465-467.
[14] 陈 明,谢良地,谢镇国,等.脂肪间充质干细胞的归巢研究[J].中华心血管病杂志,2011,39(5 Suppl):455.
[15] 何志旭,汪浩文,尚 峰,等.骨髓间充质干细胞治疗实验性肺动脉高压后肺组织结构的变化[J].中国病理生理杂志,2009,25(10):1907-1911.
[16] Liu K, Liu R, Cao G, et al. Adipose-derived stromal cell autologous transplantation ameliorates pulmonary arterial hypertension induced by shunt flow in rat models[J]. Stem Cells Dev,2011,20(6):1001-1010.
[17] Salgado AJ, Reis AL, Sousa NJ, et al. Adipose tissue derived stem cells secretome: Soluble factors and their roles in regenerative medicine[J]. Curr Stem Cell Res Ther,2010,5(2):103-110.
[18] Rehman J, Traktuev D, Li J, et al.Secretion of angiogenic and antiapoptotic factors by human adipose stromal cells[J].Circulation,2004,109(10):1292-1298.
[19] Nakagami H, Maeda K, Morishita R, et al. Novel autologous cell therapy in ischemic limb disease through growth factor secretion by cultured adipose tissue-derived stromal cells[J]. Arterioscler Thromb Vasc Biol,2005,25(12): 2542-2547.
[20] Jeffery TK, Morrell NW. Molecular and cellular basis of pulmonary vascular remodeling in pulmonary hypertension[J].Prog Cardiovasc Dis,2002,45(3):173-202.
[21] Kuhr FK, Smith KA, Song MY, et al.New mechanisms of pulmonary arterial hypertension: role of Ca2+signaling [J].Am J Physiol Heart Circ Physiol,2012,302(8): H1546-H1562.
[22] Berra-Romani R, Mazzocco-Spezzia A, Pulina MV, et al. Ca2+handling is altered when arterial myocytes progress from a contractile to a proliferative phenotype in culture[J]. Am J Physiol Cell Physiol,2008,295(3): C779-C790.
[23] Liu XR, Zhang MF, Yang N, et al. Enhanced store-operated Ca2+entry and TRPC channel expression in pulmonary arteries of monocrotaline-induced pulmonary hypertensive rats[J]. Am J Physiol Cell Physiol,2012,302(1): C77-C87.
[24] Hirenallur-S DK, Haworth ST, Leming JT,et al. Upregulation of vascular calcium channels in neonatal piglets with hypoxia-induced pulmonary hypertension [J].Am J Physiol Lung Cell Mol Physiol,2008,295(5):L915-L924.
[25] Mahn K, Hirst SJ, Ying S, et al. Diminished sarco/endoplasmic reticulum Ca2+ATPase(SERCA) expression contributes to airway remodelling in bronchial asthma [J]. Proc Natl Acad Sci U S A, 2009,106(26):10775-10780.
[26] Haeri HH, Hashemianzadeh SM, Monajjemi M. A kinetic Monte Carlo simulation study of inositol 1,4,5-trisphosphate receptor (IP3R) calcium release channel[J]. Comput Biol Chem,2007,31(2):99-109.
Effectsofadiposetissue-derivedmesenchymalstemcellsoncalciumchannelsofpulmonaryarteryinratswithpulmonaryarterialhypertensioninducedbymonocrotaline
ZHENG Su-li, XIE Liang-di, LI Hong-liang, LIANG Min-lie, XU Chang-sheng
(FujianHypertensionInstitute,TheFirstAffiliatedHospitalofFujianMedicalUniversity,Fuzhou350005,China.E-mail:ldxie@hotmail.com)
AIM: To investigate the effects of adipose tissue-derived mesenchymal stem cells (ADMSCs) on calcium channels of pulmonary artery in monocrotaline (MCT)-induced pulmonary hypertensive rats.METHODSADMSCs were isolated from adipose tissue by collagenase digestion. Twenty-four Sprague-Dawley rats were randomly divided into 3 groups: normal control (Ctr) group, pulmonary arterial hypertension (PAH) group and ADMSCs transplantation group. Mean pulmonary arterial pressure (MPAP) was measured by catheterization, and right ventricular hypertrophy index (RVHI) was calculated. The expression of voltage-gated calcium channel α1c subunit (CaVα1c), sarcoplasmic/endoplasmic reticulum calcium ATPase 2a (SERCA-2a), inositol 1,4,5-triphosphate receptor 1(IP3R-1), transient receptor potential channel 1 (TRPC1) and TRPC6 at mRNA and protein levels in the pulmonary trunks was determined by RT-PCR and Western blotting, respectively.RESULTSMPAP and RVHI were higher in PAH group than those in Ctr group, while those in ADMSCs group were significantly decreased as compared with PAH group. The expression of CaVα1c, TRPC1 and TRPC6 at mRNA and protein levels was obviously increased in PAH group as compared with Ctr group, while that in ADMSCs group was significantly decreased as compared with PAH group. Compared with Ctr group, the expression of SERCA-2a and IP3R-1 at mRNA and protein levels was obviously decreased in PAH group, while that in ADMSCs group was significantly increased as compared with PAH group.CONCLUSIONMPAP and RVHI are attenuated by ADMSCs in MCT-induced pulmonary hypertensive rats. The reduction of pulmonary arterial pressure by ADMSCs transplantation in MCT-induced pulmonary hypertensive rats may be related to the changes of calcium channels.
Adipose tissue-derived mesenchymal stem cells; Pulmonary arterial hypertension; Calcium channels
R363
A
10.3969/j.issn.1000- 4718.2013.06.001
1000- 4718(2013)06- 0961- 08
2012- 12- 07
2013- 04- 15
国家自然科学基金资助项目(No. 81270111/H0109)
△通讯作者 Tel: 0591-87982618; E-mail: ldxie@hotmail.com
