乙型肝炎病毒对肝内TGF-β1/Smads信号通路的作用*
2013-10-24张香梅乐晓华陈培芬苟继周钟荀珍周亚敏刘晓玲陈青山
张香梅, 乐晓华, 陈培芬, 苟继周, 孙 炎, 钟荀珍, 周亚敏, 刘晓玲, 陈青山△
(1深圳市第三人民医院病理科,广东 深圳 518112; 2暨南大学医学院流行病学教研室,广东 广州 510632)
乙型肝炎病毒对肝内TGF-β1/Smads信号通路的作用*
张香梅1, 乐晓华1, 陈培芬1, 苟继周1, 孙 炎1, 钟荀珍1, 周亚敏2, 刘晓玲2, 陈青山2△
(1深圳市第三人民医院病理科,广东 深圳 518112;2暨南大学医学院流行病学教研室,广东 广州 510632)
目的探讨乙型肝炎病毒(HBV)对肝内TGF-β1蛋白表达及Smads信号通路的作用,为制定慢性乙肝肝纤维化临床治疗策略提供理论依据。方法(1)运用免疫组化PV-6000法检测对照组和慢性乙肝组肝组织中TGF-β1、HBsAg和HBcAg的表达,并采用荧光定量PCR法测定慢性乙肝患者血清HBV DNA含量。(2)应用体外细胞培养技术培养HBV刺激的人肝星状细胞系LX-2细胞,Western blotting方法测定其细胞内TGF-β1、Smad3和Smad7的蛋白表达。结果(1)慢性乙肝组肝组织内TGF-β1的表达高于对照组(P<0.01);肝内TGF-β1表达水平与血清HBV DNA含量呈正相关(P<0.01),且HBcAg阳性肝组织水平较高(P<0.01)。(2)体外细胞学实验中,HBV刺激组LX-2细胞内TGF-β1和Smad3蛋白含量高于对照组和HBV+抗-TGF-β1组(P<0.01);Smad7蛋白表达差异无统计学意义(P>0.05)。结论(1)TGF-β1在慢性乙肝患者肝组织中的表达与血清HBV DNA含量及肝内HBcAg的表达有关。(2)在TGF-β1/Smads信号通路中,HBV致纤维化作用机制以Smad3的正性调控为主,Smad7的作用不明显。
乙型肝炎病毒; 转化生长因子 β1; Smad蛋白类; 肝纤维化
我国人群对乙型肝炎病毒(hepatitis B virus, HBV)具有较高的感染率,绝大多数HBV慢性感染人群都有不同程度的肝纤维化(hepatic fibrosis)表现,其中10%~15%在5~10年内可发展成为肝炎后肝硬化或肝细胞癌[1-2]。已有研究表明,转化生长因子 β1(transforming growth factor β1, TGF-β1)及Smads信号通路与器官纤维化的发生、发展密切相关[3-4]。本研究结合临床资料,运用分子生物学、细胞学等方法,探讨HBV对肝内TGF-β1蛋白表达和TGF-β1/Smads信号通路中关键蛋白Smad3、Smad7的影响,为临床阻抑或延缓慢性乙型肝炎(chronic hepatitis B, CHB)肝纤维化、肝硬化的发生提供理论依据。
材 料 和 方 法
1材料
随机收集深圳市第三人民医院病理科2008~2012年间经临床及病理学证实为慢性乙型病毒性肝炎的肝穿刺活检石蜡包埋组织标本99例。选取10例无HBV及其它病原体感染的正常肝组织作为对照。乙型肝炎病毒核酸定量检测试剂盒(PCR-荧光探针法)由凯杰生物工程(深圳)有限公司生产;HBsAg、HBcAg抗体和PV-6000免疫组化检测试剂盒购自北京中杉金桥生物技术有限公司;兔抗人TGF-β1多克隆抗体和鼠抗人Smad3、Smad7单克隆抗体购自Santa Cruz;PVDF膜和化学发光液购自Pierce。体外细胞学实验所用HBV来自我院1例慢性乙型肝炎患者的血清,蔗糖密度梯度离心法纯化浓缩后HBV DNA终浓度为1.74×1011IU/L。该血清的使用已征得患者本人同意。
2方法
2.199例慢性乙型肝炎患者血清HBV DNA含量测定 实验所用试剂为乙型肝炎病毒核酸定量检测试剂盒,方法为PCR-荧光探针法。实验严格按照试剂盒操作说明进行,反应体系设为40 μL:HBV PCR反应液37.6 μL,Taq酶0.4 μL,尿嘧定DNA糖苷酶(uracil DNA glycosylase,UNG) 0.06 μL,模板cDNA 2 μL。循环条件:37 ℃ 5 min,94 ℃ 1 min,95 ℃ 5 s,60 ℃ 30 s,40个循环。荧光信号收集设在60℃。实验用仪器为ABI7500扩增仪。
2.2免疫组织化学法检测HBsAg、HBcAg和TGF-β1蛋白在慢性乙肝患者肝组织中的表达 运用免疫组化PV-6000法分别检测对照组和慢性乙肝组肝组织中TGF-β1、HbsAg和HBcAg的表达。HBsAg和HBcAg检测抗体为工作液,TGF-β1抗体工作浓度为1∶120。DAB显色后,苏木精复染,中性树脂封固。PBS液取代Ⅰ抗作阴性对照。其染色结果以着色强度及阳性细胞数综合评分:(1)着色强度:无色为0分、浅黄色为1分、棕黄色为2分;(2)阳性细胞数:≤25%为1分、26%~50%为2分、51%~75%为3分、>75%为4分。2项得分相加为其总得分。≤2分为阴性,3~4分为阳性,>4分为强阳性,强阳性判定为高表达。最终结果由2位病理医师采用双盲法观察所得。
2.3人肝星状细胞系LX-2细胞的培养并用MTT实验检测细胞的增殖能力 实验分为3组:(1)对照组;(2)HBV组;(3)HBV+抗TGF-β1组。其中第(2)组在加入纯化HBV后HBV的终浓度为1.74×109IU/L,第(3)组培养基内TGF-β1抗体终浓度为5 μg/L。取对数生长期的上述各组LX-2细胞,胰酶消化后用含10%FCS-DMEM培养基调整上述各组细胞,以每孔约5×103个LX-2细胞接种于96孔板,每孔体积200 μL,同时设空白对照(仅加培养基)。培养约36~48 h后每孔加入20 μL 5 g/L的MTT继续培养4 h,吸干上清,每孔加二甲基亚砜150 μL,在酶标仪492 nm波长测定吸光度值。根据实验组/对照组吸光度(A)比值表示细胞增殖能力大小。独立实验2次,每次每组取5个复孔,求平均值。
2.4Western blotting方法测定不同处理组LX-2细胞中TGF-β1、Smad3和Smad7蛋白的表达 实验分组同上。将生长状态良好的LX-2细胞(1×108/L浓度)接种于6孔培养板,每孔2 mL,37 ℃、5%CO2条件下培养24 h后,在第(2)组培养孔加入纯化HBV,在第(3)组培养孔加入5 μg/L浓度的抗TGF-β1抗体后继续培养48 h。收集上述各组细胞,于冰上细胞裂解液中裂解30 min,4 ℃、12 000 r/min离心20 min,上清用BCA法进行蛋白定量。取20 μg蛋白,选用10%分离胶和5%浓缩胶进行凝胶电泳、转膜和封闭后,分别用1∶400兔抗人TGF-β1多克隆抗体、1∶1 000的鼠抗人Smad3单克隆抗体和1∶500的鼠抗人Smad7单克隆抗体室温孵育1 h后4 ℃过夜,次日洗膜后分别加酶标记的羊抗兔或抗鼠抗体(1∶4 000)室温孵育1 h后ECL化学发光法检测,X胶片扫描后测定各条带灰度值,以GAPDH为内参照。
3统计学处理
采用SPSS 13.0软件包进行统计分析:计量资料用均数±标准差(mean±SD)表示,两样本均数比较采用t检验,多个样本均数比较采用方差分析,样本均数间的多重比较采用SNK法,以P<0.05为差异有统计学意义。
结 果
1基本资料
本研究选取的99例慢性乙肝患者中,男性83例,占83.8 %,平均年龄(36.10±8.26)岁;女性16 例,占16.2 %,平均年龄(37.31±8.81)岁。99例乙肝患者血清中HBV DNA含量:HBV DNA≤1×106IU/L,20例;1×106
2TGF-β1在慢性乙肝患者肝组织中的表达及其与血清HBVDNA含量和肝内HBcAg表达的关系
免疫组化PV-6000法检测结果显示,TGF-β1在正常肝组织中不表达或弱表达,在慢性乙肝患者肝组织中呈不同程度的黄色或棕黄色表达,主要表达于肝星状细胞胞浆内,见图1。TGF-β1在乙肝患者肝内的表达水平高于对照组(P<0.05),见表1;肝内TGF-β1表达水平随着乙肝患者血清HBV DNA含量的增高而增加(P<0.01);HBcAg阳性肝组织中TGF-β1的表达高于HBcAg阴性肝组织(P<0.01),见图1、表2。
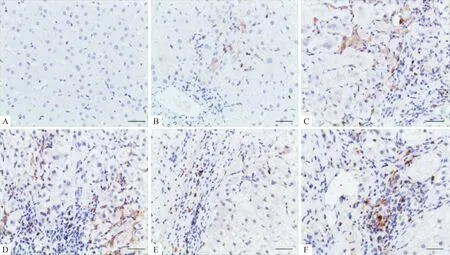
Figure 1. Expression of intrahepatic TGF-β1in control and chronic hepatitis B (CHB) groups (immunohistochemical staining using PV-6000 method, scale bars=50 μm). A: control group; B, C, D: CHB group, with serum HBV DNA content at 1.44×106, 1.24×108and 1.52×1010IU/L, respectively; E: intrahepatic HBcAg (-), with serum HBV DNA content at 1.00×106IU/L; F: intrahepatic HBcAg (+), with serum HBV DNA content at 1.00×106IU/L.
图1TGF-β1在对照组和慢性乙肝组肝组织中的表达
表1慢性乙肝组与对照组肝组织TGF-β1的表达
Table 1. The expression of intrahepatic TGF-β1in control and CHB groups(Mean±SD)

GroupnTGF-β1Control101.20±0.92CHB993.09±1.71**
**P<0.01vscontrol.
3HBV对LX-2细胞体外增殖能力的影响
MTT结果显示,对照组、HBV组和HBV+抗-TGF-β1组各孔测定的A值分别为 0.22±0.00、1.06±0.04和0.23±0.01,HBV组高于对照组和HBV+抗TGF-β1组(P<0.01),其余差异无统计学意义(P>0.05)。
表299例慢性乙肝患者肝组织TGF-β1表达与肝细胞内HBcAg、血清HBVDNA含量的关系
Table 2. The relationship between intrahepatic TGF-β1expression with hepatocellular HBcAg and serum HBV DNA content in 99 cases of chronic hepatitis B patients (Mean±SD)

IndicatorLevelnTGF-β1LiverHBcAg(+)584.09±1.26*(-)411.68±1.21SerumHBV-DNA(IU/L)<1×106200.90±1.021×106~1×108252.72±1.31#1×108~1×1010263.85±1.05#>1×1010284.29±1.30#
*P<0.05vsHBcAg(-);#P<0.05vsHBV DNA<1×106IU/L.
4HBV对LX-2细胞TGF-β1、Smad3和Smad7蛋白表达的影响
运用Western blotting方法检测TGF-β1、Smad3蛋白和Smad7蛋白在对照组、HBV组和HBV+抗TGF-β1组细胞中的表达。3组中,TGF-β1和Smad3蛋白表达差异有统计学意义(均P<0.01),HBV组高于对照组和HBV+抗-TGF-β1组(P<0.05),其余差异无统计学意义(P>0.05);Smad7蛋白差异无统计学意义(P>0.05),见图2。
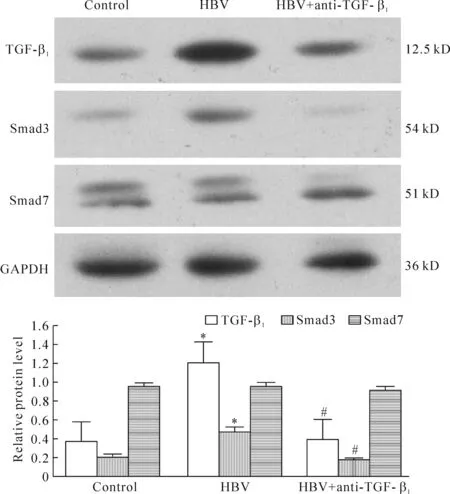
Figure 2. Expression of TGF-β1, Smad3 and Smad7 in LX-2 cells detected by Western blotting.Mean±SD.n=15.*P<0.05vscontrol;#P<0.05vsHBV.
图2Westernblotting法检测TGF-β1、Smad3和Smad7蛋白在3组细胞中的表达
讨 论
慢性HBV感染所致肝纤维化是目前我国乙肝患者所面临的严重健康问题,探明HBV在肝纤维化形成中的作用,对有效防治乙肝肝纤维化尤为重要。
本研究首先检测TGF-β1在慢乙肝患者肝组织中的表达,并分析其表达与乙肝患者同期测定的血清HBV DNA含量的关系,结果显示,TGF-β1在乙肝肝组织中的表达高于正常肝组织、表达量与血清HBV DNA含量呈正相关关系,这与赖娅芳等[5]得出的结论一致。
肝组织内HBcAg不仅是HBV存在的直接标志,而且是判断HBV的存在和复制状态的重要指标[6]。本研究结果表明TGF-β1蛋白在HBcAg阳性肝组织中的表达水平高于HBcAg阴性的肝组织,尤其在HBcAg浆型表达的肝组织内TGF-β1表达更明显,提示HBV有可能通过直接或间接的方式诱导肝内细胞因子TGF-β1的表达。
在TGF-β1/Smads信号通路中,肝星状细胞是该通路发挥作用的关键细胞,Smads蛋白则是该通路的主要组成部分,对TGF-β1信号通路激活状态的维持及调节至关重要[7]。已有研究显示,在Smads蛋白家族中,Smad3是目前已知TGF-β1通路发挥作用,启动下游靶基因表达的重要的信号转导分子[8-9],而Smad7主要抑制TGF-β1信号通路,对Smads信号起着负调控作用[10-11]。在肝脏损伤过程中,肝星状细胞的活化可来自于TGF-β1的旁分泌和自分泌,活化的肝星状细胞可分泌更大量的TGF-β1,从而促进及维持肝星状细胞的进一步活化[12-13]。体外细胞学实验所用的LX-2细胞来源于正常人肝脏中分离的、经转染SV40T质粒后培养筛选的肝星状细胞,它能更好地模拟人体肝星状细胞的特性,使实验结果更加接近真实水平[14]。实验结果表明,当在培养基内加入HBV血清并培养24 h后时,不但LX-2细胞的增殖能力增加(肝星状细胞的活化标志之一),其TGF-β1和Smad3蛋白含量较加入前明显增加,这与已往研究得出的“HBV可促进人肝星状细胞系LX-2细胞TGF-β1的表达及细胞增殖”的结论相一致[15]。但在培养液中加入抗TGF-β1抗体一定时间(约16 h)后,LX-2细胞内TGF-β1和Smad3蛋白含量基本恢复到未加入HBV血清时的水平,原因可能是加入的抗TGF-β1抗体中和了活化的肝星状细胞分泌至培养液中的TGF-β1,从而部分或完全阻止了TGF-β1与肝星状细胞膜上的TGF-β1受体结合,消弱或阻止了HBV对肝星状细胞的作用及对TGF-β1/Smads信号通路的影响。Smad7蛋白表达在整个实验过程中变化不明显,提示TGF-β1/Smads信号通路在慢乙肝肝纤维化形成中的作用主要是通过Smad3的正性调控为主,Smad7的负性调控机制作用不明显,这和以往研究所认为的Smad7是TGF-β1/Smads信号通路中主要的抑制性调控蛋白,肝损伤时TGF-β1可快速诱导Smad7的表达不一致[14]。
可见,HBV的存在及复制对慢乙肝患者肝纤维化的形成与发展至关重要,TGF-β1/Smads信号通路中HBV致纤维化作用以Smad3的正性调控为主。因此,在慢乙肝抗纤维化的治疗中,既要动态监测乙肝患者体内HBV DNA复制水平适时进行抗病毒治疗,又要积极针对TGF-β1和Smad3进行靶向治疗,阻抑或延缓肝纤维化或肝硬化的发生。
[1] Lu FM,Zhuang H. Management of hepatitis B in China[J]. Chin Med J (Engl), 2009,122(1):3-4.
[2] Mulrooney-Cousins PM,Michalak TI. Persistent occult hepatitis B virus infection: experimental findings and clinical implications[J]. World J Gastroenterol, 2007,13(43):5682-5686.
[3] Henderson NC, Forbes SJ. Hepatic fibrogenesis:from within and outwith[J]. Toxicology, 2008,254(3):130-135.
[4] Friedman SL. Mechanisms of hepatic fibrogenesis[J]. Gastroenterology, 2008,134(6): 1655-1669.
[5] 赖娅芳,杨 岩,盛慧萍. 慢性乙型肝炎患者血清中TNF-γ、IL-10、TGF-β1水平与HBV-DNA载量的关系[J].宁夏医科大学学报, 2010,32(2):211-213.
[6] 徐志强,成 军, 张鸿飞.HBcAg生物学特性研究进展[J].世界华人消化杂志, 2004,12(12):2833-2836.
[8] Lin YL, Lin CY, Chi CW, et a1. Study on anti-fibrotic effects of curcumin in rat hepatic stellate cells [J]. Phytother Res, 2009,23(7):927-932.
[9] Uemura M, Swenson ES, Gaca MD, et al. Smad2 and Smad3 play different roles in rat hepatic stellate cell function and alpha-smooth muscle actin organization [J]. Mol Biol Cell, 2005,16(9):4214-4224.
[10] Yan XH, Liu ZY, Chen YG. Regulation of TGF-β signaling by Smad7[J]. Acta Biochim Biophys Sin, 2009,41(4):263-272.
[11] 杨 斌,曾维政,吴晓玲. HSCs表型转化的信号转导通路及其阻断剂的研究进展[J].世界华人消化杂志,2009,17(22):2283-2291.
[12] 吕沐瀚,李晓云,李昌平.转化生长因子β1对肝星状细胞活化及跨膜信号转导影响与舒肝颗粒的干预[J].中国组织工程研究与临床康复,2009,13(50): 9898-9902.
[13] 纪 辉,迟宝荣,张一宁.肝纤维化与肝星状细胞[J]. 吉林大学学报(医学版),2008,34(3):538-542.
[14] 俞蕾敏,吕 宾.TGF-β/smad信号转导通路与肝纤维化的关系[J].国际消化病杂志, 2008,28(5): 397-400.
[15] 哈明昊,饶慧英,刘 峰,等.乙型肝炎病毒促进CTGF和TGF-β1在肝星状细胞中的表达[J].世界华人消化杂志,2008,16(9):924-928.
RoleofhepatitisBvirusinintrahepaticTGF-β1/Smadssignalingpathway
ZHANG Xiang-mei1, LE Xiao-hua1, CHEN Pei-fen1, GOU Ji-zhou1, SUN Yan1, ZHONG Xun-zhen1,ZHOU Ya-min2, LIU Xiao-ling2, CHEN Qing-shan2
(1DepartmentofPathology,theThirdPeople’sHospitalofShenzhen,Shenzhen518112,China;2EpidemiologyDivision,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:tchqsh@jnu.edu.cn)
AIM: To explore the effects of hepatitis B virus (HBV) on intrahepatic expression of transforming growth factor β1(TGF-β1) and Smads.METHODSThe expression of intrahepatic TGF-β1, HBsAg and HBcAg in control group and chronic hepatitis B (CHB) group was detected by immunohistochemical method.The serum HBV DNA content was determined by real-time PCR. The role of HBV in the expression of TGF-β1, Smad3 and Smad7 in human hepatic stellate cell line LX-2invitrowas observed by cell culture and Western blotting.RESULTSThe average score of intrahepatic TGF-β1expression in CHB group was higher than that in control group. With the increase in serum HBV DNA content, intrahepatic TGF-β1expression was also enhanced. In the HBcAg positive hepatic tissue, there was higher TGF-β1expression than that in the liver tissue of HBcAg negative. Compared with control group and HBV+anti-TGF-β1group, HBV caused increased expression of TGF-β1and Smad3 in HBV groupinvitro. No difference of Smad7 protein among control group, HBV group and HBV+anti-TGF-β1group was observed.CONCLUSIONThe expression of intrahepatic TGF-β1is related to serum HBV DNA and hepatocellular HBcAg in the patients with CHB. HBV-induced liver fibrosis mainly relies on positive regulatory mechanisms of Smad3,and the negative regulation by Smad7 almost does not function.
Hepatitis B virus; Transforming growth factor β1; Smad proteins; Liver fibrosis
R363.2+1
A
10.3969/j.issn.1000- 4718.2013.12.016
1000- 4718(2013)12- 2218- 05
2013- 09- 09
2013- 10- 31
深圳市科技计划(医疗卫生类)(No.20103133;No. 201202060)
△通讯作者 Tel: 020-85220258; E-mail: tchqsh@jnu.edu.cn
