Pd和甲醛对Ag/C催化四氯化碳原位液相加氢脱氯性能的影响
2013-10-22周秀莲鲁墨弘李明时单玉华朱建军
周秀莲,鲁墨弘,朱 劼,李明时,单玉华,朱建军
(常州大学 石油化工学院,江苏 常州213164)
四氯化碳对臭氧层具有很强的破坏性。根据《关于消耗臭氧层物质的蒙特利尔议定书》,四氯化碳的生产和工业应用已经被禁止。而工业上所有甲烷氯化物(如一氯甲烷、二氯甲烷和氯仿)生产工艺均会副产四氯化碳。因此,如何有效处理和利用四氯化碳已成为该领域可持续发展必须解决的难题。目前,对四氯化碳的处理最有效的方法是通过催化加氢使之转化为有用的化合物。一般该转化是在贵金属Pt、Pd或者两者组合的催化剂上与H2反应来实现[1-4]。Weiss等[5]最先发 现 Pt/Al2O3催化剂 可 以对四氯化碳进行催化转化。Lu等[6]研究了溶剂对四氯化碳液相催化转化反应的影响,发现甲醇为溶剂时最利于提高Pd/C催化剂活性。孙建芝等[7]研究了四氯化碳液相加氢制氯仿的催化剂,发现在Pd/C中加入助剂Ag有效抑制了甲烷的生成,提高了氯仿的选择性。尽管催化加氢法是绿色生产工艺,但H2来源不易,给企业生产带来了困难[8]。Pena等[9]研究了甲醇催化分解制氢,发现合成甲醇的催化剂可以用于甲醇催化分解制氢的反应中,其中以Cu基催化剂为主。因此,无需外加氢源的催化加氢反应技术引起了人们的关注,这类新的液相催化加氢反应体系具有良好的应用前景[10]。
在本研究中,笔者考察了助剂对四氯化碳原位液相催化转化反应的影响,重点考察了双金属催化剂中Pd/Ag摩尔比和助剂甲醛用量对Ag/C催化剂性能的影响,并探讨了助剂的作用机制。
1 实验部分
1.1 催化剂制备
采用等体积浸渍法制备Ag/C催化剂。采用共浸渍法制备双金属Pd-Ag催化剂,将配制好的相应浓度的硝酸银和氯化钯溶液浸渍在20~40目的活性炭颗粒上,浸渍24h后,将样品于120℃干燥12h,然后置于立式固定床中,在25mL/min H2流下,400℃还原3h。还原结束后停止加热,冷却至室温,取出密封备用。制备的所有催化剂中,Ag的质量分数均为8%。含Pd和Ag的催化剂记为Pd-Ag(x)/C,其中,x为Pd和Ag的摩尔比(x=0.01、0.03和0.05)。
1.2 催化剂活性评价
采用100mL有聚四氟内衬的高压反应釜评价催化剂的催化活性。将5mL CCl4和25mL甲醇及0.3g催化剂加入反应釜后,拧紧釜盖和取样阀,用N2置换反应釜中的空气至少3次,然后通入所需压力的N21MPa,并开启磁力搅拌器和控温仪。待温度升到130℃、压力至2MPa,开始反应。反应结束后,将反应釜用冷水迅速冷却至室温,然后缓慢打开排气阀释放反应器内的压力,尾气经碱液吸收后放空,通过抽滤回收催化剂和反应液。反应过程中,每隔一段时间收集液体产物,采用美国VARIAN CP-3800气相色谱仪分析产物组成。色谱条件:30m×0.53mm SE-30弹性石英毛细管柱,FID检测,柱温40~80℃,检测室、气化室温度均为250℃,液相进样量0.2μL。主要液相产物为CH2Cl2和CHCl3,反应过程中几乎不产生CH4气体,可采用归一化法定量。
1.3 甲醇/甲醛分解反应
甲醇或甲醛的分解反应在高压反应釜中进行。将物料及0.3g Ag/C催化剂加入反应釜后,先用N2置换反应釜中的空气至少3次,再用Ar置换反应釜中的N2至少3次,然后通入所需压力的Ar 1MPa,并开启磁力搅拌器和控温仪。待升到温度130℃、压力2MPa,开始反应。反应结束后,将反应釜与质谱仪连接,先开启质谱仪走基线,载气为Ar。待基线稳定后,关闭Ar,打开釜的排气阀,使釜内气体进入质谱仪进行检测。待气体检测完毕后,关闭排气阀,打开载气Ar。
1.4 催化剂的表征
采用日本理学D/max 2500PC粉末X-射线衍射仪分析样品的晶相。Cu靶/石墨单色器,步进扫描,Ni滤波,管电压40kV,管电流80mV。
采用英国Thmu公司Multilab2000型X射线光电子能谱仪测定催化剂的表面组成和元素的化合态。光源为Mg-Kα,通过能20eV,以C1s(284.6eV)峰来校准其他元素的XPS峰。
2 结果与讨论
2.1 甲醇分解反应产物
考察了甲醇在Ag/C催化剂作用下的分解反应,通过质谱检测CO2、CO、和H2。反应9h后釜内产物的质谱检测结果示于图1。
从图1可以看出,在釜内气体进入质谱仪0.01min后开始检测到釜内气体信号,Ar浓度没有反应前走基线时的浓度高,因此Ar响应值略微下降。而H2响应值较基线显著上升了2个数量级,说明反应生成了大量的H2,同时也检测到了CO2和CO。因此,可以证明在Ag/C催化剂和所给反应条件下,甲醇可以发生自身分解反应,产生H2,从而可作为加氢反应的氢源。甲醇的分解反应如式(1)所示。
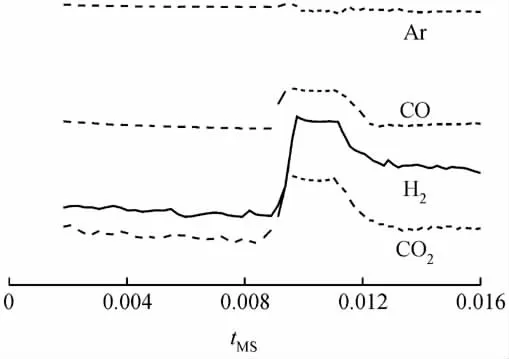
图1 质谱检测的甲醇分解反应结果Fig.1 The result of decomposition reaction of methanol detected by MS
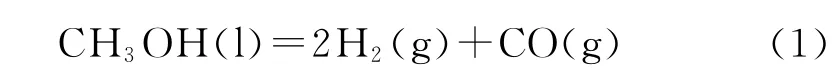
2.2 助催化剂Pd对Ag/C催化剂性能的影响
在Ag/C催化剂中加入不同量的Pd制备成Pd-Ag(x)/C催化剂(x=n(Pd)/n(Ag)),考察其在CCl4原位液相催化转化反应中的催化活性。CCl4转化率及各产物选择性随反应时间的变化示于图2。
从图2可以看出,在空白实验中,即不加催化剂、其余条件保持不变的情况下,9h后CCl4转化率为36.6%。这可能是因为在该反应条件下,CCl4与甲醇反应生成HCl,反应釜虽然使用了四氟内衬,不能保证完全与釜内壁隔绝,HCl蒸气会对反应釜产生一定的腐蚀,形成的Fe2+溶解在反应液中,Fe2+和Fe可能为还原剂[11],将CCl4还原脱氯生成CH2Cl2和 CHCl3。Deng等[12]通过加入能与 Fe2+形成络合物的试剂证实,参与还原反应的Fe2+的数量有限。此外,如果没有有效的催化剂,很难产生活性氢,且与空白实验相比,使用催化剂后CCl4转化率大幅提高,因此,可以忽略Fe对反应的影响。故以下内容中无特别要求,省略与空白实验的对比,且每组CCl4的转化率中均包含Fe对于CCl4的转化率的贡献。
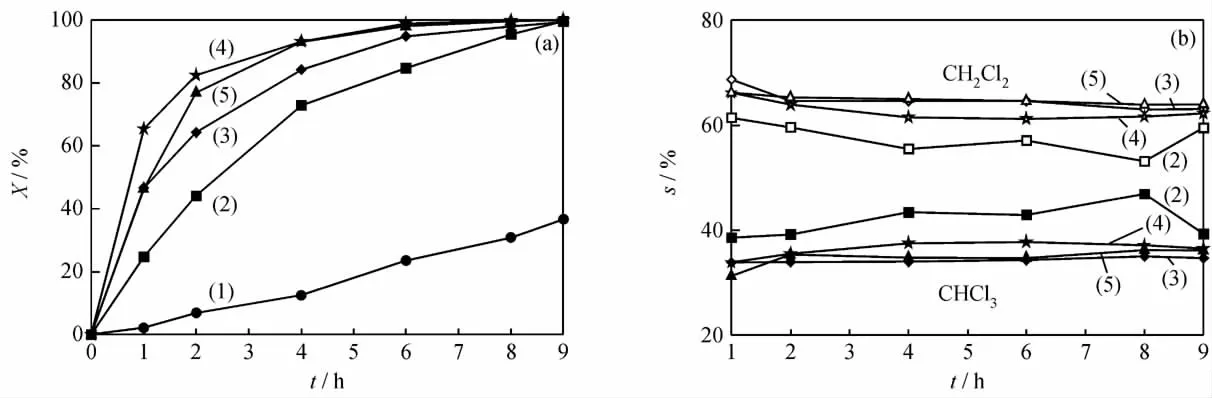
图2 Pd-Ag(x)/C催化CCl4液相转化反应的转化率(X)和产物选择性(s)随反应时间的变化Fig.2 Conversion(X)and product selectivity(s)vs reaction time of CCl4liquid phase conversion reaction over Pd-Ag(x)/C catalyst
从图2还可见,微量Pd的加入明显提高了Ag/C催化剂的活性。随着x的增加,即Pd-Ag(x)/C催化剂中Pd含量的增加,催化活性逐渐增加;但当x增加为0.05时,催化活性反而下降。反应2h时,采用Ag/C催化剂的CCl4转化率为44.1%;采用Pd-Ag(0.01)/C、Pd-Ag(0.03)/C和 Pd-Ag(0.05)催 化 剂 时, 转 化 率 分 别 为 64.3%、82.4% 和77.0%。Pd的加入对产物选择性没有影响,CH2Cl2和CHCl3选择性之比值保持在6/4左右。这是因为甲醇在Pd-Ag(x)/C催化剂的作用下发生分解,催化剂表面形成活性物Ag-H,同时也形成了活性物[Pd0-H];随着Pd含量的增加,活性物[Pd0-H]在催化剂表面富集得越来越多,使得催化剂的活性增强。但是当Pd负载量过大,分布在载体上的金属粒子变大,甚至发生团聚,从而降低金属活性中心的利用率,同时也影响了Ag的活性,使得产生的活性氢减少。因此Pd-Ag(0.03)/C为该反应的最适宜催化剂。
2.3 液体助剂对CCl4原位液相加氢脱氯反应的影响
2.3.1 甲醛溶液加入量的影响
由于甲醛为强还原剂,选择甲醛溶液(质量分数37%~40%)为助剂,控制加入反应体系的液体的总体积为30mL,考察了甲醛溶液加入量对Ag/C催化CCl4液相转化反应转化率和产物选择性的影响,结果如图3所示。
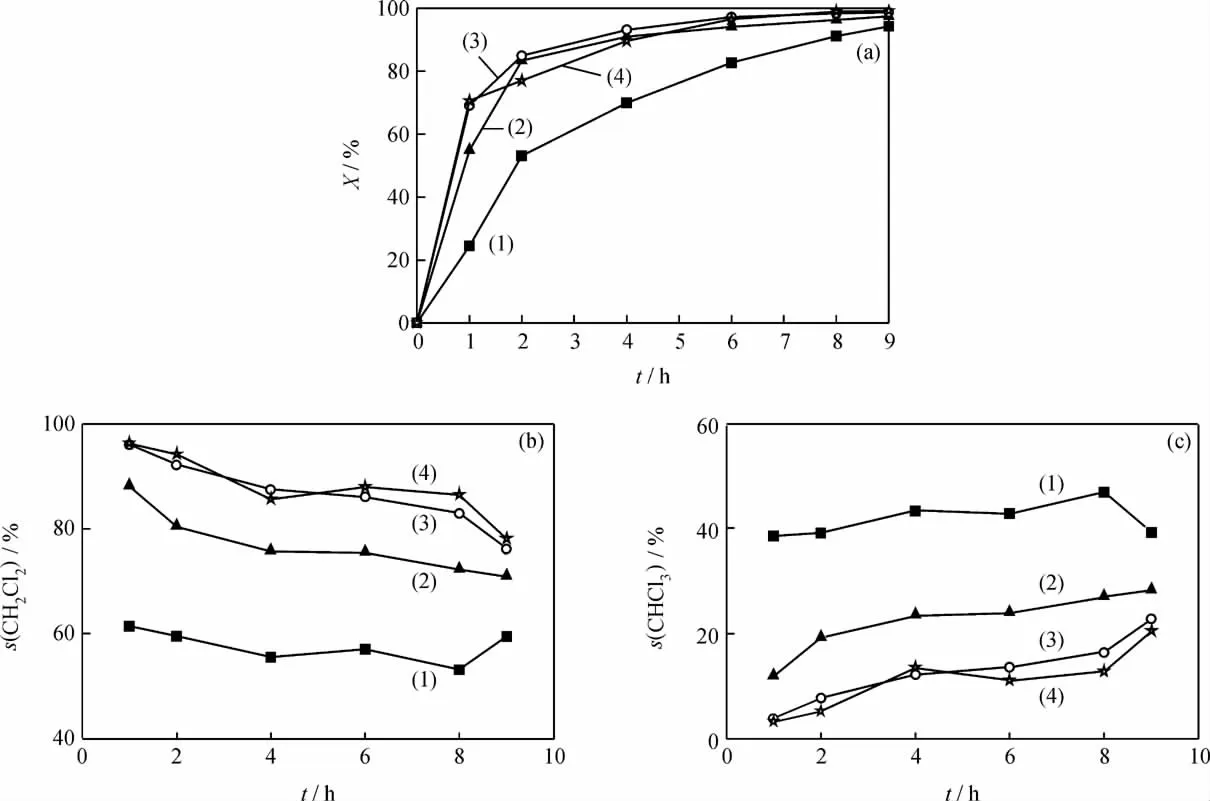
图3 甲醛溶液加入量对Ag/C催化CCl4液相转化反应转化率(x)和产物选择性(s)的影响Fig.3 Effect of formaldehyde solution addition on conversion and product selectivity(s)of CCl4liquid phase catalytic conversion(x)reaction over Ag/C catalyst
由图3可以看出,在反应体系中加入甲醛溶液,CCl4转化率明显增加。随着甲醛溶液加入量的增加,CCl4转化率呈现先增加后降低的趋势。反应2h时,不加甲醛溶液,CCl4转化率为44.1%;加入2、5和10mL甲醛溶液后,转化率分别达到83.4%、84.9%和77.0%。由此可见,当加入2mL甲醛溶液,CCl4转化率就增加了近1倍;随着反应时间的延长,甲醛溶液的加入量为5mL时,CCl4转化率较2mL时略高。当甲醛溶液加入量为10mL时,CCl4转化率反而有所下降,这是因为甲醛溶液过多时,水量就多,导致体系分层,从而抑制了反应的进行。张天永等[13]曾利用甲醛还原法代替催化加氢法,将硝基还原为胺基。向反应体系中加入甲醛溶液作为助剂,一方面甲醛在催化剂作用下,可发生分解产生H2;另一方面因其具有较强的还原性[14-15],可加快催化剂表面形成的Ag-Cl物种还原为Ag的进程,使得催化剂表面的Ag-H物种增多。
由图3还可以看出,甲醛溶液的加入使产物的选择性有明显的改变。不加甲醛时,CH2Cl2和CHCl3同时生成,且其选择性随反应时间的延长基本保持稳定,分别在60%和40%左右。加入甲醛后,CH2Cl2和CHCl3也是同时生成,但随着甲醛量的增加,CH2Cl2选择性明显增加,而CHCl3选择性显现下降的趋势;随着反应进行,CH2Cl2选择性缓慢下降,CHCl3选择性缓慢上升。甲醛溶液加入量为5mL和10mL时,CH2Cl2和CHCl3选择性变化不大。
尽管甲醛溶液的加入量为5mL时,CCl4转化率较加入量2mL时略高,但CH2Cl2选择性明显提高。因此,选择甲醛溶液量为5mL进行下一步研究。
2.3.2 验证实验
石小玉[16]研究发现,少量的水对CCl4的转化反应有促进作用。由于甲醛溶液中含有大量的水,为了验证甲醛对反应的促进作用,笔者选用三聚甲醛(质量分数≥98%)作为助剂。本反应体系为酸性体系,而三聚甲醛在酸的作用下,可重新分解成甲醛,它是甲醛的一种特殊商品形式。经计算,5mL上述甲醛溶液中水的体积为2.7mL,甲醛的摩尔量与2.1g三聚甲醛中甲醛的摩尔量相当。考察了2.7 mL水和2.1g三聚甲醛单独存在下对CCl4催化转化反应转化率和产物选择性的影响,结果如图4所示。
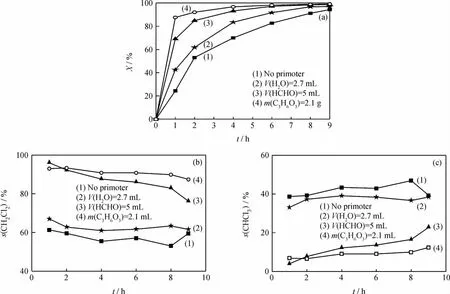
图4 甲醛和水对CCl4催化转化反应转化率和产物选择性的影响Fig.4 Effect of formaldehyde and H2O on conversion and product selectivity of CCl4liquid phase catalytic conversion reaction
由图4可以看出,甲醛加入对CCl4转化率的影响较大。反应1h时,不加任何助剂,CCl4转化率为24.4%;加入助剂H2O、甲醛溶液和三聚甲醛,对应 的 CCl4转 化 率 分 别 为 42.6%、69.1% 和87.6%。单独加入2.7mL H2O后,CCl4转化率上升,与石小玉[16]的研究结果相吻合。与H2O相比,加入甲醛溶液后,CCl4转化率明显上升,说明甲醛溶液中甲醛对该反应的促进作用比H2O明显。而加入三聚甲醛比加入甲醛溶液时的CCl4转化率更高,这可能因为三聚甲醛加入反应体系后就被分解为甲醛,其甲醛量与甲醛溶液中的甲醛量相等,但甲醛溶液会带入过量的水,对反应不利。这一验证结果更加证实了甲醛对CCl4催化转化反应的促进作用。
由图4还可以看出,与不加任何助剂相比,2.7mL H2O的加入对产物的选择性没有明显影响,CH2Cl2选择性保持在60%左右,CHCl3选择性保持在40%左右。当向体系中加入甲醛溶液后,CH2Cl2选择性明显提高,CHCl3选择性明显下降;随着反应的进行,CH2Cl2选择性呈现下降的趋势,由96.1%下降到76.3%;CHCl3选择性呈现上升的趋势,由3.9%上升至22.8%。向体系中加入三聚甲醛,CH2Cl2选择性最高,保持在90%左右,CHCl3选择性保持在10%左右。说明甲醛的加入明显改变了CCl4液相催化转化反应的产物分布。
2.4 CCl4液相催化转化反应中甲醛作用机制的初步探讨
2.4.1 反应前后Ag/C催化剂的晶相结构和Ag价态的变化
对加有甲醛溶液的CCl4液相催化转化反应前后的Ag/C催化剂进行了XRD表征,结果如图5所示。
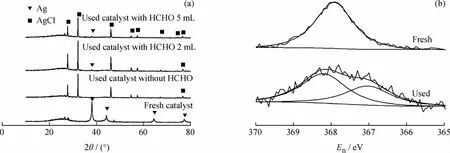
图5 加有甲醛溶液的CCl4液相催化转化反应前后Ag/C催化剂的XRD和XPS谱Fig.5 XRD and XPS patterns of Ag/C catalyst after CCl4liquid phase catalytic conversion reaction with formaldehyde solution added
由图5可以看出,反应前Ag/C催化剂在2θ为38.1°、44.3°、64.5°和 77.8°处出现了比较明显的Ag的特征衍射峰。不加甲醛溶液反应9h后的Ag/C催化剂的XRD谱中出现AgCl的特征衍射峰[17]。经计算,0.3g Ag/C催化剂中含0.22mmol的Ag,5μL CCl4含0.21mmol的Cl。也就是说5μL CCl4几乎可以将0.3g Ag/C催化剂的Ag全部转化为AgCl;当将CCl4的量放大到1000倍,即5mL时,反应9h,CCl4转化率仍在90%左右(见图2),说明该催化反应还是能进行下去。笔者直接制备了与Ag/C催化剂中Ag的摩尔量相等的AgCl/C的催化剂,其反应活性与Ag/C相当。笔者猜想在无甲醛的反应体系中,Ag/C催化剂表面经历了由活性组分Ag转变为AgCl,然后又被还原为Ag的循环往复的过程,从而保证了催化剂的活性。
反应体系中加入甲醛溶液反应后的Ag/C催化剂均具有AgCl的特征衍射峰,同时在2θ为38.1°处出现Ag(111)晶面的衍射峰,且随着甲醛溶液量的增加,该衍射峰逐渐增强。这说明在反应体系中,甲醛的加入可能加速了催化剂表面Ag-Cl物种还原为Ag的循环过程,从而保证了催化剂的活性。
反应前后Ag/C催化剂的XPS谱见图5。由于XPS对Ag不敏感,因此不能精确地从化学位移来判断Ag的价态。从图5可见,反应前的Ag/C催化剂只有1种价态的Ag,根据其结合能并结合图5 XRD表征结果可以认为,是0价态的金属Ag。反应后的Ag/C催化剂明显存在2种不同价态的Ag,结合图5XRD表征结果可以认为,它们是Ag0和Ag+1。由此笔者推测,在反应过程中,Ag0总是存在,由它催化甲醇的分解,产生反应所需的活性氢(Ag-H)。
2.4.2 甲醛分解反应
考察了甲醛溶液在Ag/C催化剂作用下的自身分解反应,通过质谱检测H2,结果示于图6。
图6为Ar氛围中,甲醛在Ag/C催化剂作用下发生分解反应,反应9h后釜内产物经质谱检测的结果。从图6可以看出,甲醛分解反应产生的气体极少,因此Ar响应值几乎不变;H2(实线表示)响应值上升了0.5个数量级,与空气中H2(虚线表示)的响应值相当。与甲醇分解反应检测的气体信号相比(见图1),可以认为在催化剂和所给反应条件下,甲醛分解反应中几乎不产生H2。
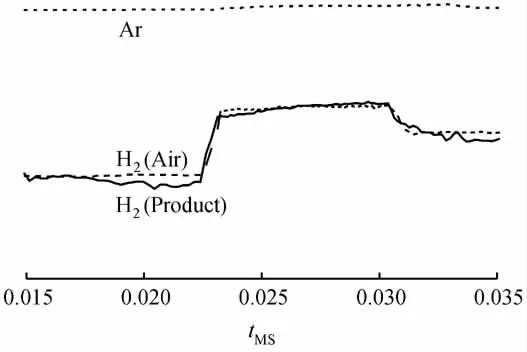
图6 质谱检测的甲醛自身分解反应结果Fig.6 The result of decomposition reaction of formaldehyde detected by MS
综上可知,反应体系的活化氢主要由甲醇提供,甲醛主要起加速催化剂表面Ag-Cl物种还原为活性物种Ag的作用。
3 结 论
(1)采用Pd掺杂的Ag/C催化剂,不改变CCl4转化反应的产物分布,但明显提高了Ag催化剂的活性,以n(Pd)/n(Ag)为0.03的Pd-Ag/C催化剂的活性最高。
(2)助剂甲醛溶液的加入明显提高了Ag/C催化剂催化CCl4转化反应转化率和CH2Cl2的选择性,以甲醛溶液为5mL时转化率和CH2Cl2的选择性最高,同时证实甲醛溶液中的甲醛对反应的促进作用明显大于水的促进作用。
(3)助剂三聚甲醛的加入明显提高了Ag/C催化剂催化CCl4转化反应转化率和CH2Cl2的选择性。三聚甲醛在酸的作用下,可分解成甲醛,起到甲醛的作用。甲醛在该体系中主要起加速催化剂表面Ag-Cl物种还原为Ag的作用。
[1]WEISS A H, GAMBHIR B S,LEON R B.Hydrodechlorination of carbon tetrachloride[J].Journal of Catalysis,1971,22(2):240-245.
[2]CHOI H C,CHOI S H,LEE J S,et al.Effects of Pt precursors on hydrodechlorination of carbon tetrachloride over Pt/A12O3[J].Journal of Catalysis,1997,166(2):284-293.
[3]LUISA M A,GOMEZ S L,SEOANE A A.Hydrodechlorination of carbon tetrachloride in the liquid phase on a Pd/carbon catalyst:Kinetic and mechanistic studies[J].Applied Catalysis B:Environmental,2004,53(2):101-110.
[4]蒋晓原,毛建新,陆维敏,等.四氯化碳加氢制氯仿Pt-Pd/C催化剂的制备与研究[J].石油化工,2000,29 (7):484-485.(JIANG Xiaoyuan,MAO Jianxin,LU Weimin,et al.Studies of Pt-Pd/C catalyst for hydrogenation of CCl4to CHCl3[J].Petrochemical Technology,2000,29(7):484-485.)
[5]WEISS A H, VALINSKI S,ANTOSHIN G V.Hydrodechlorination and oligomerization of carbon tetrachloride over nickel Y zeolites[J].Journal of Catalysis,1982,74(1):136-139.
[6]LU Mohong,SUN Jianzhi,LI Mingshi,et al.High selective hydrodechlorination of CCl4into CHCl3on Ag-Pd/carbon catalysts[J].React Kinet Mech Catal,2010,100(1):99-103.
[7]孙建芝,张东宝,鲁墨弘,等.Ag-Pd/C催化四氯化碳液相加氢反应的研究[J].高校化学工程学报,2010,24 (5):795-800.(SUN Jianzhi,ZHANG Dongbao,LU Mohong,et al. Hydrogenation of carbon tetrachloride over Ag-Pd/C catalysts in liquid phase[J].Journal of Chemical Engineering of Chinese Universities,2010,24(5):795-800.)
[8]沈颖旎,罗智伟,严新焕.原位液相催化加氢法合成N-乙基苯胺和N,N-二乙基苯胺[J].催化学报,2008,29(7):612-616.(SHEN Yingni,LUO Zhiwei,YAN Xinhuan.In situ liquid-phase catalytic hydrogenation for the synthesis ofN-ethylaniline andN,N-diethylaniline[J].Chinese Journal of Catalysis,2008,29(7):612-616.)
[9]PENA M A,GOMEZ J P,FIERRO J L G.New catalytic routes for syngas and hydrogen production[J].Applied Catalysis A:General,1996,144(1):7-57.
[10]ZHOU L,YAN X H.A novel transfer hydrogenation with high hydrogen utilization for the hydrogenation of halogenated nitrobenzene without hydrodehalogenation[J].Catalysis Letters,2009,132(1-2):16-21.
[11]MATHESON L J,TRATNYEK P G. Reductive dehalogenation of chlorinated methanes by iron metal[J].Environmental Science and Technology,1994,28(12):2045-2051.
[12]DENG B,BURRIS D R,CAMPBELL T J.Reduction of vinyl chloride in metallic iron-water system [J].Environmental Science and Technology,1999,33(15):2651-2658.
[13]张天永,张友兰,刑文康.甲醛还原法制备2,2’-二氯氢化偶氮苯[J].应用化学,2004,21 (5):521-523.(ZHANG Tianyong,ZHANG Youlan,XING Wenkang.Preparation of 2,2’-dichlorohydrazobenzene by formaldehyde reduction[J].Chinese Journal of Applied Chemistry,2004,21(5):521-523.)
[14]CHOU K S,REN C Y.Synthesis of nanosized silver particles by chemical reduction method[J].Materials Chemistry and Physics,2000,64(3):241-246.
[15]KHANNA P K,SINGH N,CHARAN S,et al.Synthesis and characterization of Ag/PVA nanocomposite by chemical reduction method[J].Materials Chemistry and Physics,2005,93(1):117-121.
[16]石小玉.四氯化碳催化加氢研究[D].常州:常州大学,2010.
[17]张燕,王源升,宋玉苏.纳米AgCl粉末制备高稳全固态Ag/AgCl电极[J].武汉理工大学学报,2008,30(9):32-35.(ZHANG Yan, WANG Yuansheng,SONG Yusu.Preparation of steady solid Ag/AgCl electrode by AgCl nano-powders[J].Journal of Wuhan University of Technology,2008,30(9):32-35.)
