脑水肿的AQP4 调节机制研究进展
2013-10-22陈少军陈学群杜继曾综述
李 敏,陈少军,陈学群,杜继曾 综述
(浙江大学医学院基础医学系,浙江 杭州 310058)
脑水肿是脑组织中水份的异常过度集聚而引发的脑肿胀,发生脑水肿时脑体积增大、颅内压增高。很多大脑疾病、机体处于严重的全身感染或者急性缺氧状况时都会导致脑水肿的发生。研究表明,水通道蛋白(aquaporins,AQPs)与脑水肿的发生密切相关。水通道蛋白是一种通透水的特殊膜蛋白。自1992年Peter Agre发现第一个水通道蛋白(AQP1)以来,迄今在哺乳动物组织中已发现13 种水通道蛋白(AQP0~AQP12)[1],在不同的组织器官中调节水分的跨膜转运,对机体的水平衡的维持起重要作用。在哺乳动物脑中最主要的水通道蛋白是AQP4,其与脑脊液的产生和重吸收有关,因此AQP4 是脑水肿发生发展的关键分子。
1 AQP4 的结构与功能
AQP4 最早由Hasegawa[2](1994年)从大鼠肺中克隆出来,是水通道蛋白家族成员之一。AQP4 基因定位于人染色体18q11.2 与q12.1之间的连接处,由4个外显子组成,编码由301个氨基酸组成的蛋白质。每个AQP4 蛋白单体都是6次跨膜,其N 端和C 端均位于胞内,有5个环(A、B、C、D、E 环),包括3个细胞外环(A、C、E)和2个细胞内环(B、D)(图1A)。2个保守的精氨酸-脯氨酸-丙氨酸基序(NPA)位于B环和E 环,为AQP 家族成员共有的特征性结构(图1B),研究证实该结构在水分子转运中起重要作用[2]。2个NPA 环从双分子层相对面折叠进入膜中,在双分子层中线处交叉重叠,形成一个直径约0.38 nm(稍大于一个水分子直径)的通道,这种结构被称为沙漏模式,可使水分子顺渗透压梯度单线通过。AQP4 四级结构是由4个具有独立活性的单体组成的四聚体,每个单体形成独立的水通道,同时4个单体之间形成的通道还存在阻断粒子的结构(图1C)。根据翻译起始位置的不同,AQP4 分为3 种亚型,Mz(含364个氨基酸)、M1(含323个氨基酸)和M23(含有301 氨基酸)亚型(图1A)[3]。其中,M23 在脑中含量最丰富,M1 水通透性最高[4]。Furman 等[5]发现,M1 型和M23 型以一定比例结合形成,电镜下以正交排列在星形胶质细胞中,其中M23 亚型是主要成分。正常情况下M1 型与M23 型结合的比例是较恒定的,但是在M23 突变后可以发生变化,改变质膜的通透性[6]。近年研究发现,对原代培养的大鼠星形胶质细胞用AQP4 亚型特异性的RNA 干扰(RNA interference,RNAi)后,有很大比例的M23 亚型来源于M1 亚型mRNA 的翻译,并且AQP4 M1 亚型mRNA 的5'非翻译区(5'UTR)通过多位点遗漏扫描机制(multiple-site leaky scanning mechanism),一个框外的上游开放阅读框(ORF)以及一个重起始机制调控M1/M23的比例[7]。
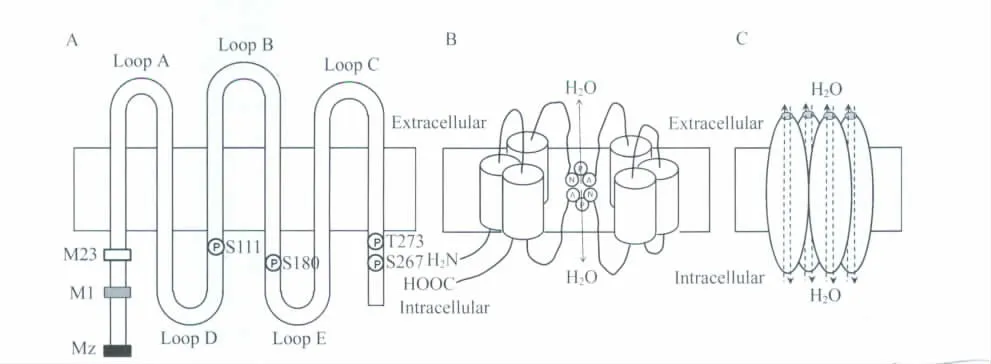
图1 水通道蛋白AQP4 结构及磷酸化位点示意图Fig.1 Schematic diagram of AQP4 structure and phosphorylation sites
在免疫组化分析脑中AQP4 主要存在于脑星形胶质细胞、毛细血管内皮细胞、室管膜上皮细胞、邻近软脑膜的胶质细胞及脉络丛上皮细胞中,覆盖超过95%的脑毛细血管表面,而在神经元和少突胶质细胞内均未见表达[8]。据文献报道[9],AQP4 在活化的小胶质细胞中有表达。免疫组化方法检测AQP4 在斑马鱼感觉器官中有表达,提示AQP4 可能参与斑马鱼感觉细胞的水平衡和离子运输[10]。除了参与调节水平衡和离子稳态,AQP4 还参与胶质母细胞瘤的细胞迁移、侵袭和附着[11]。对AQP4 在小鼠神经垂体上分布的研究提示AQP4 可能参与垂体细胞在渗透调节中的感受器效应[12]。AQP4 在大脑的大量分布以及在星形胶质细胞上的分布呈明显的极性,即在靠近血管内皮细胞的星形胶质细胞终足上大量表达,提示AQP4 是胶质细胞与脑脊液及血管之间水转运和调节的重要结构基础,在维持大脑水平衡中起重要作用,是脑水肿中重要的靶蛋白。
2 AQP4 的调节
AQP4 的快速短时程调节主要包括AQP4蛋白磷酸化和AQP4 在细胞内的分布;长时程调节主要有AQP4 表达变化、AQP4 蛋白在膜上不同的正交空间排列(orthogonal array)方式,以及AQP4 与其他蛋白如抗肌萎缩蛋白之间的相互作用[13-14]。
2.1 短时程调节
2.1.1 磷酸化调节 Ser180 位于胞质内D环,很多实验表明Ser180 参与PKC 介导的对于AQP4 磷酸化的调控,而PKC 的激活会导致AQP4 水通透性的快速降低。转染AQP4 的LLC-PK1 细胞中加入PKC 的激活剂二丁酸佛波醇酯(phorbol 12,13-dibutyrate,PDBu)后,细胞的通透性显著降低,同时32P 标记观察到AQP4 磷酸化增加,但是Ser180 位点突变可以逆转PKC 的抑制作用[15]。此外,PKC 的激活增加胶质瘤细胞AQP4 磷酸化,降低胶质瘤细胞水通透性[16]。除了Ser180 位点,PKC 激活剂同样也可以活化AQP4 的一些其他磷酸化位点(如Ser267 和Thr273)[17]。但是,目前没有直接证据显示与脑水肿直接相关的原代星形胶质细胞中内源AQP4 可以被PKC 磷酸化,从而降低细胞的水通透性[18-19]。
许多研究表明[6,20-21],Ser111 位点磷酸化可以增加AQP4 的水通透性。Gunnarson 证明,钙调蛋白通过磷酸化AQP4 的Ser111 位点,从而增加细胞的通透性,但是钙调蛋白并不直接磷酸化Ser111 位点,而是通过激活一氧化氮合酶(nitric oxide synthase,NOS)产生的NO,以及下游PKG 的活化对AQP4 磷酸化起调节作用[21]。在肾脏上皮细胞和爪蟾卵母细胞发现,AQP4 的Ser111 位点还能被PKA 磷酸化,并且可以增加细胞的水通透性[22-23]。因此,Ser111的磷酸化也是增加AQP4 水通透性的一个潜在的药理学靶点。AQP4 的Ser111 位点是一个能同时被PKG 和PKA 磷酸化的位点。AQP4 的Ser111 位点在星形胶质细胞系中被PKG 磷酸化,在肾脏上皮细胞中被PKA 磷酸化,是否可以同时被两种蛋白激酶磷酸化导致AQP4 的水通透性增加有待考证。近年研究表明,人类AQP4 蛋白Asp184 位点突变与AQP4 水通透性有关。全反射显微镜观察非洲爪蟾卵母细胞,发现Asp184 位点突变不改变AQP4 表达水平和膜定位,但是能引起细胞水通透性的急剧降低[24]。
2.1.2 胞内分布调节 有研究发现,组胺处理转染AQP4 的人类胃壁细胞系(HGT-1)激活PKA 介导AQP4 磷酸化伴随着AQP4 内在化[25]。AQP4 三种亚型水通透性是M1 >Mz >M23,在PKC 被激活后,表达这三种亚型蛋白的卵母细胞都出现由于AQP4 内在化而引起的水通透性下降,其中M23 对PKC 的调节更为敏感,内在化速度更快[4]。这些发现提示了PKA和PKC 可能通过对AQP4 在细胞上的分布进行调节,从而影响细胞的水通透性[25]。
2.2 长时程调节
2.2.1 表达水平调节 AQP4 在脑中的表达水平随发育过程而改变[26]。不少研究发现,AQP4 的mRNA 及蛋白水平在低氧和其他应激中发生变化。低氧下调大鼠原代星形胶质细胞AQP4 蛋白表达[27]。液体冲击性损伤(fluid percussion injury,FPI)能够显著诱导星形胶质细胞膜上AQP4 蛋白表达,而氧化和硝化应激(oxidative/nitrative stress,ONS)、促分裂素原活化蛋白激酶(mitogen-activated protein kinases,MAPK)、线粒体通透性转换作用(mitochondrial permeability transition,mPT)、核转录因子κB(nuclear factor kappa B,NF-κB)、Na-K-Cl 联合转运子(Na+,K+,Cl-cotransporter,NKCC)参与AQP4 的上调[28]。PKC 的激活下调大鼠原代星形胶质细胞AQP4 蛋白表达[17,29],而凝血酶可能通过PKC 途径降低原代星形胶质细胞AQP4 的蛋白表达[30]。Tanaka 等发现,ET-1 通过ETB 受体下调原代星形胶质细胞中AQP4 mRNA 和蛋白水平,提示ET-1 可以通过对AQP4 的水平调节从而影响星形胶质细胞水通透性[31]。
2.2.2 正交空间排列方式 AQP4 参与构成膜正交排列整列结构,冰冻灼刻电子显微图(freeze fracture electron micrographs,FFEM)显示,星形胶质细胞终足足突处的膜上有许多规则排列的立方体柱状结构的颗粒。这些颗粒形成特殊的图形,称之为正交排列阵颗粒(orthogonally arrays of paticle,OAP),参与调节血脑屏障对于水分子和离子的通透性,还起到调节细胞外间隙的作用。研究显示,与AQP4亚型M1 形成的四聚体相比,M23 四聚体构成的颗粒的膜内间隙更大,而M23 与M1 杂合四聚体形成的颗粒膜内间隙介于二者之间。提示可以通过影响AQP4 翻译起始位点调节OAP的大小从而调节细胞的水通透性[5]。
2.2.3 蛋白相互作用 抗肌萎缩蛋白成员之一的α-syntrophin 蛋白可能对AQP4 的定位和调节起重要作用。α-syntrophin 敲除小鼠的星形胶质细胞终足AQP4 减少[32]。在急性低钠血症引发的脑水肿中,α-syntrophin 敲除小鼠大脑水肿的程度显著低于野生型小鼠[33],提示α-syntrophin参与AQP4 的表达和定位。
3 脑水肿中AQP4 的调节
AQP4 的调节的直接效应是细胞膜通透性的改变。脑水肿主要分为血管源性脑水肿和细胞毒性脑水肿。血管源性脑水肿是指由于血管上皮细胞之间的紧密连接被破坏,血脑屏障(blood brain barrier,BBB)通透性增加,血液中大量液体进入脑实质的细胞外间隙,即血脑屏障被破坏。血管源性脑水肿主要发生于创伤[34]、肿瘤[35]、炎症[36]和低氧[37]等情况;而细胞毒性脑水肿发生在血脑屏障完整的情况下,主要是由于星形胶质细胞代谢紊乱从而影响了膜上钠钾泵的功能,引发大量水分子进入细胞,从而导致细胞水肿[38]。细胞毒性脑水肿主要发生于中毒[39]、创伤[40]、低氧[41]等情况。应激或各种疾病中发生的脑水肿常常血管源性脑水肿和细胞毒性同时存在,只是每种情况下其中一种水肿占主导地位。许多证据表明,AQP4是脑水肿过程的主要参与者[2,42]。无论是血管源性脑水肿的消退还是细胞毒性脑水肿的发生都依赖于AQP4 的开关和功能表达。因此,脑水肿的发生与否、发展以及严重程度很大程度上取决于AQP4 的调节。
3.1 血管源性脑水肿中AQP4 的调节 BBB是由血管内皮细胞和环绕着内皮细胞的星形胶质细胞终足所组成的。BBB 提供了一个在血管和大脑组织之间的高度选择性的屏障,维持血管微环境来稳定整个大脑的稳态。正常机体中大脑细胞间隙液体的产生和清除是平衡的,但病理状况会导致BBB 破坏,液体集聚,颅内压(intracranial pressure,ICP)升高,导致脑水肿的产生。血管源性脑水肿最主要的特点是BBB 的破坏和继发的血管内液渗漏到大脑实质的胞外间隙中。新近研究表明,肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)介导内皮细胞核转录因子P65 亚基的435 位点苏氨酸的磷酸化,破坏了内皮细胞间的紧密连接,从而参与了癫痫持续状态诱发的血管源性脑水肿[43]。由于血管源性脑水肿是BBB 的破坏,液体的渗漏而非细胞功能紊乱,所以AQP4 可能并不参与血管源性脑水肿的形成。研究证明,在血管源性脑水肿中AQP4 可以加速液体的重吸收。通过分别向野生型和AQP4 敲除小鼠大脑实质灌注等量人工脑脊液(cerebrospinal fluid,CSF)后发现,AQP4 敲除小鼠脑中水分和ICP 随时间降低明显减慢[44]。在三种血管源性脑水肿模型(皮层冻伤、肿瘤移植、脑脓肿)中,同样条件处理野生型和AQP4 敲除型小鼠可以造成等同的ICP,代表BBB 破坏程度相等;而在消退过程中AQP4 敲除小鼠脑内水含量和ICP 随时间的消退均明显减慢[44-45],提示血管源性脑水肿的清除过程需要AQP4 的参与。Tourdias 等也发现,炎症诱发的大鼠血管源性脑水肿的消退期AQP4 转录水平和翻译水平均显著升高,说明AQP4 和血管源性脑水肿的消退有关[46]。
机体通过AQP4 自身的开放和关闭控制水的进出来直接快速调节脑水肿,而AQP4 的开关主要由AQP4 的磷酸化来调控。AQP4 有很多的磷酸化位点(图1A),其中Ser180 和Ser111 是参与AQP4 动态调节的主要位点。PKC 的激活剂佛波醇酯能下调非洲爪蟾和肾脏上皮细胞的AQP4 水通透性[47],这种作用是通过PKC 磷酸化AQP4 S180 位点引起的,PKC触发的AQP4 水通透性下降很可能是一个关闭水通道的作用。很多的短时调节都是通过细胞膜上的激素受体所介导的,主要是G 蛋白偶联受体(G-protein coupled receptor,GPCR)。大多数的GPCR 激活后的胞内信号通路都是cAMP-PKA和PLC-PKC 通路。GPCR 的配体和激活剂包括一些激素和儿茶安酚类物质。血管加压素(vasopressin,AVP)参与大脑水分调节,可以激活两种受体V1 和V2[12]。V1 受体主要是PLC-PKC 通路,V2 受体是cAMP-PKA 通路。AVP 诱导的水通透性的变化主要都是通过V1受体。脑缺血、脑肿瘤和创伤等能够诱发血管源性脑水肿,而这些病理情况下脑内AVP 水平均升高[48-50],同时这些病理状况中脑水肿的早期阶段AQP4 的表达显著下降[51-53]。有研究发现,AVP 通过其GPCR 的1 型受体激活PKC,使AQP4 的S180 位点修饰改变,从而使AQP4 内在化,降低卵母细胞水通透性[54]。新近研究发现,AVP 的V1 受体的拮抗剂SR49059 能够重新激活AQP4 的表达减轻创伤引起的脑水肿[55]。以上研究提示脑缺血、脑肿瘤和创伤病理状况下释放增多的AVP 可能通过V1 受体关闭AQP4 以及降低AQP4 的表达量,从而阻碍其清除水肿的功能。
血管源性脑水肿的水肿液清除主要通过细胞外间隙和胶质细胞界膜至脑室和蛛网膜下腔,另外还通过胶质细胞终足和毛细血管内皮细胞入血[56],而AQP4 正是在大脑这些区域大量表达[2]。AQP4 的开放和表达升高有利于加速水肿的消退,可在一定程度减轻血管源性脑水肿。
3.2 细胞毒性脑水肿中AQP4 的调节 细胞毒性脑水肿的特点是血脑屏障完整,只是细胞自身的急性水肿,主要是星形胶质细胞的水肿。星形胶质细胞的肿胀是早期脑损伤的重要标志,是对脑缺血、低氧、创伤的反应。水中毒是研究细胞毒性脑水肿的模型,水中毒时水肿主要发生在围绕着神经元的星形胶质细胞终足处。在大脑损伤患者的脑组织中也发现了胶质细胞终足的特征性肿胀。在全身性渗透压改变后,大量分布AQP4 的星形胶质细胞选择性的水肿提示了AQP4 可能参与细胞毒性脑水肿的形成。为了进一步确定AQP4 在星形胶质细胞水肿中的作用,对AQP4 敲除的原代小鼠星形胶质细胞低渗诱导,发现AQP4 敲除的原代小鼠星形胶质细胞的水通透性比野生型降低了9倍[57]。Yang 等通过转基因方法过表达小鼠星形胶质细胞AQP4 蛋白,发现在腹膜注射去氨加压素(desmopressin,DDAVP)的水中毒模型中,AQP4 过表达的转基因小鼠细胞毒性脑肿胀更为快速[58]。在低氧处理大鼠星形胶质细胞模拟低氧脑缺血的模型中,相比于AQP4 敲除型星形胶质细胞,野生型细胞会更快速的肿胀,肿胀后细胞体积比AQP4 敲除细胞更大,提示AQP4 在促进水分进入星形胶质细胞中起着重要作用[27]。以上这些都说明AQP4 是重要的水转运通道,参与细胞毒性脑水肿的形成。在细胞毒性脑水肿中AQP4 能够加速水分进入细胞,也可能加速水肿细胞中水分的清除。有研究报道,检测野生型和AQP4 敲除型星形胶质细胞在等渗和低渗溶液中的变化情况,发现野生型星形胶质细胞肿胀和皱缩的速率都比AQP4 敲除型更快[56]。同时发现,低氧诱导野生型和AQP4 敲除型星形胶质细胞肿胀,复氧后二者肿胀的消退时间一致,但野生型星形胶质细胞的肿胀程度是AQP4 敲除型的1.3 倍,提示AQP4 可以加速低氧诱导的星形胶质细胞水肿的清除[27]。但目前没有研究直接证明AQP4 野生型和敲除型细胞是否有不同的清除速率。
低氧、缺血和中毒诱导的细胞毒性脑水肿与脑细胞的能量代谢密切相关。ATP 是细胞膜的钠钾泵运转的能源,以上三种病理状况都会影响ATP 合成,导致钠钾泵的失调,使细胞内离子浓度和渗透压升高[59-61]。渗透压是细胞肿胀的源动力,AQP4 除了可以被其他蛋白调节外,其本身的表达也对渗透压反应。在慢性渗透压变化刺激后,AQP4 在神经垂体的垂体细胞膜上表达增多[12],提示缺氧、缺血、中毒等导致ATP 合成减少,钠钾泵失调使细胞胞内高渗,细胞内外的渗透压变化可能通过上调AQP4 表达加速水分流入,形成细胞毒性脑水肿。同时有研究表明,钠钾泵通过AQP4 的K27 和W30 位点和AQP4 相联系,AQP4、钠钾泵和mGluR 复合物可能和大脑的水稳态有关,因此病理状态下钠钾泵的失调可能会影响AQP4 的水通透性[62]。此外,钙失衡也是细胞毒性脑水肿的重要原因。正常状态下细胞内外Ca2+极高的浓度差依赖钙泵来维持[63],在大脑缺氧缺血时,钙泵失调Ca2+进入细胞内[64],一方面升高细胞内离子浓度,改变渗透压,另一方面还可激活Ca2+依赖的磷脂酶,使膜磷脂分解,形成一系列包括白三烯在内的生物活性物质[65]。半胱氨酸白三烯受体2 (cysteinyl leukotriene receptor 2,CysLT 2)可通过激活ERK1/2 和p38 MAPK 通路介导星形胶质细胞中AQP4 的上调参与氧-葡萄糖剥夺和恢复(oxygen-glucose deprivation and recovery,OGD/R)模型诱导的缺血脑水肿[66]。研究发现,诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)在脑梗死和缺血损伤区域表达,低氧通过p38/MAPK 通路诱导小鼠小胶质细胞产生iNOS 和NO[67]。Gunarson 等发现,NO能够激活PKG 磷酸化AQP4 的S111 位点引起星形胶质细胞水肿[21]。因此缺血缺氧可能通过小胶质细胞产生的NO 对AQP4 进行调节引起细胞毒性脑水肿。
AQP4 的敲除、敲低或关闭能降低细胞毒性脑水肿的发生。但有研究发现,定向敲低星形胶质细胞AQP4 使细胞膜通透性降低的同时也造成了细胞生长抑制,而AQP4 敲除大鼠皮层星形胶质细胞的形态和生长特征并没有发现明显改变[68]。因此降低AQP4 的功能可以避免和减轻细胞毒性脑水肿,但敲低AQP4 并不能直接作为避免水肿发生的方法。
4 结论
AQP4 是参与大脑水平衡的重要蛋白。机体通过对AQP4 表达水平的长时程调节和多个磷酸化位点的短时程快速调节控制AQP4 的开关,以调节星形胶质细胞功能和对水的通透性,参与脑水肿的形成与消退。以上这些因素对水通道通透性的调节具有相似或者相反作用,提示生理及病理的多种刺激影响细胞的AQP4,而对AQP4 通透性的调节则是开放和关闭之间的时空结合。AQP4 的Ser180 和Ser111 位点及其他一些潜在的磷酸化位点的磷酸化调节机制可能是快速调节脑水肿的重要机制。脑水肿发生发展过程中的AQP4 分子开关调节机制是目前的研究热点。
[1]ZELENINA M,ZELENIN S,APERIA A.Water channels (aquaporins)and their role for postnatal adaptation[J].Pediatr Res,2005,57(5 Pt 2):47R-53R.
[2]TAIT M J,SAADOUN S,BELL B A,et al.Water movements in the brain:role of aquaporins [J].Trends Neurosci,2008,31(1):37-43.
[3]MOE S E,SORBO J G,SOGAARD R,et al.New isoforms of rat Aquaporin-4[J].Genomics,2008,91(4):367-377.
[4]FENTON R A,MOELLER H B,ZELENINA M,et al.Differential water permeability and regulation of three aquaporin 4 isoforms[J].Cell Mol Life Sci,2010,67(5):829-840.
[5]FURMAN C S,GORELICK-FELDMAN D A,DAVIDSON K G,et al.Aquaporin-4 square array assembly:opposing actions of M1 and M23 isoforms[J].Proc Natl Acad Sci USA,2003,100(23):13609-13614.
[6]SILBERSTEIN C,BOULEY R,HUANG Y,et al.Membrane organization and function of M1 and M23 isoforms of aquaporin-4 in epithelial cells[J].Am J Physiol Renal Physiol,2004,287(3):F501-511.
[7]PISANI F,ROSSI A,NICCHIA G P,et al.Translational regulation mechanisms of aquaporin-4 supramolecular organization in astrocytes [J].Glia,2011,59(12):1923-1932.
[8]YOOL A J.Aquaporins:multiple roles in the central nervous system[J].Neuroscientist,2007,13(5):470-485.
[9]TOMAS-CAMARDIEL M,VENERO J L,DE PABLOS R M,et al.In vivo expression of aquaporin-4 by reactive microglia[J].J Neurochem,2004,91(4):891-899.
[10]ZICHICHI R,MAGNOLI D,MONTALBANO G,et al.Aquaporin 4 in the sensory organs of adult zebrafish (Danio rerio)[J].Brain Res,2011,1384:23-28.
[11]DING T,MA Y,LI W,et al.Role of aquaporin-4 in the regulation of migration and invasion of human glioma cells [J].Int J Oncol,2011,38(6):1521-1531.
[12]MESBAH-BENMESSAOUD O,BENABDESSELAM R,HARDIN-POUZET H,et al.Cellular and subcellular aquaporin-4 distribution in the mouse neurohypophysis and the effects of osmotic stimulation[J].J Histochem Cytochem,2011,59(1):88-97.
[13]GUNNARSON E,ZELENINA M,APERIA A.Regulation of brain aquaporins [J].Neuroscience,2004,129(4):947-955.
[14]YUKUTAKE Y,HIRANO Y,SUEMATSU M,et al.Rapid and reversible inhibition of aquaporin-4 by zinc[J].Biochemistry,2009,48(51):12059-12061.
[15]ZELENINA M,ZELENIN S,BONDAR A A,et al.Water permeability of aquaporin-4 is decreased by protein kinase C and dopamine[J].Am J Physiol Renal Physiol,2002,283(2):F309-318.
[16]MCCOY E S,HAAS B R,SONTHEIMER H.Water permeability through aquaporin-4 is regulated by protein kinase C and becomes rate-limiting for glioma invasion [J].Neuroscience,2010,168(4):971-981.
[17]ZELENINA M.Regulation of brain aquaporins[J].Neurochem Int,2010,57(4):468-488.
[18]NICCHIA G P,ROSSI A,MOLA M G,et al.Actin cytoskeleton remodeling governs aquaporin-4 localization in astrocytes [J].Glia,2008,56(16):1755-1766.
[19]KADOHIRA I,ABE Y,NURIYA M,et al.Phosphorylation in the C-terminal domain of aquaporin-4 is required for golgi transition in primary cultured astrocytes [J].Biochem Biophys Res Commun,2008,377(2):463-468.
[20]GUNNARSON E,AXEHULT G,BATURINA G,et al.Lead induces increased water permeability in astrocytes expressing aquaporin 4 [J].Neuroscience,2005,136(1):105-114.
[21]GUNNARSON E,ZELENINA M,AXEHULT G,et al.Identification of a molecular target for glutamate regulation of astrocyte water permeability [J].Glia,2008,56(6):587-596.
[22]ZHENILO V M,BELIAEVSKII A D,BYCHKOV A A,et al.Computer analysis of components of general anesthesia [J].Anesteziol Reanimatol,2001(3):6-8.
[23]HAMABATA T,LIU C,TAKEDA Y.Positive and negative regulation of water channel aquaporins in human small intestine by cholera toxin [J].Microb Pathog,2002,32(6):273-277.
[24]NICCHIA G P,FICARELLA R,ROSSI A,et al.D184E mutation in aquaporin-4 gene impairs water permeability and links to deafness [J].Neuroscience,2011,197:80-88.
[25]CARMOSINO M,PROCINO G,TAMMA G,et al.Trafficking and phosphorylation dynamics of AQP4 in histamine-treated human gastric cells[J].Biol Cell,2007,99(1):25-36.
[26]NICO B,RIBATTI D,FRIGERI A,et al.Aquaporin-4 expression during development of the cerebellum[J].Cerebellum,2002,1(3):207-212.
[27]FU X,LI Q,FENG Z,et al.The roles of aquaporin-4 in brain edema following neonatal hypoxia ischemia and reoxygenation in a cultured rat astrocyte model[J].Glia,2007,55(9):935-941.
[28]RAO K V,REDDY P V,CURTIS K M,et al.Aquaporin-4 expression in cultured astrocytes after fluid percussion injury [J].J Neurotrauma,2011,28(3):371-381.
[29]GU F,HATA R,TOKU K,et al.Testosterone up-regulates aquaporin-4 expression in cultured astrocytes[J].J Neurosci Res,2003,72(6):709-715.
[30]TANG Y,CAI D,CHEN Y.Thrombin inhibits aquaporin 4 expression through protein kinase C-dependent pathway in cultured astrocytes[J].J Mol Neurosci,2007,31(1):83-93.
[31]TANAKA K,KOYAMA Y.Endothelins decrease the expression of aquaporins and plasma membrane water permeability in cultured rat astrocytes[J].J Neurosci Res,2011,89(3):320-328.
[32]AMIRY-MOGHADDAM M,XUE R,HAUG F M,et al.Alpha-syntrophin deletion removes the perivascular but not endothelial pool of aquaporin-4 at the blood-brain barrier and delays the development of brain edema in an experimental model of acute hyponatremia [J].FASEB J,2004,18(3):542-544.
[33]AMIRY-MOGHADDAM M,OTTERSEN O P.The molecular basis of water transport in the brain[J].Nat Rev Neurosci,2003,4(12):991-1001.
[34]KATADA R,NISHITANI Y,HONMOU O,et al.Expression of aquaporin-4 augments cytotoxic brain edema after traumatic brain injury during acute ethanol exposure [J].Am J Pathol,2012,180(1):17-23.
[35]DAVIES D C.Blood-brain barrier breakdown in septic encephalopathy and brain tumours [J].J Anat,2002,200(6):639-646.
[36]ZHANG X,LI H,HU S,et al.Brain edema after intracerebral hemorrhage in rats:the role of inflammation[J].Neurol India,2006,54(4):402-407.
[37]SCHOENE R B.Illnesses at high altitude [J].Chest,2008,134(2):402-416.
[38]NAG S,MANIAS J L,STEWART D J.Pathology and new players in the pathogenesis of brain edema[J].Acta Neuropathol,2009,118(2):197-217.
[39]CHU K,JUNG K H,KIM H J,et al.Diffusionweighted MRI and99mTc-HMPAO SPECT in delayed relapsing type of carbon monoxide poisoning:evidence of delayed cytotoxic edema[J].Eur Neurol,2004,51(2):98-103.
[40]MARMAROU A.A review of progress in understanding the pathophysiology and treatment of brain edema [J].Neurosurg Focus,2007,22(5):1-10.
[41]KALLENBERG K,BAILEY D M,CHRIST S,et al.Magnetic resonance imaging evidence of cytotoxic cerebral edema in acute mountain sickness[J].J Cereb Blood Flow Metab,2007,27(5):1064-1071.
[42]PAPADOPOULOS M C,VERKMAN A S.Aquaporin-4 and brain edema [J].Pediatr Nephrol,2007,22(6):778-784.
[43]KIM J E,RYU H J,CHOI S Y,et al.Tumor necrosis factor-alpha-mediated threonine 435 phosphorylation of p65 nuclear factor-kappaB subunit in endothelial cells induces vasogenic edema and neutrophil infiltration in the rat piriform cortex following status epilepticus [J].J Neuroinflammation,2012,9(1):1-13.
[44]PAPADOPOULOS M C,MANLEY G T,KRISHNA S,et al.Aquaporin-4 facilitates reabsorption of excess fluid in vasogenic brain edema [J].FASEB J,2004,18(11):1291-1293.
[45]BLOCH O,PAPADOPOULOS M C,MANLEY G T,et al.Aquaporin-4 gene deletion in mice increases focal edema associated with staphylococcal brain abscess[J].J Neurochem,2005,95(1):254-262.
[46]TOURDIAS T,MORI N,DRAGONU I,et al.Differential aquaporin 4 expression during edema build-up and resolution phases of brain inflammation[J].J Neuroinflammation,2011,8:143.
[47]FAZZINA G,AMORINI A M,MARMAROU C R,et al.The protein kinase C-activator phorbol myristate acetate decreases brain edema by aquaporin-4 downregulation after middle cerebral artery occlusion in the rat[J].J Neurotrauma,2010,27(2):453-461.
[48]MIURA M,TAKAGI S,MATSUKADO Y,et al.Influence of vasopressin level on osmotic pressure and sodium concentration in plasma and cerebrospinal fluid in patients with intracranial lesions[J].Neurol Med Chir (Tokyo),1989,29(9):806-810.
[49]TRABOLD R,KRIEG S,SCHOLLER K,et al.Role of vasopressin V(1a)and V2 receptors for the development of secondary brain damage after traumatic brain injury in mice [J].J Neurotrauma,2008,25(12):1459-1465.
[50]BARRECA T,GANDOLFO C,CORSINI G,et al.Evaluation of the secretory pattern of plasma arginine vasopressin in stroke patients [J].Cerebrovasc Dis,2001,11(2):113-118.
[51]KIENING K L,VAN LANDEGHEM F K,SCHREIBER S,et al.Decreased hemispheric aquaporin-4 is linked to evolving brain edema following controlled cortical impact injury in rats[J].Neurosci Lett,2002,324(2):105-108.
[52]MENG S,QIAO M,LIN L,et al.Correspondence of AQP4 expression and hypoxic-ischaemic brain oedema monitored by magnetic resonance imaging in the immature and juvenile rat [J].Eur J Neurosci,2004,19(8):2261-2269.
[53]FRIEDMAN B,SCHACHTRUP C,TSAI P S,et al.Acute vascular disruption and aquaporin 4 loss after stroke [J].Stroke,2009,40 (6):2182-2190.
[54]MOELLER H B,FENTON R A,ZEUTHEN T,et al.Vasopressin-dependent short-term regulation of aquaporin 4 expressed in xenopus oocytes [J].Neuroscience,2009,164(4):1674-1684.
[55]LIU X,NAKAYAMA S,AMIRY-MOGHADDAM M,et al.Arginine-vasopressin V1 but not V2 receptor antagonism modulates infarct volume,brain water content,and aquaporin-4 expression following experimental stroke [J].Neurocrit Care,2010,12(1):124-131.
[56]MANLEY G T,BINDER D K,PAPADOPOULOS M C,et al.New insights into water transport and edema in the central nervous system from phenotype analysis of aquaporin-4 null mice[J].Neuroscience,2004,129(4):983-991.
[57]PAPADOPOULOS M C,VERKMAN A S.Aquaporin-4 gene disruption in mice reduces brain swelling and mortality in pneumococcal meningitis[J].J Biol Chem,2005,280(14):13906-13912.
[58]YANG B,ZADOR Z,VERKMAN A S.Glial cell aquaporin-4 overexpression in transgenic mice accelerates cytotoxic brain swelling [J].J Biol Chem,2008,283(22):15280-15286.
[59]COMELLAS A P,DADA L A,LECUONA E,et al.Hypoxia-mediated degradation of Na,K-ATPase via mitochondrial reactive oxygen species and the ubiquitin-conjugating system [J].Circ Res,2006,98(10):1314-1322.
[60]UNTERBERG A W,STOVER J,KRESS B,et al.Edema and brain trauma [J].Neuroscience,2004,129(4):1021-1029.
[61]TOMBAUGH G C,SAPOLSKY R M.Corticosterone accelerates hypoxia-and cyanideinduced ATP loss in cultured hippocampal astrocytes[J].Brain Res,1992,588(1):154-158.
[62]LEE M,LEE S J,CHOI H J,et al.Regulation of AQP4 protein expression in rat brain astrocytes:role of P2X7 receptor activation[J].Brain Res,2008,1195:1-11.
[63]LEHOTSKY J,KAPLAN P,MURIN R,et al.The role of plasma membrane Ca2+pumps (PMCAs)in pathologies of mammalian cells [J].Front Biosci,2002,7:d53-84.
[64]PRUNIER F,KAWASE Y,GIANNI D,et al.Prevention of ventricular arrhythmias with sarcoplasmic reticulum Ca2+ATPase pump overexpression in a porcine model of ischemia reperfusion[J].Circulation,2008,118(6):614-624.
[65]LAWAL A O,ELLIS E M.Phospholipase C mediates cadmium-dependent apoptosis in HEK 293 cells [J].Basic Clin Pharmacol Toxicol,2011,110(6):510-517.
[66]QI L L,FANG S H,SHI W Z,et al.CysLT2 receptor-mediated AQP4 up-regulation is involved in ischemic-like injury through activation of ERK and p38 MAPK in rat astrocytes [J].Life Sci,2011,88(1-2):50-56.
[67]PARK S Y,LEE H,HUR J,et al.Hypoxia induces nitric oxide production in mouse microglia via p38 mitogen-activated protein kinase pathway [J].Brain Res Mol Brain Res,2002,107(1):9-16.
[68]NICCHIA G P,FRIGERI A,LIUZZI G M,et al.Inhibition of aquaporin-4 expression in astrocytes by RNAi determines alteration in cell morphology,growth,and water transport and induces changes in ischemia-related genes [J].FASEB J,2003,17(11):1508-1510.
