一种基于铜配合物的高灵敏硫化氢荧光探针
2013-10-17陈韵聪郭子建何卫江
黄 彬 陈韵聪 郭子建 何卫江
(南京大学化学化工学院配位化学国家重点实验室,南京 210093)
0 引 言
硫化氢是继NO与CO之后的第三个被确认的人体气体信号分子,在神经信号传导过程中起着十分重要的调节作用[1-4]。同时硫化氢还被发现在心血管系统中也具有许多重要的生理功能,如调节血管平滑肌的舒张、抗氧化、抑制发炎、降低新陈代谢速率等[5-9]。硫化氢水平异常还被认为与阿尔兹海默氏症、唐氏综合症、糖尿病和肝硬化等密切相关[10-13]。硫化氢的生理学和病理学功能研究已经成为目前化学与生物学研究的热点,而发展准确快捷的硫化氢检测方法成为该领域的关键课题之一。传统H2S检测技术包括比色法、电化学法和气相色谱法等[14-19]。这些方法不仅需要进行样品预处理,而且无法进行细胞和活体中硫化氢的实时原位检测,也不能提供空间分布信息。这也正是目前体内各组织的硫化氢浓度水平存在较大争议的主要原因[20-22]。
由于灵敏度高、响应快和可实现生物实时造影等特点,荧光分析和造影已成为生物分子实时跟踪的重要手段和研究热点。近年来硫化氢荧光探针的研究逐渐引起人们的关注,已有多例硫化氢荧光探针的研究报道[23-32]。这些荧光探针有的已可用于血液中H2S的检测或者细胞中的成像,对内源性硫化氢检测研究有极大的促进作用。由于硫化氢的pKa1约为 7.04,在生理(pH 7.40)条件下硫化氢会发生脱质子解离作用,胞内H2S与HS-的比例约为1∶2(nH2S∶)。因此文献中常以NaHS或Na2S作为H2S供体进行探针响应性能的研究。
硫化氢荧光探针主要有3种设计策略:1.利用硫化氢的还原性将探针的叠氮基团还原为氨基从而改变探针分子的荧光性质[23-24];2.利用硫化氢的亲核性通过对探针分子的亲核进攻改变探针分子的荧光性质[25-27];3.利用 S2-与 Cu2+极强的亲和力(溶度积常数KSP=6×10-36)将Cu2+从与荧光配体形成的铜配合物中脱除。由于具有顺磁效应的Cu2+具有猝灭荧光的特点,相应铜配合物的荧光很弱。Cu2+的脱除可以使得荧光配体的荧光得到恢复,表现出对硫化氢的荧光增强响应[28-30]。目前大部分报道的硫化氢荧光探针采用前两种设计策略。这两种设计策略中使用的化学反应大多不可逆,探针基本不能重复利用,而且多数反应需要较长的时间完成(10~120 min),难以实现硫化氢的快速跟踪和实时检测。第三种设计策略有其独特的优势,脱除反应不仅响应迅速有利于实现硫化氢的快速跟踪,而且释放出的荧光配体可与Cu2+重新结合形成配合物探针实现再利用。同时由于CuS的溶度积非常小,该类探针对S2-往往具有很高的灵敏度。本研究基于第三种策略设计了一个新的基于铜配合物的H2S荧光探针,其中的荧光配体1通过将4-氨基-7-硝基-2,1,3-苯并噁二唑 (NBD)荧光团的4-氨基修饰为水溶性的铜离子螯合团三乙烯四胺而获得。采用NBD荧光团则是因为其可见光激发性能有利于降低生物样本检测中的光毒性和自发荧光干扰。同时其较大的斯托克斯位移、良好的水溶性和生物相容性也有利于探针的实际应用。荧光配体1的合成路线如图1所示。

图1 荧光配体1的合成路线Fig.1 Synthesis of fluorescent ligand 1
1 实验部分
1.1 试剂和仪器
合成中所用主要试剂为南京大学化学化工学院采购的国产试剂。Boc-ON和NBD-Cl购自Aldrich,三乙烯四胺为化工厂工业品。光谱测试中的溶剂为Aldrich光谱纯溶剂,配制溶液用水为二次水,HEPES和各类无机盐也来自Aldrich。电喷雾质谱由LCQ电喷雾质谱仪(ESI-MS,Thermo Finnigan)测定,同位素分布峰分析采用ISOPRO程序模拟。核磁共振谱分别在Bruker DRX-500和Bruker DRX-300核磁共振波谱仪上采集。吸收光谱用Shimadzu UV-3100分光光度计测定。荧光光谱由AMINCO Bowman series 2荧光光谱仪记录。pH值用PHS-3精密pH计记录。
1.2 荧光配体1的合成
100 mL三颈瓶中加入三乙烯四胺(720 mg,4.92 mmol)和25 mL THF,冰浴下搅拌滴加30 mL含Boc-ON(2.47 g,10.03 mmol)的THF溶液。1 h内滴加完毕后室温继续搅拌18 h。脱去溶剂后进行柱层析分离得淡黄色固体 2(二氯甲烷/甲醇,4∶1,V/V),产量:1.18 g,产率:69.4%。
100 mL圆底烧瓶中分别加入化合物2(0.346 g,1.0 mmol)、NBD-Cl(0.199 g,1.0 mmol)、无水碳酸钾和15 mL乙腈,室温搅拌4 h后抽滤。滤液脱去溶剂后获得的残余物经柱层析(二氯甲烷/乙酸乙酯,4∶1,V/V)后得化合物 3,产量:240 mg,产率:47.2%。
25 mL圆底烧瓶中分别加入化合物3(0.204 g,0.4 mmol)、2 mL二氯甲烷和1 mL三氟乙酸。室温搅拌2 h后脱去溶剂即得荧光配体1,产量:112 mg,产率:91.2%。1H NMR(500 MHz,D2O,ppm)δ:8.37(d,J=8.5 Hz,1H),6.29 (d,J=8.5 Hz,1H),3.67(br,2H),3.08 (t,J=6.3 Hz,4H),2.96 (t,J=6.2 Hz,2H),2.89 (t,J=6.3 Hz,4H).13C NMR (125 MHz,D2O)δ:145.96,143.91,143.60,138.58,119.99,100.58,50.36,40.81,37.06.MS-ESI (positive mode,m/z):Calcd.310.15,Found 310.25 for[M+H]+.
1.3 荧光配体1的光谱测试
取化合物1的DMSO储备液加入到100 mL容量瓶中,以含5%DMSO(V/V)的HEPES缓冲溶液(50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH 7.20)定 容配制成浓度分别为 100 μmol·L-1和 10.0 μmol·L-1的溶液。荧光配体1的吸收光谱利用前者测定,而其Cu2+滴定吸收光谱测定是通过向3 mL上述溶液(100 μmol·L-1)中分别加入不同体积的Cu2+水溶液(12 mmol·L-1,每次 2.5 μL)充分混匀后测定。 化合物 1的荧光光谱测定利用浓度为10.0 μmol·L-1的溶液测试完成,其Cu2+荧光滴定光谱则是通过向3 mL溶液中分别加入不同体积的Cu2+水溶液(1.2 mmol·L-1,每次加2.5 μL)后进行测定的。
1.4 荧光配体1对不同金属离子的荧光响应测试
化合物1对金属离子的荧光选择性响应实验在含 5%DMSO(V/V)的 HEPES缓冲溶液(50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH 7.20)中进行。 在向3 mL 化合物 1 溶液(10.0 μmol·L-1)中加入 2.5 μL 金属离子水溶液充分混匀后进行荧光光谱测定。测定碱金属或碱土金属离子响应时溶液中被测金属总浓度为化合物1浓度的1 000倍。测定其他金属离子响应时被测金属离子的总浓度与化合物1浓度相等。
1.5 配合物1-Cu2+的S2-荧光滴定
实验同样在前述含5%DMSO的HEPES缓冲溶液中进行。配合物探针1-Cu2+通过加入等当量的荧光配体1和Cu2+形成。滴定通过逐渐向3 mL 1-Cu2+配合物溶液(10.0 μmol·L-1)中加入不同体积的Na2S水溶液(1.2 mmol·L-1,每次加 2.5 μL)进行,光谱测定均在充分混匀后完成。
1.6 配合物1-Cu2+的阴离子荧光选择性响应测试
配合物探针1-Cu2+对阴离子的选择性响应能力及S2-与其他阴离子的竞争响应实验也在前述的HEPES缓冲溶液中进行。选择性实验中向3 mL配合物 1-Cu2+(10.0 μmol·L-1)溶液中分别加入 12.5 μL浓度为 12 mmol·L-1硫化钠水溶液(5 equiv)或12.5 μL浓度为480 mmol·L-1的其他阴离子 (100 equiv)溶液,充分混匀后分别进行荧光光谱测定。竞争实验中则在加入12.5 μL浓度为480 mmol·L-1的竞争阴离子溶液后继续加入12.5 μL浓度为12 mmol·L-1硫化钠水溶液,充分混合后进行测定。
1.7 探针1-Cu2+的线性响应范围及检测限测定
测试在含 10 μmol·L-11-Cu2+配合物的前述缓冲溶液中进行。向3 mL探针溶液中分别加入不同体积的 Na2S 水溶液(1.2 mmol·L-1),每次加 2.5 μL,充分混匀后进行荧光测试。检测限测试先扫描背景20遍,获得标准偏差σ,再根据线性范围内的斜率(S)利用3σ/S求出检测限。
2 结果与讨论
2.1 荧光配体1的Cu2+紫外滴定研究
自由荧光配体1的最大吸收峰出现在478 nm,相对摩尔吸光系数为 1.7×104L·mol-1·cm-1(图 2)。 随着Cu2+的加入,该吸收峰逐渐降低并发生蓝移,同时在400 nm处的吸收逐渐增强。滴定光谱在455、350及310 nm处有3个清晰的等吸收点,表明化合物1与Cu2+发生了配位作用形成了稳定的配合物。从根据478和400 nm处的吸收强度绘制的滴定曲线可以看出荧光配体1的吸收随着加入Cu2+总浓度发生线性变化。在加入1倍的Cu2+后继续滴加Cu2+吸收光谱趋于稳定。这些结果表明化合物1与Cu2+是以1∶1方式配位结合的。根据NBD类荧光分子的相关报道可推测478 nm处的吸收峰为NBD的分子内电荷转移(ICT)吸收峰[33-34],而当4-氨基参与配位后ICT效应减弱并导致吸收峰发生蓝移。
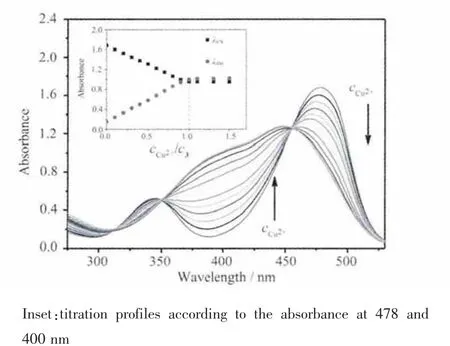
图2 荧光配体 1(100 μmol·L-1)在含 5%DMSO(V/V)的HEPES 缓冲溶液(50mmol·L-1HEPES,100 mmol·L-1KNO3,pH 7.20)中的Cu2+紫外滴定光谱图Fig.2 Absorption spectra of compound 1(100 μmol·L-1)obtained upon Cu2+titration in HEPES buffer(50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH 7.20)containing 5%DMSO(V/V)
2.2 荧光配体1的Cu2+荧光滴定研究
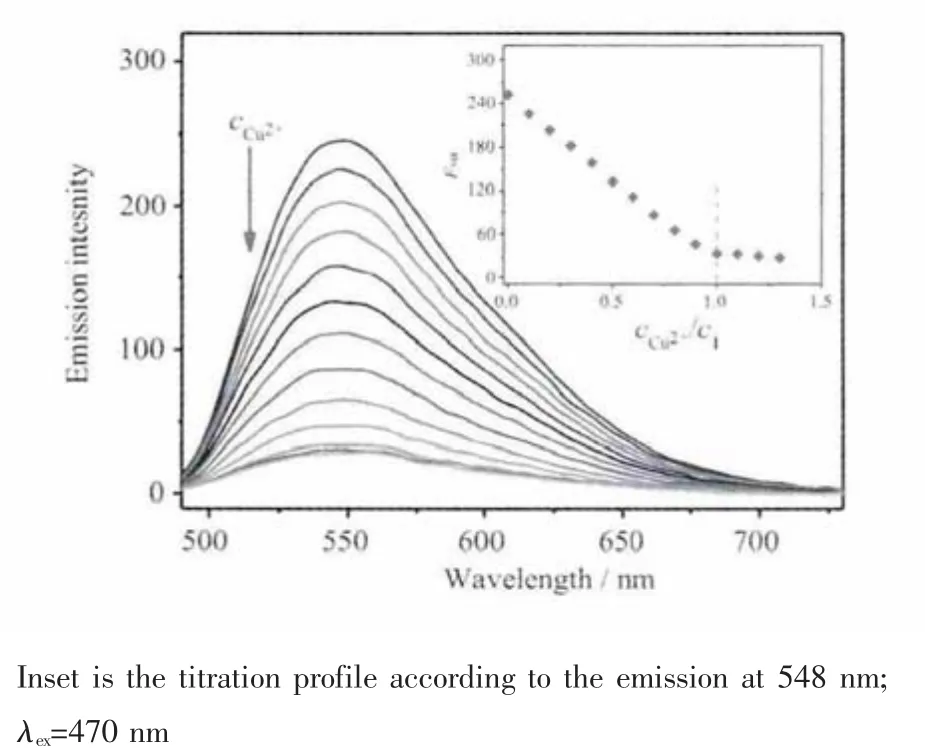
图3 荧光配体 1(10 μmol·L-1)在含 5%DMSO(V/V)的HEPES 缓冲溶液(50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH7.20)中的 Cu2+荧光滴定光谱图Fig.3 Emission spectra of compound 1(10 μmol·L-1)obtained in HEPES buffer(50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH 7.20)containing 5%DMSO(V/V)upon Cu2+titration
荧光光谱测定发现自由荧光配体1的最大激发波长为470 nm,最大荧光发射波长为548 nm,斯托克斯位移将近80 nm,有利于降低荧光检测中激发的干扰,达到设计目的。从Cu2+荧光滴定结果可以看出(图3),化合物1的荧光强度随着Cu2+浓度的增加线性降低,而发射波长并没有移动。当加入Cu2+的量达到1当量后继续滴加则荧光光谱变化很小,也再次证实了化合物1与Cu2+的1∶1配位方式。Cu2+滴定导致的荧光显著降低的原因是顺磁性Cu2+配位后引起化合物1的荧光发生显著猝灭,这也是顺磁性金属离子的一个重要特性。Cu2+这种对配体荧光的显著猝灭作用为发展基于铜配合物Cu2+脱除的S2-增强响应奠定了基础。
2.3 荧光配体1对不同金属离子的荧光响应
荧光配体1(10 μmol·L-1)对不同金属离子的荧光响应行为同样在前述HEPES缓冲中测定 (图4)。实验结果显示只有Cu2+造成显著的荧光猝灭,等当量Cu2+可导致近90%的荧光猝灭。其他金属离子对化合物1的荧光影响不大,Hg2+虽然也造成一定的荧光猝灭,但猝灭效应明显小于Cu2+。由于Cu2+配位导致该荧光配体的荧光猝灭效应最强,相应配合物在金属离子脱除过程中显示的荧光增强效应将会更加显著,因此化合物1的铜配合物更具有作为荧光增强型硫化氢探针的潜力。

图4 不同金属离子对含5%DMSO(V/V)的HEPES缓冲溶液(50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH7.20)中荧光配体 1(10 μmol·L-1)在 548 nm处荧光的猝灭效应(λex=470 nm)Fig.4 Emission decreasing factor at 548 nm of compound 1(10 μmol·L-1)induced by different metal cations in HEPES buffer(50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH 7.20)containing 5%DMSO(V/V)(λex=470 nm)
2.4 配合物1-Cu2+对硫化氢荧光响应研究

图5 含 5%DMSO(V/V)的 HEPES缓冲溶液(50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH 7.20)中配合物 1-Cu2+(10 μmol·L-1)对硫化氢的荧光响应Fig.5 Emission spectra of complex 1-Cu2+(10 μmol·L-1)obtained upon S2-titration in HEPES buffer(50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH 7.20)containing 5%DMSO
配合物1-Cu2+对硫化氢荧光响应研究同样在前述含5%DMSO的HEPES缓冲溶液中完成(图5),实验中采用Na2S作为硫化氢供体,配合物通过加入等当量的荧光配体和铜离子现场形成。实验结果显示随着加入S2-浓度的增加体系的荧光强度明显增强,荧光增强可达8倍以上。这表明S2-确实能将配合物体系中的Cu2+夺去并逐步恢复荧光配体1的荧光,实现对S2-的增强响应。同时滴定实验发现荧光增强响应几乎在硫化钠滴加的瞬间完成,表明这一探针对硫化氢的响应速度非常快,可以满足硫化氢动态跟踪的需要,也完全符合前述配合物脱除铜离子的响应机制。从相应的荧光响应照片(图6)可以看出在紫外光照射下1-Cu2+配合物溶液几乎没有荧光,而当5当量的Na2S加入之后溶液瞬间发出黄色荧光,而且与化合物1在紫外灯照射下发出的荧光一致,显示化合物1的荧光在硫化钠加入后得到恢复。这一现象也表明配合物1-Cu2+对硫化氢的荧光识别非常灵敏可靠,可以通过肉眼观察来实现。由荧光滴定曲线可以看出配合物1-Cu2+对硫化氢的线性响应范围为 1~20 μmol·L-1。 根据 1.7 所述实验和计算方法确定配合物探针对硫化氢的检测低限为0.2 μmol·L-1,而文献中目前报道的绝大多数探针检测限在1 μmol·L-1以上[32],这也表明配合物 1-Cu2+体系具有较高的灵敏度。将荧光得到恢复的溶液再加入Cu2+,荧光再度发生类似于图3中出现的猝灭现象,说明本体系可以用于重复检测H2S。

图6 紫外灯照射下配合物1-Cu2+(10 μmol·L-1)在含5%DMSO(V/V)的 HEPES 缓冲溶液(50 mmol·L-1 HEPES,100 mmol·L-1KNO3,pH 7.20)中对 Na2S的荧光响应照片Fig.6 Photograph of complex 1-Cu2+(10 μmol·L-1)in HEPES buffer(50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH 7.20)containing 5%DMSO under the irradiation with UV lamp of 365 nm

图7 10 μmol·L-1配合物 1-Cu2+在含 5%DMSO(V/V)的 HEPES 缓冲溶液(50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH 7.20)中对不同阴离子的荧光响应(a)及由不同阴离子引发的548 nm处荧光增强比例柱状图(b)Fig.7 (a)Emission spectra of 10 μmol·L-1complex 1-Cu2+obtained in the presence of 5 equiv S2-or 100 equiv other anions in HEPES buffer(50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH 7.20)containing 5%DMSO.(b)Histogram of F/F0at 548 nm of 1-Cu2+in the presence of different anions
2.5 配合物1-Cu2+对硫化氢荧光响应的选择性
为明确配合物1-Cu2+对硫化氢荧光识别的选择性,研究还在前述HEPES缓冲溶液中测定了其他阴离子存在下该配合物的荧光光谱。测定中探针浓度为 10 μmol·L-1,S2-浓度为 50 μmol·L-1,其他阴离子浓度为 1 000 μmol·L-1。实验结果显示(图 7),配合物1-Cu2+溶液加入 100倍其他阴离子如 Ac-、SO42-、HSO42-、F-、Cl-、Br-、I-、HCO32-、CO32-、HPO42-、 H2PO4-、NO2-、SCN-、HSO32-、SO32-、S2O32-、S2O42-时荧光强度变化很小。相反加入5当量的S2-可使探针体系的荧光显著增强8倍以上。同时即使在高浓度的其他阴离子存在下,配合物1-Cu2+对硫化氢的增强响应也不受明显影响。这些结果表明配合物探针1-Cu2+对硫化氢的增强响应具有很好的选择性,大浓度其他常见阴离子的存在不会干扰对硫化氢的检测。这也为该探针的生物检测应用奠定了基础。
3 结 论
本研究设计的基于NBD荧光团的荧光配体1能与Cu2+形成1∶1的配合物1-Cu2+,并使其荧光显著猝灭。配合物1-Cu2+能选择性地对硫化氢表现出8倍以上的荧光增强响应。荧光响应机理是S2-与Cu2+结合将Cu2+从配合物中有效脱除进而解除了Cu2+对荧光配体的荧光猝灭效应,导致配体荧光恢复增强。该体系具有响应迅速、可重复利用的特点,灵敏度也高于大部分目前报道的硫化氢探针。探针的可见光激发特点及良好的硫化氢响应性能使得该体系在检测生物样品中的硫化氢方面具有广阔的应用前景。
[1]Szabo C.Nat.Rev.Drug Discovery 2007,6:917-935
[2]Lowicka E,Beltowski J.Pharmacol.Rep.,2007,59:4-24
[3]Li L,Rose P,Moore P K.Annu.Rev.Pharmacol.Toxicol.,2011,51:169-187
[4]DU Jun-Bao(杜军保),CHEN Xiao-Bo(陈小波),GENG Bin(耿彬),et al.J.Peking Univ.:Health Sci.(Beijing Daxue Xuebao:Yixue Ban),2002,34(2):187-187
[5]QIU Wen-Bing(邱文冰),JIN Hong(金红),WANG Dong-Ming(王东明).Adv.Cardiovasc.Dis.(Xinxueguan Bingxue Jinzhan),2006,27(suppl 1):84-87
[6]Yang G D,Wu L Y,Jiang B,et al.Science,2008,322:587-590
[7]Yang C,Yang Z,Zhang M,et al.PLoS ONE,2011,6:e21971
[8]LiL,BhatiaM,ZhuYZ,etal.FASEBJ.,2005,19:1196-1198
[9]Blackstone E,Morrison M,Roth M B.Science,2005,308:518-518
[10]Eto K,Asada T A,Arima K,et al.Biochem.Biophys.Res.Commun.,2002,293:1485-1488
[11]Kamoun P,Belardinelli M-C,Chabli A,et al.Am.J.Med.Genet.Part A,2003,116:310-311
[12]Yang W,Yang G,Jia X,et al.J.Physiol.,2005,569:519-531
[13]Fiorucci S,Antonelli E,Mencarelli A,et al.Hepatology,2005,42:539-548
[14]Lei W,Dasgupta P K.Anal.Chim.Acta,1989,226:165-170
[15]Jimnez D,Matinez-manez R,Sancenon F,et al.J.Am.Chem.Soc.,2003,125:9000-9001
[16]Richardson C J,Magee E A M,Cummings J H.Clin.Chim.Acta,2000,293:115-125
[17]SearcyDG,PetersonMA.Anal.Biochem.,2004,324:269-275
[18]Radford-KnoeryJ,CutterGA.Anal.Chem.,1993,65:976-982
[19]Berube P R,Parkinson P D,Hall E R.J.Chromatogr.A,1999,830:485-489
[20]Kabil O,Banerjee R.J.Biol.Chem.,2010,285:21903-21907
[21]Olson K R.Biochim.Biophys.Acta Bioenerg.,2009,1787:856-863
[22]Furne J,Saeed A,Levitt M D.Am.J.Physiol.Regul.Integr.Comp.Physiol.,2008,295:R1479-R1485
[23]Lippert A R,New E J,Chang C J.J.Am.Chem.Soc.,2011,133:10078-10080
[24]Peng H,Cheng Y,Dai C,et al.Angew.Chem.Int.Ed.,2011,50:9672-9765
[25]Liu C,Pan J,Li S,Zhao Y,et al.Angew.Chem.Int.Ed.,2011,50:10327-10329
[26]Qian Y,Karpus J,Kabil O,et al.Nat.Commun.,2011,2:495
[27]Chen Y,Zhu C,Yang Z,et al.Angew.Chem.Int.Ed.,2013,52:1688-1691
[28]Sasakura K,Hanaoka K,Shibuya N,et al.J.Am.Chem.Soc.,2011,133:18003-18005
[29]Hou F,Huang L,Xi P,et al.Inorg.Chem.,2012,51:2454-2460
[30]HouF,HuangL,XiP,etal.DaltonTrans.,2012,41:5799-5804
[31]Xuan W,Sheng C,Cao Y,et al.Angew.Chem.Int.Ed.2012,51:2282-2284
[32]LinVS,ChangCJ.Curr.Opin.Chem.Biol.,2012,16:595-601
[33]Qian F,Zhang C,Zhang Y,et al.J.Am.Chem.Soc.,2009,131:1460-1468
[34]Uchiyama S,Santa T,Fukushima T,et al.J.Chem.Soc.,Perkin Trans.2.,1998:2165-2174