LSC-500螯合树脂脱除钙离子的工艺研究
2013-10-17谢英惠袁俊生
谢英惠,赵 欣,袁俊生
(河北工业大学海水资源高效利用化工技术教育部工程研究中心,天津 300130)
在海水提取钾离子的过程中,以天然斜发沸石做吸附剂,海水经过吸附、洗脱等方法可制取高浓度含钾溶液,该溶液经过蒸发、结晶、分离可制取钾盐[1]。可是,这种富含钾离子的溶液中含有的钙极易形成碳酸钙等物质使设备内壁结垢,严重影响设备的正常使用,并且会降低钾盐纯度,因此需要脱除溶液中的钙。目前,国内外对钙的去除已经进行了大量的研究,如沉淀法[2]、物理吸附法[3]、萃取法[4]和膜分离法[5]等。但是,这些方法普遍存在能耗高、试剂消耗量多、净化深度不够等缺点;膜分离法对进水水质要求高,增加水处理成本。然而,离子交换树脂具有特殊的选择性并可重复利用,因此得到了广泛应用,常被用来与金属离子进行交换,达到分离效果。笔者通过多种离子交换剂筛选,确定LSC-500螯合树脂为除钙剂,并对其去除钙离子的行为进行了研究,为利用离子交换树脂脱除钙离子提供了实验依据,对海水提钾的应用具有重要的理论意义。
1 实验部分
1.1 实验试剂及仪器
试 剂:LSC-500、D152、D401、D418、001×7、001×14.5树脂;氯化钾、氯化钠为工业级,六水合氯化镁、无水氯化钙为分析纯试剂。实验所用富钾液中各阳离子质量浓度:K+,9.69 g/L;Na+,108.80 g/L;Ca2+,0.53 g/L;Cl-,177.69 g/L。
仪器:AA320型原子吸收分光光度计,DZKWS-4型恒温水浴锅,WH8401-50型多功能电动搅拌器,78-1A型磁力搅拌器,DL-101-1BS型电热鼓风干燥箱,FA1004型电子天平,电炉,微量滴定管等。
1.2 实验过程
1.2.1 树脂的筛选实验
分别取相同质量的 LSC-500、D152、D401、D418、001×7和 001×14.5树脂,置于三口烧瓶中,各加入100 mL富钾液,在相同的操作条件下进行静态吸附实验,直至吸附达到平衡为止,测定反应之后富钾液中的Ca2+含量,计算树脂对Ca2+的平衡吸附量。
1.2.2 反应时间对钙离子脱除率的影响
取12份4 g左右的LSC-500树脂加入三口烧瓶中,分别加入100 mL富钾液,在20℃条件下进行静态吸附, 分别在 5、10、15、20、30、40、50、60、90、120、150、180 min时取样,测定反应之后富钾液中的Ca2+含量,计算 Ca2+脱除率。
1.2.3 反应温度对钙离子脱除率的影响
取7份4 g左右的LSC-500树脂加入三口烧瓶中,分别加入 100 mL 富钾液,分别在 25、35、45、55、65、75、85℃条件下静态吸附180 min,测定反应之后富钾液中的Ca2+含量,计算Ca2+脱除率。
1.2.4 LSC-500树脂对钙离子的静态全交换容量的测定
还有一个孩子叫管玹,网名叫“黎雨”,也是个热爱阅读的孩子,她读了很多我的小说后,开始进行小说创作。现在她已经长大,清华大学毕业。她说自己高考时期也一直坚持阅读和写作,虽然会占用一定的学习时间,但她自己就会更自觉地提高学习效率。
称取3份1 g左右的LSC-500螯合树脂,分别装入三口烧瓶中,各加入富钾液100 mL,在25℃的恒温水浴槽中分多次进行离子交换反应。当反应前后溶液中Ca2+质量浓度不变时,即达到离子交换平衡。测定此时溶液中的Ca2+质量浓度,计算LSC-500螯合树脂对Ca2+的全交换容量,并求平均值。树脂对Ca2+的全交换容量按式(1)计算。

式中:Q为单位质量树脂对Ca2+的全交换容量,mg/g;ρ0为富钾液中Ca2+初始质量浓度,mg/L;ρ为平衡时溶液中 Ca2+质量浓度,mg/L;V 为富钾液体积,L;m为树脂质量,g。
1.2.5 吸附动力学分析
称取12份2g左右的LSC-500树脂,置于250 mL三口烧瓶中,分别加入100 mL富钾液,放入恒温水浴槽中,在20℃下恒温搅拌进行吸附反应,分别在5、10、15、20、30、40、50、60、90、120、150、180 min 时取样,测定溶液中Ca2+质量浓度,计算出树脂对Ca2+的吸附量。在35℃和50℃分别重复上述实验。
2 结果与讨论
2.1 树脂的筛选结果
使用不同类型的树脂,在相同的操作条件下对富钾液中的钙离子进行静态吸附实验,绘制树脂对钙离子的平衡吸附量Qe随树脂用量的变化曲线,结果如图1所示。由图1可知,在相同的操作条件下,LSC-500型树脂对富钾液中的Ca2+吸附量最大。因此实验选用LSC-500型螯合树脂进行富钾液中Ca2+的吸附研究。
2.2 反应时间对钙离子脱除率的影响
图2为反应时间对Ca2+脱除率的影响。实验结果表明,随着时间的延长,Ca2+的脱除率先增大后趋于定值。由图2可知,在0~60 min,树脂对Ca2+的脱除率快速升高,这是由于开始时Ca2+主要被树脂的外表面吸附,在不断搅拌条件下,固液界面上的扩散较容易进行。随着反应的不断进行,溶液中Ca2+浓度逐渐减小,并且Ca2+沿树脂的微孔向树脂的内部扩散时扩散阻力逐渐增大,从而吸附速率随着时间的延长不断减小[6]。 60 min 以后,Ca2+的脱除率增大趋势变缓,150 min时吸附达到平衡。为确保反应完全,实验中选择反应时间为180 min。
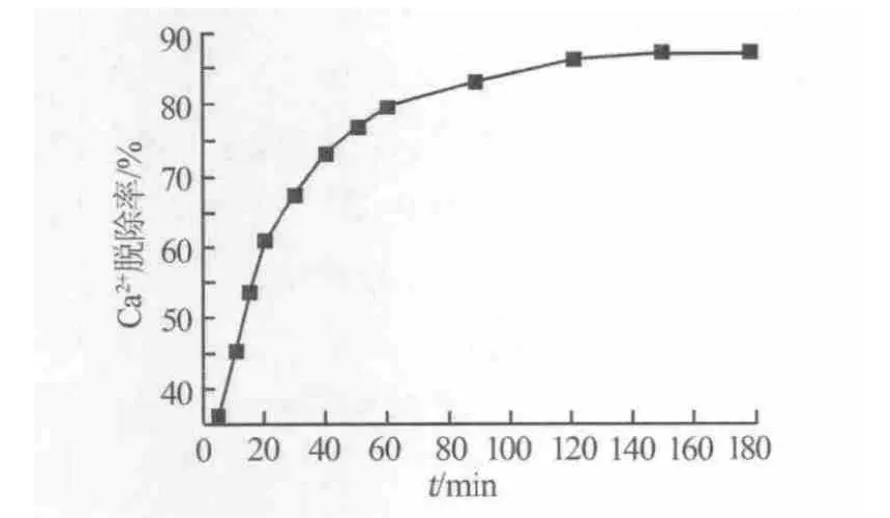
图2 反应时间对Ca2+脱除率的影响
2.3 反应温度对钙离子脱除率的影响
图3为反应温度对钙离子脱除率的影响。实验结果表明,反应温度对钙离子的脱除率有较大的影响。由图3可见,随着温度的升高,钙离子的脱除率先不断增加,然后有降低趋势。原因可能是,升高温度时,液体的黏滞力下降,离子的热运动速率加快,使得浓度梯度减小,液膜变薄,增加了离子进入树脂孔道进行交换的机会[7];而温度过高时,树脂的结构会遭到破坏,从而降低了树脂对钙离子的脱除率。当温度从 25℃升高至 65℃时,Ca2+的脱除率从87.03%增大至92.86%;从65℃升高至75℃时,Ca2+的脱除率变化较小;75℃以后再升高温度,Ca2+的脱除率反而降低。因此,实验选择反应温度为65℃。
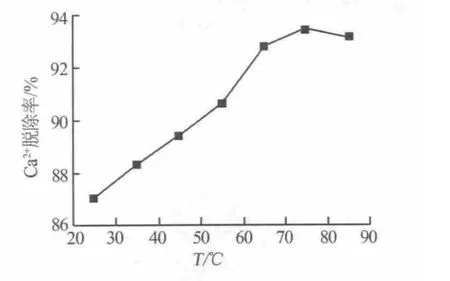
图3 温度对Ca2+脱除率的影响
2.4 LSC-500树脂对钙离子的静态全交换容量的测定结果
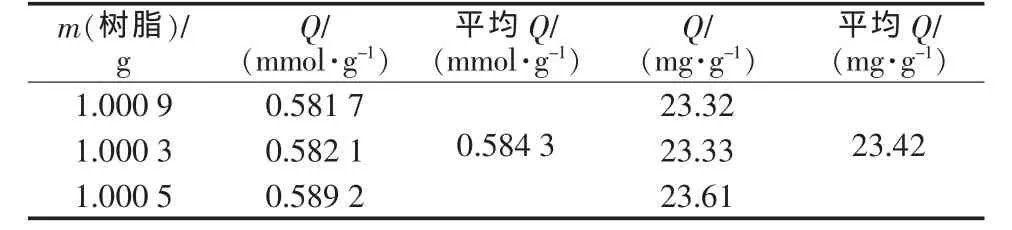
表1 LSC-500树脂对钙离子静态全交换容量
2.5 吸附动力学分析
2.5.1 动力学曲线
根据20、35、50℃条件下树脂对 Ca2+的吸附量随时间的变化数据,绘制吸附曲线(Qt-t)如图4所示。由图4可以看出,LSC-500树脂对钙离子的吸附量随着时间的延长而逐渐增大,当反应时间为150 min时,吸附反应基本达到平衡;当反应时间相同时,温度越高树脂对钙离子的吸附量越大,进一步说明高温有利于LSC-500树脂对钙离子的吸附。
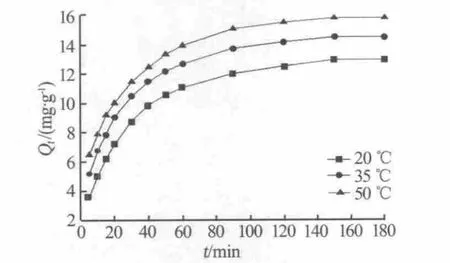
图4 不同温度下LSC-500树脂对Ca2+的吸附曲线
2.5.2 速率控制步骤
离子交换反应受到液膜扩散、颗粒扩散和化学反应3个步骤的速度的影响,通常情况下,离子交换过程中的化学反应速率比扩散速率要快[8-9],所以离子交换反应的速率一般是由液膜扩散或颗粒扩散来决定的,其中速度较慢的一个步骤就是整个离子交换反应的速控步骤。液膜扩散模型和颗粒扩散模型[10]的方程式表示如下:
液膜扩散方程:

颗粒扩散方程:

式中:F=Qt/Qe,为离子交换度;k1为液膜扩散的速率常数;k2为颗粒扩散的速率常数;t为反应时间,min。
分别用液膜扩散模型和颗粒扩散模型对LSC-500树脂吸附钙离子的吸附动力学数据进行拟合,拟合结果如图5和图6所示,拟合参数见表2。
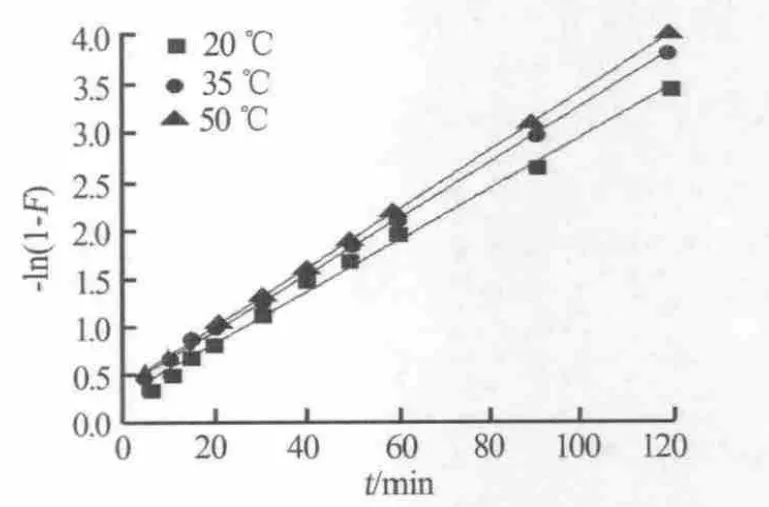
图5 液膜扩散拟合曲线
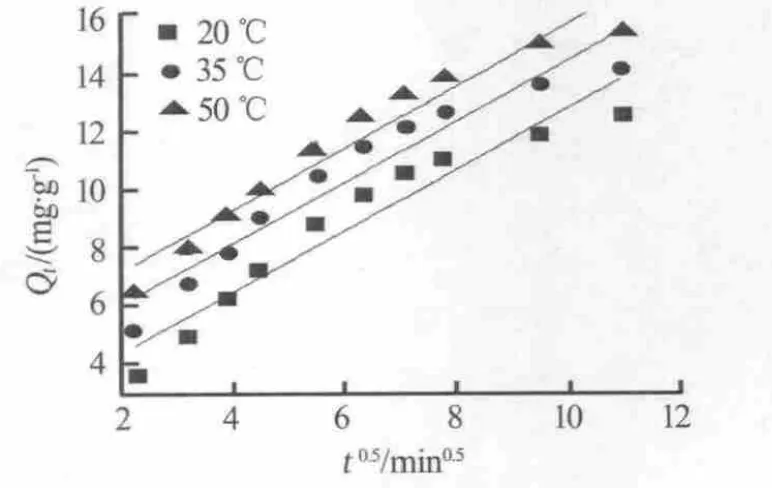
图6 颗粒扩散拟合曲线
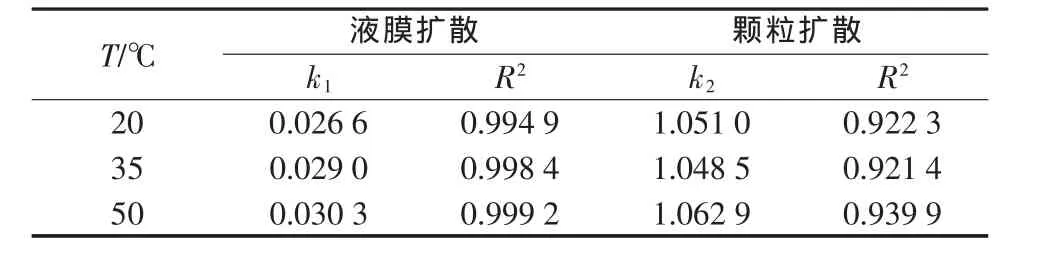
表2 LSC-500树脂吸附Ca2+液膜扩散与颗粒扩散参数
由表2可以看出,液膜扩散模型拟合曲线的相关性系数R2均大于0.99,说明液膜扩散拟合曲线存在良好的线性关系,而颗粒扩散模型拟合曲线的线性关系较差,这表明液膜扩散是LSC-500树脂吸附钙离子的主要速控步骤。
3 结论
1)实验比较了LSC-500、D152、D401、D418、001×7和001×14.5型6种树脂对富钾液中Ca2+的平衡吸附量,结果说明,LSC-500型树脂对Ca2+的平衡吸附量最大,所以实验选择LSC-500树脂进行研究。
2)随着反应时间的延长,Ca2+的脱除率先增大后趋于定值,反应时间为150 min时吸附达到平衡,为确保反应完全,实验中选择反应时间为180 min。
3)随着反应温度的升高,钙离子的脱除率先不断增加然后有降低趋势,考虑升高温度对Ca2+的脱除率的贡献大小,选择反应温度为65℃。
4)在25℃条件下,LSC-500树脂对钙离子的静态饱和吸附量为23.42 mg/g。
5)吸附动力学实验结果表明,LSC-500树脂吸附Ca2+的主要速控步骤是液膜扩散。
[1]袁俊生,韩慧茹.海水提钾技术研究进展[J].河北工业大学学报,2004,33(2):140-147.
[2]徐振洪.原油脱钙剂作用机理及其脱钙效果[J].石油炼制与化工,2004,35(10):29-33.
[3]谢英惠,刘佳.新型分子筛脱除钙离子的热力学研究[J].河北工业大学学报,2010,39(6):72-75.
[4]胡威,黄兴远,李小理.低浓度钴溶液除铁、钙、镁和P2O4深度除杂工艺研究[J].稀有金属与硬质合金,2011,39(3):10-12.
[5]萧小月,卜小东,桂治轮,等.功能无机材料在海水淡化技术中的应用与开发[J].功能材料,1996,27 (6):481-486.
[6]Dogˇan M,Abak H,Alkan M.Adsorption of methylene blue onto hazelnut shell:Kinetics,mechanism and activation parameters[J].J.Hazard.Mater.,2009,164(1):172-181.
[7]刘奔逸,王东田.沸石分子筛对水中钙离子的吸附研究[J].苏州科技学院学报:工程技术版,2010,23(3):19-22.
[8]Sarkar M,Acharya P K,Bhattacharya B.Modeling the adsorption kinetics of some priority organic pollutants in water from diffusion and activation energy parameters[J].J.Colloid Interface Sci.,2003,266 (1):28-32.
[9]Chang C Y,Tsai W T,Ing C H,et al.Adsorption of polyethylene glycol(PEG) from aqueous solution onto hydrophobic zeolite[J].J.Colloid Interface Sci.,2003,260(2):273-279.
[10]马红梅,朱志良,张荣华,等.弱碱性环氧阴离子交换树脂去除水中铜的动力学研究[J].离子交换与吸附,2006,22(6):519-526.
