表阿霉素免疫纳米微粒靶向抗肝癌作用的研究
2013-10-17黄国祥袁淑仪王金林龚时文
杨 峰 黄国祥 袁淑仪 庞 泓 王金林 龚时文
广东省东莞市人民医院,广东东莞 523126
目前原发性肝癌的治疗是以手术为主的综合治疗,但总的手术切除率仅有20%~30%,且术后2年复发率高达50%[1],因此化疗依然是肝癌治疗重要的辅助手段。为提高传统化疗药物的疗效并减少其毒副作用,靶向给药日益成为治疗肝癌的有效方法,而单克隆抗体和载药纳米微粒则是当前研究的热点[2-4]。笔者在前期研究中选择生物相容性好、可生物降解的天然高分子材料海藻酸钠和阳离子瓜尔胶,利用聚电解质复合法制成具有良好缓释性能的载表阿霉素纳米微粒(E-ADM-NPs)[5]。 本研究将进一步探讨EADM-NPs与抗VEGFR2单克隆抗体的交联,并观察交联物(E-ADM-Ab-NPs)对荷人肝癌裸鼠模型的抗肿瘤作用,以期用于原发性肝癌的靶向治疗。
1 材料与方法
1.1 试剂与动物
海藻酸钠(温州东升试剂厂);阳离子瓜尔胶(美国E-conomy公司);盐酸表阿霉素(法玛西亚有限公司);抗VEGFR2单克隆抗体(美国Biodesign公司);碳化二亚胺(EDC)(美国 Pierce 公司);人肝癌 Bel 7402 细胞株(由中科院上海细胞生物研究所提供);三级BALB/c裸鼠(由中山大学医学动物实验中心提供)。
1.2 E-ADM-Ab-NPs的制备及抗体活性的检测
依据文献方法[5],利用聚电解质复合法制备E-ADMNPs和未载药 NPs。 称取 10 mg E-ADM-NPs和 2 mg抗VEGFR2单抗溶于pH值7.4的磷酸盐缓冲液(PBS)中,缓慢加入5 mg EDC,4℃条件下搅拌2 h而后静置过夜。将所得溶液离心后用蒸馏水洗涤3遍,冷冻干燥即可制得EADM-Ab-NPs。 依法制备未载药 Ab-NPs,参考文献[6]利用酶联免疫测定法(ELISA) 对E-ADM-Ab-NPs和未载药Ab-NPs中抗VEGFR2单抗的活性进行检测。
1.3 荷人肝癌裸鼠模型的建立
取对数生长期的人肝癌Bel 7402细胞,用含15%小牛血清的PRMI 1640培养液按1×107/mL的浓度配成细胞悬液供皮下接种。取一定数量4~6周龄的三级BALB/c裸鼠,分别于右侧肩胛部皮下种植0.1 mL细胞悬液,饲养2周后选择生长良好、皮下肿瘤直径0.5~0.7 cm的裸鼠用于肿瘤治疗试验,饲养6周后选择生长良好、皮下肿瘤直径约1.0~1.2 cm的裸鼠用于药物的组织分布试验。
1.4 E-ADM-Ab-NPs在荷瘤裸鼠体内的分布
取体重为(20±2)g/只的荷人肝癌裸鼠12只(雌雄各半),随机分为 E-ADM-Ab-NPs组和 E-ADM-NPs组,两组按含E-ADM 5 mg/kg的剂量分别经尾静脉注射 EADM-Ab-NPs及 E-ADM-NPs。 每只裸鼠给药后 1 h经眼静脉窦取血1.0 mL作样品,然后断颈处死裸鼠,手术分别取出肿瘤、心脏、肝脏、肾脏等组织作样品。利用高效液相色谱法(HPLC)检测荷人肝癌裸鼠组织和血液中E-ADM的浓度。
1.5 E-ADM-Ab-NPs在荷瘤裸鼠体内的抑瘤试验
取体重为(18±2)g/只的荷人肝癌裸鼠48只(雌雄各半),随机分为 8组,每组 6只。A 组:E-ADM-Ab-NPs组;B 组:E-ADM-NPs组;C 组:Ab-NPs组;D 组:E-ADM 原药加抗VEGFR2单抗组;E组:E-ADM原药组;F组:抗VEGFR2单抗组;G组:未载药NPs组;H组:空白对照组。各组制剂分别溶于生理盐水中,按E-ADM每次10 mg/kg、抗VEGFR2单抗每次0.1 mg/kg的剂量经荷瘤裸鼠尾静脉注射,空白对照组注射生理盐水,每隔2天给药1次,共5次。于治疗第11天断颈处死裸鼠,取血清检测谷丙转氨酶、肌酐及白细胞计数。完整剥离瘤体测量长径及短径并称重,用体积=(长径×短径2)/2计算肿瘤体积,观察瘤体积抑制率及瘤重抑制率。瘤体积抑制率=[(对照组平均瘤体积-实验组平均瘤体积)/对照组平均瘤体积]×100%,瘤重抑制率=[(对照组平均瘤重-实验组平均瘤重)/对照组平均瘤重]×100%。
1.6 统计学方法
采用SPSS 11.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,采用单因素方差分析,采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 E-ADM-Ab-NPs的抗体活性
ELISA 法检测表明,E-ADM-Ab-NPs浓度稀释至 1∶1600时,其抗体仍表现出对靶抗原良好的免疫结合活性,其效价与游离抗VEGFR2单抗基本相当。
2.2 E-ADM-Ab-NPs在荷瘤裸鼠体内的分布
E-ADM-Ab-NPs组肿瘤组织中的 E-ADM 浓度为(31.85±4.78)mg/kg,其显著高于 E-ADM-NPs组(P < 0.05),而血液、心脏、肝脏、肾脏等组织中的E-ADM浓度分别为(5.21±0.49)mg/L、(4.40 ±0.33)mg/kg、(3.14 ±0.27)mg/kg、(2.38 ±0.39)mg/kg,均显著低于 E-ADM-NPs组(P < 0.05),见表1。
表1E-ADM-Ab-NPs组及E-ADM-NPs组在荷瘤裸鼠体内的分布(n=6,±s)
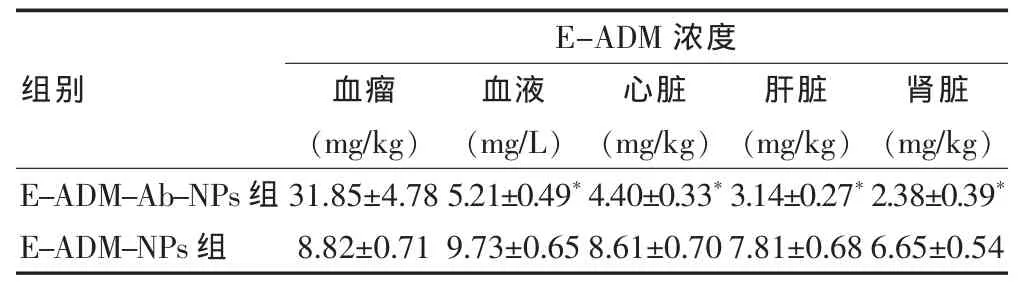
表1E-ADM-Ab-NPs组及E-ADM-NPs组在荷瘤裸鼠体内的分布(n=6,±s)
注:与 E-ADM-NPs组比较,*P < 0.05
组别E-ADM 浓度血瘤(mg/kg)血液(mg/L)心脏(mg/kg)肝脏(mg/kg)肾脏(mg/kg)E-ADM-Ab-NPs组E-ADM-NPs组31.85±4.78 8.82±0.71 5.21±0.49*9.73±0.65 4.40±0.33*8.61±0.70 3.14±0.27*7.81±0.68 2.38±0.39*6.65±0.54
2.3 E-ADM-Ab-NPs对荷瘤裸鼠的抗肿瘤作用
治疗11 d后与空白对照组相比,除未载药NPs组外其余各组的肿瘤体积和重量均明显下降,差异具有统计学意义(P < 0.05)。 E-ADM-Ab-NPs组的平均肿瘤体积及瘤体积抑制率为(79.17±18.63)mm3和60.69%,平均肿瘤重量及瘤重抑制率为(0.51±0.16)g和58.54%,显示其抗肿瘤作用强于其他组(P <0.05)。 见表2、3。
表2 各组第11天的肿瘤体积和瘤体积抑制率(n=6,±s)
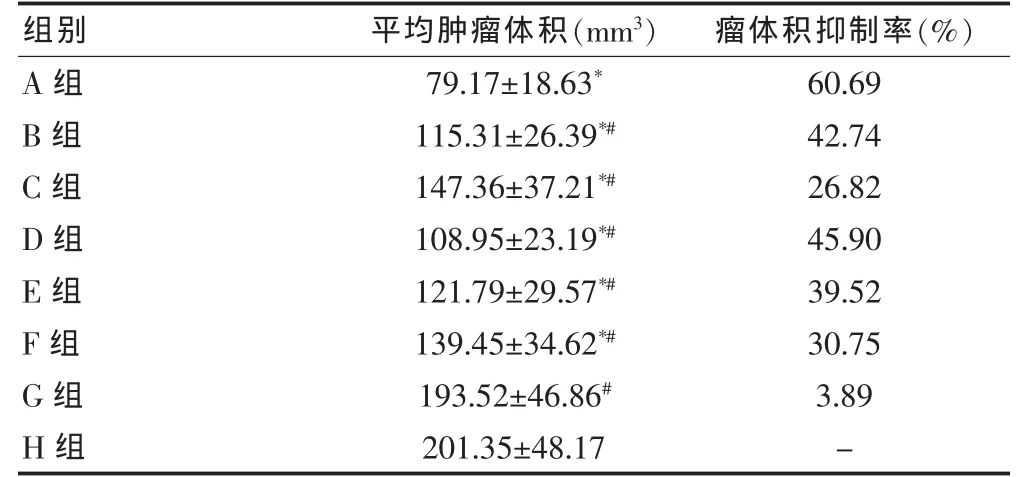
表2 各组第11天的肿瘤体积和瘤体积抑制率(n=6,±s)
注:与 H 组比较,*P < 0.05;与 A 组比较,#P < 0.05;“-”表示无数据
组别 平均肿瘤体积(mm3) 瘤体积抑制率(%)A组B组C组D组E组F组G组H组79.17±18.63*115.31±26.39*#147.36±37.21*#108.95±23.19*#121.79±29.57*#139.45±34.62*#193.52±46.86#201.35±48.17 60.69 42.74 26.82 45.90 39.52 30.75 3.89-
表3 各组第11天的肿瘤重量和瘤重抑制率(n=6,±s)
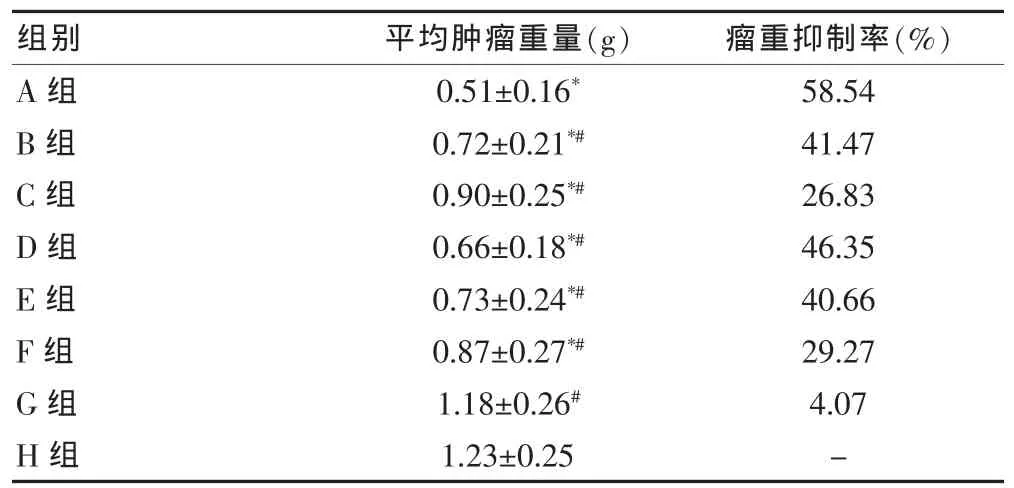
表3 各组第11天的肿瘤重量和瘤重抑制率(n=6,±s)
注:与 H 组比较,*P < 0.05;与 A 组比较,#P < 0.05;“-”表示无数据
G组H组1.18±0.26#1.23±0.25 4.07-
2.4 毒副作用统计结果
E-ADM-Ab-NPs组的血白细胞计数及血清谷丙转氨酶水平为(6.82±1.09)×109/L 和(40.26±15.27)U/L,与空白对照组相近,差异均无统计学意义(P>0.05)。E-ADM原药组及E-ADM原药加抗VEGFR2单抗组的血白细胞计数分别为(3.95±0.84)×109/L 和(4.08±0.91)×109/L,明显低于其他组,而血清谷丙转氨酶水平则分别为(72.46±17.02)U/L 和(68.51±15.94)U/L,显著高于其他组,差异均有统计学意义(P<0.05)。血肌酐水平在各组中的差异无统计学意义(P > 0.05)。 见表4。
表4 各组血白细胞计数、谷丙转氨酶及肌酐水平比较(n=6,±s)
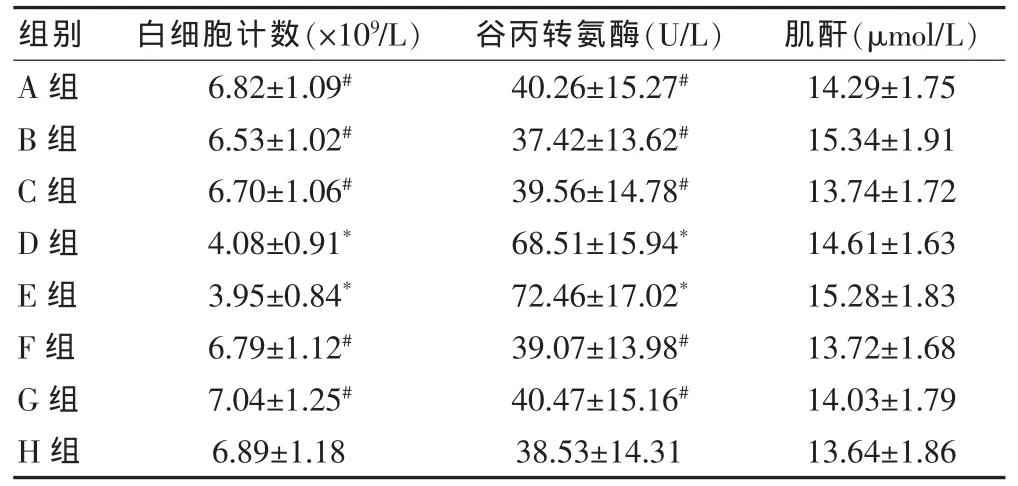
表4 各组血白细胞计数、谷丙转氨酶及肌酐水平比较(n=6,±s)
注:与H组比较,*P<0.05;与E组比较,#P<0.05
组别 白细胞计数(×109/L) 谷丙转氨酶(U/L) 肌酐(μmol/L)A组B组C组D组E组F组G组H组6.82±1.09#6.53±1.02#6.70±1.06#4.08±0.91*3.95±0.84*6.79±1.12#7.04±1.25#6.89±1.18 40.26±15.27#37.42±13.62#39.56±14.78#68.51±15.94*72.46±17.02*39.07±13.98#40.47±15.16#38.53±14.31 14.29±1.75 15.34±1.91 13.74±1.72 14.61±1.63 15.28±1.83 13.72±1.68 14.03±1.79 13.64±1.86
3 讨论
原发性肝癌化疗的总体疗效一直不甚理想,传统的全身静脉化疗对机体有较强的毒副作用,限制了化疗药物在肿瘤局部达到有效浓度,而局部化疗如肝动脉栓塞化疗(TACE)等往往需要创伤性操作才能实现。如何在提高肿瘤组织药物浓度的同时降低正常组织中的药物浓度,是目前肿瘤化疗研究的热点,因此载药纳米微粒靶向治疗具有广阔的前景。
本研究利用聚电解质复合法合成载E-ADM纳米微粒,其载体材料海藻酸钠的分子链上富含羧基和羟基,可通过化学交联与抗VEGFR2单克隆抗体相结合,ELISA法检测表明在E-ADM-Ab-NPs制备过程中抗体活性无明显丧失。VEGFR2主要分布于肿瘤血管内皮表面及原发性肿瘤细胞表面,而在正常组织及良性血管增生性组织中仅呈低水平表达,是介导血管内皮生长因子(VEGF)在肿瘤新生血管形成中发挥功能的主要受体[7-9]。原发性肝癌组织的VEGFR2阳性表达率达60%~70%[10],而抗VEGFR2单抗是针对VEGFR2的特异性抗体,能将化疗药物携带至肿瘤组织中发挥免疫靶向治疗作用[11-13]。荷人肝癌裸鼠模型体内的分布试验表明,E-ADM-Ab-NPs可选择性地集中于肿瘤组织,而在血液、心脏、肝脏、肾脏等正常组织中的分布较少。E-ADM-Ab-NPs具有的良好缓释性能可使肝癌组织较长时间处于有效的药物浓度中,同时抗VEGFR2单抗可竞争性抑制VEGF与VEGFR2结合,从而抑制肿瘤血管的生成[14-15]。荷人肝癌裸鼠模型的体内治疗发现,E-ADM-Ab-NPs组的瘤体积抑制率和瘤重抑制率明显高于E-ADM原药组,有助于临床上减少化疗药物的单次用量,并避免长时间持续静脉用药所带来的不便。包含E-ADM原药各组的荷瘤裸鼠血白细胞计数明显低于空白对照组,血清谷丙转氨酶水平明显高于空白对照组,而E-ADM-Ab-NPs组的血白细胞计数和血清谷丙转氨酶水平则与空白对照组相近,表明E-ADM-Ab-NPs可减少E-ADM原药的骨髓抑制和肝功能损害等毒副作用。
综上所述,本研究合成的E-ADM-Ab-NPs由于纳米微粒的缓释性能及抗VEGFR2单抗的导向作用,可明显提高其对荷人肝癌裸鼠模型的抗肿瘤效应,并降低E-ADM原药的全身毒副作用,是一种安全有效的新型肝癌靶向治疗制剂,具备良好的临床应用前景。
[1]撒忠秋,倪雷,秦建民.纳米粒在肝癌靶向治疗中的研究进展[J].肝胆外科杂志,2010,18(2):145-147.
[2]Wu J,Nantz MH,Zern MA.Targeting hepatocytes for drug and gene delivery:emerging novel approaches and applications[J].Front Biosci,2002,7:717-725.
[3]Soldano Ferrone.靶向攻击肿瘤的免疫疗法[J].微生物学免疫学进展,2012,40(1):1-4.
[4]孙丹丹,闫雪生,李百开.纳米粒与靶向制剂在抗肝癌药物中的应用[J].齐鲁药事,2011,30(6):355-357.
[5]杨峰,袁崇德,庞泓,等.聚电解质复合法载表阿霉素纳米微粒的制备及抗胰腺癌作用的研究[J].当代医学,2009,15(33):1-2.
[6]Ramirez J,Obispo TM,Duffort D,et al.Group 5 determination in Pooideae grass pollen extracts by monoclonal antibody-based ELISA[J].Correlation with biologic activity Allergy,1997,52(8):806-813.
[7]Kollermann J,Helpap B.Expression of vascular endothelial growth factor(VEGF) and VEGF receptor Flk-1 in benign,premalignant,and malignant prostate tissue[J].Am J Clin Pathol,2001,116(1):115-121.
[8]蔡应娱,李伟毅.血管内皮生长因子(VEGF)的生物活性及其在临床中的应用[J].细胞与分子免疫学杂志,2010,26(11):1164-1166.
[9]孙涛,陶晶,杨美荣,等.血管内皮生长因子在肝癌血管中的作用[J].医学综述,2012,18(10):1492-1494.
[10]杜滂,魏经国.VEGF及其受体的表达与肝癌的生物学特性关系[J].放射学实践,2002,17(6):542-545.
[11]Klement G,Baruchel S,Rak J,et al.Continuous low-dose therapy with vinblastine and VEGF receptor-2 antibody induces sustained tumor regression without overt toxicity[J].J Clin Invest,2000,105(8):15-24.
[12]戴丽娟,鄢成伟,李淑珍,等.抗VEGFR2/抗CD3双特异单链抗体的表达及初步活性检测[J].细胞与分子免疫学杂志,2011,27(8):883-886.
[13]李红,李岳,王兰,等.以血管内皮生长因子及其受体为药靶的抗肿瘤药物的研究进展[J].成都医学院学报,2011,6(3):271-275.
[14]Ran S,Huang X,Downes A,et al.Evaluation of novel antimouse VEGFR2 antibodies as potential antiangiogenic or vascular targeting agents for tumor therapy[J].Neoplasia,2003,5(4):297-307.
[15]邹文萍,唐国强,李光明.VEGF及其受体的生物学特性[J].四川生理科学杂志,2012,34(3):123-126.
