钙水平对马铃薯试管薯产量、质量和生理病害的影响
2013-10-16李朝周秦舒浩张俊莲白江平刘玉汇杨宏羽
杜 强, 李朝周, 秦舒浩, 张俊莲*, 白江平, 刘玉汇,王 丽, 余 斌, 杨宏羽, 王 蒂*
(1 甘肃省作物遗传改良与种质创新重点实验室,兰州 730070; 2 甘肃农业大学农学院,兰州 730070; 3 甘肃农业大学生命科学院,兰州 730070)
钙水平对马铃薯试管薯产量、质量和生理病害的影响
杜 强1,2, 李朝周1,3, 秦舒浩1,2, 张俊莲1,2*, 白江平1, 刘玉汇1,王 丽1,3, 余 斌1, 杨宏羽1,2, 王 蒂1,2*
(1 甘肃省作物遗传改良与种质创新重点实验室,兰州 730070; 2 甘肃农业大学农学院,兰州 730070; 3 甘肃农业大学生命科学院,兰州 730070)

试管马铃薯; 氯化钙浓度; 产量; 质量; 生理病害
Abstract: This study determined the microtuber yield, quality, calcium content and physiological disorder of potato in response to the various concentrations of CaCl2. Potato was cultivated in the liquid MS medium with various concentrations of CaCl2.The MS medium with zero calcium reduces the number of microtubers, tuber weight and the percent of large tubers. With the calcium-free medium, no microtubers larger than 100 mg are found, their tuber skin is yellowish brown plaques, and some tubers exhibits water-soaked decay with decay rate being 2.21%. The dry weight, starch, soluble sugar and protein contents in the microtubers cultured in the calcium-free medium are decreased by 36.8%, 41.39%, 10.7% and 39.43%, respectively, while the malonaldehyde content is increased. After being stored for six months under 4oC, the tuber skin shows the sign of dehydration, with physiological disorder averaging 53.77%. When stored at room temperature for three weeks, the germination rate is only 25.53% with a slow growth. With the addition of calcium to the MS medium, the number of microtubers per stem and tuber weight are increased with the increase of calcium concentrations and then decreased at higher concentrations. The percent of large tubers and the tuber skin glossiness are increased with the increase of calcium concentrations. Compared to the microtubers grown in the standard MS medium, the dry matter of microtubers in the higher calcium medium is increased by 4.43%-8.62%, the starch content is increased by 6.79%-16.49%, the soluble sugar content is increased by 2.7%-47.9%, and protein concentration is increased by 4.63%-8.29%. Average tuber calcium content is increased significantly, reaching the range from 177μg/g to 267 μg/g, and the tuber skin does not show the sign of decay. After being stored for six months under 4℃, the tuber skin is normal, and the physiological disorder rate is reduced to 1%-8.9% with the increase of calcium concentration, and the coefficient of determination is 0.3812. Calcium concentrations do not affect the germination ability and bud growth. We conclude that the addition of9 mmol/L of CaCl2in the MS medium is the best practice for the potato cultivar ‘Xindaping’ to improve its yield and quality.
Keywords: potato microtubers; CaCl2concentration; yield; quality; physiological disorder
钙是植物必需的营养元素,对稳定细胞膜和细胞壁结构起重要作用,并在植物生长发育和应对环境胁迫中处于中心调控地位[1]。植物体内缺钙会使其顶芽和根系顶端不发育,幼叶失绿、 变形、 出现弯钩状,严重时生长点坏死呈果胶状,并出现多种生理病害,如马铃薯块茎褐心病、 内部褐斑病和空心病;苹果苦痘病、 痘斑病和水心病;梨黑斑病和黑心病等,严重影响产品外观、 内在品质和耐贮性[2-4]。但细胞质中浓度过高的游离钙,又可与磷酸盐形成沉淀,干扰与磷代谢有关的生理过程, 妨碍正常信号转导,对植物的生长发育也十分不利[5]。
马铃薯(SolanumtuberosumL.)是西部地区主栽的重要粮、 菜、 经兼用型作物,本研究所用品种“新大坪”是甘肃旱作区主栽品种,年种植面积已近4万公顷。研究发现,钙的匮缺严重影响马铃薯块茎质量,表现为块茎小,有畸形成串小块茎, 块茎表面及内部维管束细胞常坏死,出现薯内褐斑病、 表皮粗糙等多种生理性病害[2, 6-7]。而增施钙则可显著提高马铃薯单株产量和商品率,改善贮藏期间品质[8-9]。试管薯与微型薯一样,既是脱毒种薯生产体系的重要组成部分,也是研究马铃薯块茎发育生物学和转基因育种的适宜材料。试管薯是在组培条件下,通过控制培养液成分和培养条件,诱导马铃薯离体植株腋芽顶端膨大而形成的薯块,目前鲜见钙对马铃薯试管薯形成、 品质、 薯内钙离子含量及生理病害影响的报道。本研究通过在MS[10]培养液中添加不同浓度氯化钙,探讨马铃薯“新大坪”品种试管薯形成对钙营养的响应,分析钙水平对试管薯质量、 薯内钙离子含量和生理病害的影响,为该品种高品质试管薯的获得提供理论依据。
1 材料和方法
1.1 试验材料及繁殖
试验于2011年9月至2012年6月进行。材料为“新大坪”脱毒试管苗,由甘肃省作物遗传改良与种质创新重点实验室提供。每20 d将带芽茎段在MS培养基上继代繁殖一次,培养温度23±2℃,光强4000 lx、 光照时间16 h/d。
1.2 试验方法
1.2.1 试验处理 以不含氯化钙的MS培养液为基本培养液(含3%蔗糖,pH 5.8),设置6个钙浓度水平,即0、 3、 6、 9、 12、 15 mmol/L CaCl2,代号依次为C0、 C3、 C6、 C9、 C12、 C15,其中3 mmol/L为MS培养液中CaCl2正常用量。将具一个叶片的单芽茎段分别接入上述6种培养液中(以滤纸桥为支持物),每瓶接5段,每个处理20瓶(150 mL玻璃三角瓶),共100段,重复10次。其中3次用于产量和品质分析,7次用于薯内钙含量及生理病害分析。
1.2.3 生理指标的测定 试管薯收获后,测定其可溶性糖含量(蒽酮比色法)、 蛋白质含量(考马斯亮蓝法)、 丙二醛含量(巴比妥酸法)[11]、 淀粉含量(酸解法)[12]、 薯内钙含量(原子吸收分光光度法)[13]。
1.2.4 生理病害统计 试管薯收获后对各处理的外观生理病害,如水浸状腐烂和表皮粗糙统计。然后部分薯块4℃条件下贮藏6个月后,统计腐烂、 内部褐斑和空心等情况,获生理病害率。
生理病害率(%)=生理病害薯个数/薯总数×100%
室温下再放置3周,统计发芽率,并观察芽的生长。
发芽率(%)=发芽薯个数/总薯数×100%
1.2.5 数据处理 所获数据用EXCEL和SPSS 21分析软件进行分析,用Duncan新复极差法进行处理间差异的多重比较。
2 结果与分析
2.1氯化钙浓度对马铃薯试管薯结薯数量和质量的影响
MS培养液中CaCl2浓度对“新大坪”试管薯的结薯情况有极显著影响(表1)。在C0处理下,每瓶结薯数量、 薯重及大薯率均大幅度下降,分别只有
正常MS供钙水平(C3处理)每瓶结薯数和薯重的19.2%和4.3%,没有>100 mg的试管薯。此条件下试管薯表面出现明显的黄褐色粗糙斑块,个别薯块还现水浸状腐烂,腐烂率2.21%。4℃下贮藏6个月,薯块腐烂率达19.15%;室温下放置3周,仅25.53%薯块发芽(表2),且芽的生长缓慢。

2.2氯化钙浓度对马铃薯试管薯干物质和淀粉含量的影响
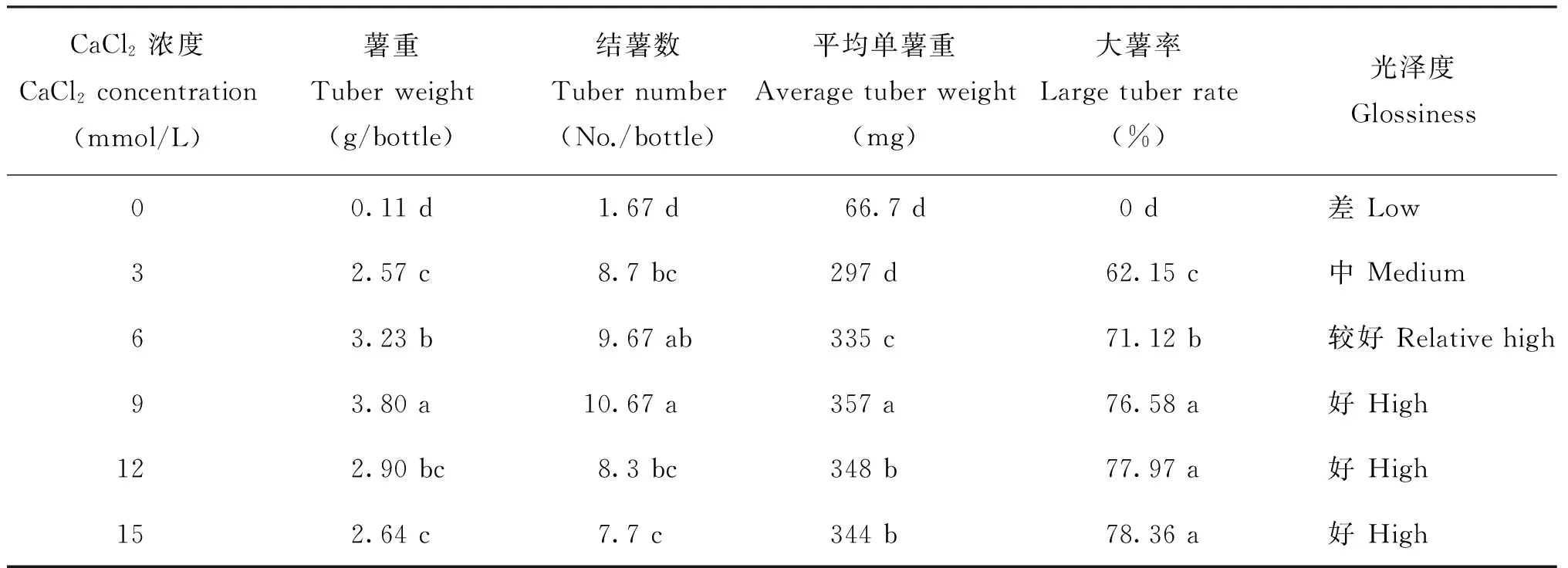
表1 氯化钙浓度对马铃薯试管薯结薯数量和质量的影响
注(Note): 同列数据后不同字母表示不同处理间差异达到5%显著水平 Values followed by different letters in the same column are significantly different among the treatments at the 5% level.
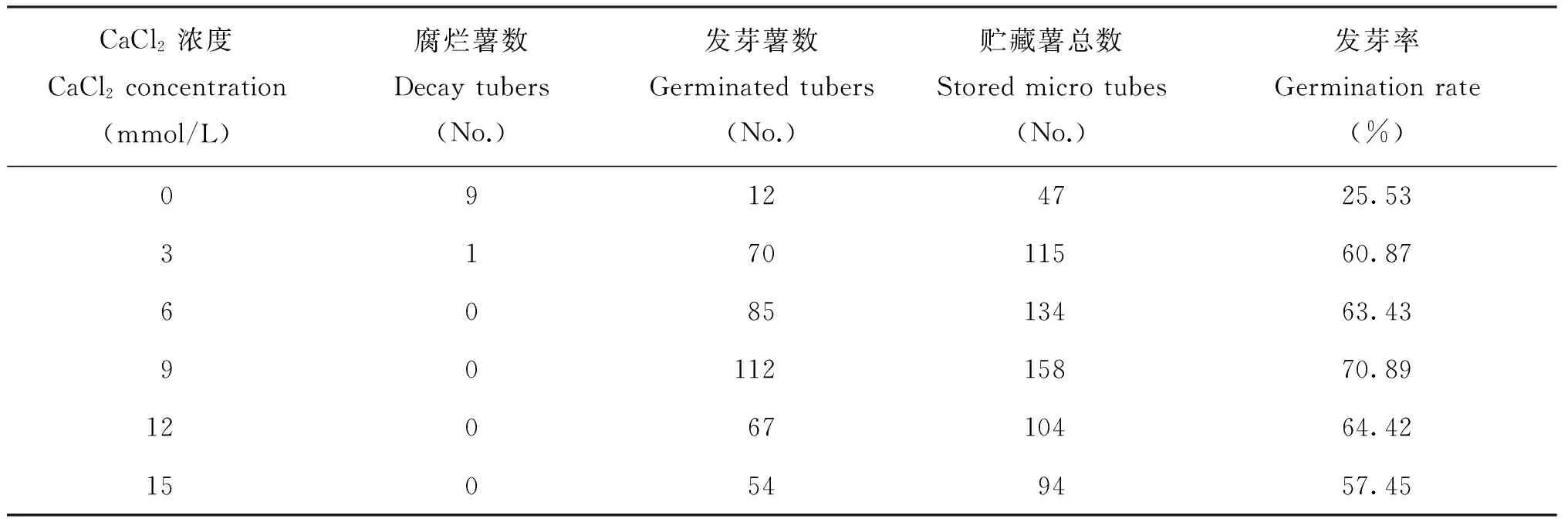
表2 氯化钙浓度对马铃薯试管薯4℃下贮藏6个月后发芽率的影响

图1 氯化钙浓度对马铃薯干物质和淀粉含量的影响Fig.1 Effects of CaCl2 concentrations on the dry matter and the starch content of the potato microtubers[注(Note): 图柱上不同字母表示不同处理间差异达到5%显著水平Different letters above the bars mean significant differences among the treatments at the 5% level.]
2.3氯化钙浓度对马铃薯试管薯可溶性糖含量的影响

图2 氯化钙浓度对马铃薯试管薯可溶性糖含量的影响Fig.2 Effects of CaCl2 concentrations on the soluble sugar content of the potato micotubers[注(Note): 图柱上不同字母表示不同处理间差异达到5%显著水平Different letters above the bars mean significant differences among the treatments at the 5% level.]
MS培养液中无钙(C0处理)时,薯块中可溶性糖含量最低(0.62%),较C3处理显著降低了10.7%(图2),此条件下的淀粉含量为5.92%,淀粉和可溶性糖比值为9.55 ∶1,即无钙处理(C0)下的试管薯淀粉与可溶性糖的比值处于较低水平。

2.4氯化钙浓度对马铃薯试管薯蛋白质含量的影响


图3 氯化钙浓度对马铃薯试管薯蛋白质含量的影响Fig.3 Effects of CaCl2 concentrations on the protein content of the potato microtubers[注(Note): 图柱上不同字母表示不同处理间差异达到5%显著水平 Different letters above the bars mean significant differences among the treatments at the 5% level.]
2.5氯化钙浓度对马铃薯试管薯钙含量及生理病害的影响


图4 氯化钙浓度对马铃薯试管薯钙含量的影响Fig.4 Effects of CaCl2 concentration on the calcium content of the potato microtubers[注(Note): 图柱上不同字母表示不同处理间差异达到5%显著水平 Different letters above the bars mean significant differences among the treatments at the 5% level.]
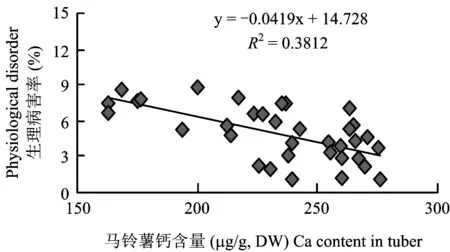
图5 马铃薯试管薯钙含量与生理病害率的相关性分析Fig.5 Correlation between the calcium content and the physiological disorder of the potato microtubers

2.6氯化钙浓度对马铃薯试管薯丙二醛(MDA)含量的影响
当MS培养液中无添加钙时,试管薯丙二醛含量大幅上升,高达15.33 nmol/g,此时试管薯出现水浸状腐烂。表明钙的缺乏破坏了细胞膜结构,膜脂过氧化现象严重,影响到细胞的完整性,导致试管薯出现水浸状腐烂。当培养液中添加CaCl2后,丙二醛含量大幅下降,且随钙浓度的升高呈先下降后上升的趋势,C9处理值最低,为2.18 nmol/g(图6)。
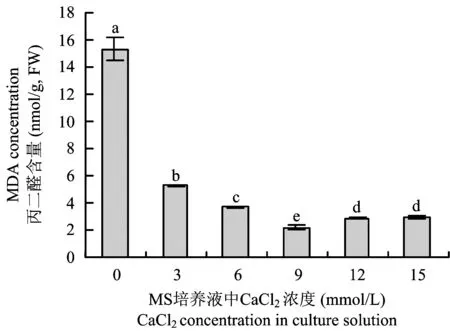
图6 氯化钙浓度对马铃薯试管薯丙二醛含量的影响Fig.6 Effect of CaCl2 concentrations on the MDA content of the potato microtubers[注(Note): 图柱上不同字母表示不同处理间差异达到5%显著水平 Different letters above the bars mean significant differences among the treatments at the 5% level.]
3 讨论



植物组织离体培养所用的各类培养基(液)中,MS培养基(液)因其硝酸盐、 钾离子和铵离子含量丰富,微量元素和有机成分全面而被广泛使用,也是马铃薯试管苗繁殖常用培养基(液)。研究者对该培养基(液)中的多种成分进行了改变,涉及有机成分缺失[25]、 某种微量元素缺失或降低[26]、 大量元素降低或添加[27-28]等,均发现不同品种所需MS培养基(液)配方存在差异。Arvin等研究了不同浓度(3、 10、 15、 20、 25 mmol/L)CaCl2对“Bintie”和“Russet Burbank”品种试管薯结薯特性的影响,发现MS培养液中添加10 mmol/L钙,试管薯的结薯数量、薯鲜重、薯内磷、 钾、 钙含量等多项指标表现最优,且两个品种对钙水平的响应存在差异,并认为MS培养液中3 mmol/L的钙浓度不是试管薯生长的最优浓度[29]。本研究也支持这一结论,即发现“新大坪”品种试管薯的结薯数、 薯重以及薯内干物质、 淀粉、 可溶性糖和蛋白质含量的变化均随钙浓度的增加呈先上升后下降的趋势,MS培养液中添加9 mmol/L CaCl2,试管薯的数量和薯内钙含量最高、 质量最优。
4 结论
MS培养液中不添加钙时,马铃薯试管薯的结薯数量、 薯重和质量均较正常供钙水平(3 mmol/L)大幅下降,无大于100 mg的试管薯,并伴有生理病害(薯皮现黄褐色粗糙斑块及薯块水浸状腐烂)发生。4℃下贮藏6个月,薯皮失水皱缩严重,病害加重,发芽率低且芽生长缓慢;MS培养液中添加不同浓度氯化钙后,试管薯的结薯数、 薯重及质量均随钙浓度的增加呈先增加后降低的变化趋势,薯内钙含量大幅度上升,薯皮光滑无水浸状腐烂。4℃下贮藏6个月,薯皮正常,生理病害率随薯内钙含量升高呈下降趋势,且试管薯芽的萌发和生长正常。确定MS培养液中添加9 mmol/L CaCl2是“新大坪”品种试管薯数量和质量的最优处理。
[1] Hepler P K. Calcium, a central regulator of plant growth and development[J]. Plant Cell, 2005, 17: 2142-2155.
[2] 曹恭, 梁鸣早. 钙-平衡栽培体系中植物必需的中量元素[J]. 土壤肥料, 2003, (2): 48-49. Cao G,Liang M Z. Calcium-the essential secondary nutrients in the balance cultivation system[J]. Soils Fert., 2003, (2): 48-49.
[3] White P J, Broadley M R. Calcium in plants[J]. Ann. Bot., 2003, 92: 487-511.
[4] 周卫, 林葆.植物钙素营养机理研究进展[J]. 土壤学进展, 1995, 23(2): 12-17. Zhou W, Lin B. Progresses on the plant calcium nutrient mechanism[J]. Prog. Soil Sci., 1995, 23(2): 12-17.
[5] 周卫, 汪洪.植物钙吸收、 转运及代谢的生理和分子机制[J]. 植物学通报, 2007, 24(6): 762-778. Zou W, Wang H. The physiological and molecular mechanisms of calcium uptake, transport, and metabolism in plants[J]. Chin. Bull. Bot., 2007, 24(6): 762-778.
[6] Ginzberg I,Minz D,Faingold Ietal. Calcium mitigated potato skin physiological disorder[J]. Am. J. Pot. Res.,2012,89: 351-362.
[7] Ozgen S, Karlsson B H, Palta J P. Response of potato(cv Russet Burbank)to supplemental calcium applications under field conditions: Tuber calcium, yield, and incidence of internal brown spot[J].Am. J. Pot. Res., 2006, 83: 195-204.
[8] 辛建华, 李天来, 陈红波. 外源钙处理对马铃薯块茎重量和数量的影响[J]. 西北农业学报, 2008, 17(5): 248-251. Xin J H, Li T L, Chen H B. Effect of calcium treatment on weight and number of potato tuber[J], Acta Agric. Bor.-Occid. Sin., 2008, 17(5): 248-251.
[9] 刘喜平, 陈彦云, 任晓月, 等. 外源钙对马铃薯块茎贮藏期间几种酶活性及蛋白质含量的影响[J]. 江苏农业科学, 2012, 40(2): 62-64. Liu X P, Chen Y Y, Ren X Yetal. Effect of exogenous calcium on several enzymatic activity and protein content in duration storage of potato tubers[J]. Jiangsu Agric. Sci., 2012, 40(2): 62-64.
[10] 王蒂. 细胞工程(第二版)[M]. 北京: 中国农业出版社,2011. 52-59. Wang D. Cell engineering(2nd Ed.)[M]. Beijing: China Agriculture Press. 2011. 52-59.
[11] 王学奎.植物生理生化实验原理和技术(第二版)[M].北京: 高等教育出版社,2006. 190-203. Wang X K. Principles and techniques of plant physiological biochemical experiment(2nd Ed.)[M]. Beijing: Higher Education Press. 2006. 190-203.
[12] 曹建康,姜微波. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007. 76-81. Cao J K, Jiang W B. Experiment guidance of postharvest physilogy and biochemistry of fruits and vegetables[M]. Beijing: China Light Industry Press, 2007. 76-81.
[13] 鲍士旦.土壤农化分析(第三版)[M]. 北京: 中国农业出版社,1999. 274-275. Bao S D. Soil and agricultural chemistry analysis(3rd Ed. )[M]. Beijing: China Agriculture Press, 1999. 274-275.
[14] 门福义,刘梦云.马铃薯栽培生理[M]. 北京: 中国农业出版社,1995. 86 Men F Y, Liu M Y. Culture physiology of potato[M]. Beijing: China Agriculture Press, 1995. 86.
[15] 安磊. 马铃薯优质新品种—新大坪[J]. 中国马铃薯,2006,20(4): 256. An L. New high quality potato variety-Xindaping[J]. Chin. Pot. J., 2006, 20(4): 256.
[16] 马琛, 乙引, 张习敏, 高巍. 钙离子在植物生理调节中的作用[J]. 贵州农业科学, 2010, 38(2): 36-41. Ma C, Yi Y, Zhang X M, Gao W. Effect of the regulation of plant physiology on calcium ion[J]. Guizhou Agric. Sci., 2010, 38(2): 36-41
[17] Ozgen S, Palta J P. Supplemental calcium application influences potato tuber number and size[J]. Hortscience, 2004, 40(1): 102-105.
[18] Balamani V, Veluyhambi K, Poovaiah B W. Effect of calcium on tuberization in potato[J]. Plant Physiol., 1986, 80: 856-858.
[19] 刘喜平, 陈彦云, 任晓月, 等. 不同生态条件下不同品种马铃薯还原糖、 蛋白质、 干物质含量研究[J]. 河南农业科学, 2011, 40(11): 100-103. Liu X P, Chen Y Y, Ren X Yetal. Research of the content of reducing sugar, protein and dry matter of four potato varieties under different ecological environment[J]. J. Henan Agric. Sci., 2011, 40(11): 100-103.
[20] 宋志荣.不同氮钾比例对马铃薯产量和品质的影响[J].中国马铃薯, 2009, 23(3): 155-157. Song Z R. Effects of the ratio of N to K fertilizer on patato yield and quality[J]. Chin. Pot. J., 2009, 23(3): 155-157.
[21] 王利勇, 汪强, 谭金芳, 等. 滴灌施肥与叶面喷施相结合供肥方式对马铃薯产量和品质的影响[J]. 江西农业学报, 2012, 24(5): 121-123. Wang L Y, Wang Q, Tang J Fetal. Influences of dripping fertilizer combined with spraying foliar manure on yield and quality of potato[J]. Acta Agric. Jiangxi, 2012, 24(5): 121-123.
[22] 任丽花, 翁伯琦, 方金梅. 施钙增强作物抗旱力的研究进展[J]. 亚热带农业研究, 2005, 1(3): 19-25. Ren L H, Wen B Q, Fang J M. Progress about the relationship between calcium fertilizers and drought-resistance of plants[J]. Subtrop. Agric. Res., 2005, 1(3): 19-25.
[23] 王海波, 黄雪梅, 张昭其. 植物逆境胁迫中活性氧和钙信号的关系[J]. 北方园艺, 2010, (22): 189-194. Wang H B , Huang X M, Zhang Z Q. Relationship between reactive oxygen species and calcium signaling in plant stress[J]. Northern Hortic., 2010, (22): 189-194.
[24] 梁国庆, 孙静文, 周卫, 王秀斌. 钙对苹果果实超氧化物歧化酶、 过氧化氢酶活性及其基因表达的影响[J]. 植物营养与肥料学报, 2011, 17(2): 438-444. Liang G Q, Sun J W, Zhou W, Wang X B. Effects of calcium on activities and gene expressions of superoxide dismutase and catalase in apple(MaluspumilaMill.) fruits[J]. Plant Nutr. Fert. Sci., 2011, 17(2): 438-444.
[25] 董淑英, 李梅, 孙静, 等. 马铃薯试管苗低成本快繁方式研究[J]. 中国马铃薯, 2002, 16(1): 7-10. Dong S Y, Li M, Sun Jetal.The study on reducing the micro-propagation cost of plantlets[J]. Chin. Pot. J., 2012, 16(1): 7-10.
[26] 陈永波, 赵清华, 袁明山, 等.微量元素缺乏与过量对脱毒马铃薯苗生长的影响[J]. 中国马铃薯, 2005, 19(1): 10-12. Chen Y B, Zhao Q H, Yuan M Setal.Effect of deficiency or excessiveness of microelements on growth of virus-free potato plants[J]. Chin. Pot. J., 2005, 19(1): 10-12.
[27] 赵映琴, 刘玉汇, 王丽, 等.低磷胁迫下马铃薯试管苗生长及生理指标变化的研究[J].干旱地区农业研究, 2009, 27(5): 183-187. Zhao Y Q, Liu Y H, Wang Letal.Plantlets in vitro under low phosphorus stress[J].Agric. Res. Arid Areas, 2009, 27(5): 183-187.
[28] 郎贤波, 廉美兰, 朴炫春, 朴美英.无机盐浓度对马铃薯脱毒苗微繁的影响[J].延边大学农学学报, 2007, 29(1): 1-4. Lang X B, Lian M L, Piao X C, Piao M Y.Effects of inorganic salt on the micropropagation of virus-free potato plantlet[J]. J. Agric. Sci. Yanbian Univ., 2007, 29(1): 1-4.
[29] Arvin M J, Habib A, Donnelly D J. Effects of calcium concentrations in medium on microtuberization of potato(SolanumtuberosumL.)[J].Iran. J. Biotechnol., 2005, 3(3): 152-156.
EffectsofCaCl2concentrationsontheyield,qualityandphysiologicaldisorderofpotatomicrotubers
DU Qiang1, 2, LI Chao-zhou1, 3, QIN Shu-hao1, 2, ZHANG Jun-lian1, 2*, BAI Jiang-ping1, LIU Yu-hui1, WANG Li1, 3, YU Bin1, YANG Hong-yu1, 2, WANG Di1, 2*
(1GansuKeyLaboratoryofCropGenetic&GermplasmEnhancement,GansuAgriculturalUniversity,Lanzhou730070,China; 2CollegeofAgronomy,GansuAgriculturalUniversity,Lanzhou730070,China; 3CollegeofLifeSciencesandTechnology,GansuAgriculturalUniversity,Lanzhou730070,China)
2013-01-19接收日期2013-05-23
国家科技支撑计划(2012BAD06B03);农业部马铃薯产业技术体系(CARS-10-P18);甘肃省高等学校基本科研业务费专项基金(GSKYYWF-1);甘肃省科技重大专项(1102NKDA025)资助。
杜强(1984—),男,河北省邯郸市人,硕士研究生,主要从事马铃薯高产优质栽培生理研究。E-mail: duqiang_ff@163.com * 通信作者 E-mail: zhangjunlian77@163.com; wangd@gsau.edu.cn
S143.91
A
1008-505X(2013)06-1502-08
