氢自养高氯酸盐还原菌培养驯化的研究*
2013-10-16高孟春李亚惠赵从从
高孟春,李亚惠,张 优,张 健,任 云,赵从从
(中国海洋大学1.海洋环境与生态教育部重点实验室;2.环境科学与工程学院,山东 青岛266100)
高氯酸盐是1种具有高度扩散性的持久性有毒污染物,被广泛地应用在军工生产、烟火工业、皮革加工等领域。一旦高氯酸盐排入水体后,由于其具有化学性质稳定和水溶性高的特点,在自然水系中流动性很强,能持续迁移造成大范围的地表水和地下水污染[1-2]。人体摄入高氯酸盐后,它能干扰甲状腺素的合成和分泌,影响人体正常的新陈代谢[3-4]。高氯酸盐去除技术主要有离子交换法、膜分离法和生物还原法。离子交换法[5]和膜过滤法[6-7]能有效地去除水中高氯酸盐,但存在高浓度高氯酸盐的再生液或浓缩液需后续处理的问题。生物还原法是指在缺氧条件下通过高氯酸盐还原菌将高氯酸盐还原为无毒的,是一种经济、有效和安全的高氯酸盐去除技术。根据电子供体和碳源的不同,高氯酸盐还原菌可分为异养微生物和自养微生物。异养高氯酸盐还原菌以有机物作为碳源和电子供体,而自养高氯酸盐还原菌以无机碳作为碳源,用S0、Fe0、H2和S2O2-3等作为电子供体。与异养高氯酸盐还原菌相比,自养高氯酸盐还原菌具有污泥产量低、不需添加有机碳源的特点,出水中有机物及微生物产物含量较低。以H2作为电子供体还原高氯酸盐的研究结果表明[12-13],氢自养还原高氯酸盐具有较好的处理效果。其中,氢自养高氯酸盐还原菌是完成微生物还原高氯酸盐的关键。但是,目前开展氢自养高氯酸盐还原菌培养驯化的研究相对较少。本文分别以厌氧污泥作为接种污泥和氢气作为电子供体,系统地研究了氢自养高氯酸盐还原菌的培养驯化过程,研究成果可为氢自养还原高氯酸盐反应器提供高效的氢自养高氯酸盐还原菌。
1 材料和方法
1.1 试验材料
接种污泥取自青岛市李村河污水处理厂的厌氧消化污泥。培养基由基础培养基、微量元素和磷酸盐缓冲液组成。基础培养基和微量元素组分分别见表1和2。磷酸盐缓冲液(20mmol/L,K2HPO3∶KH2PO3=1∶1)确保体系中pH值稳定。
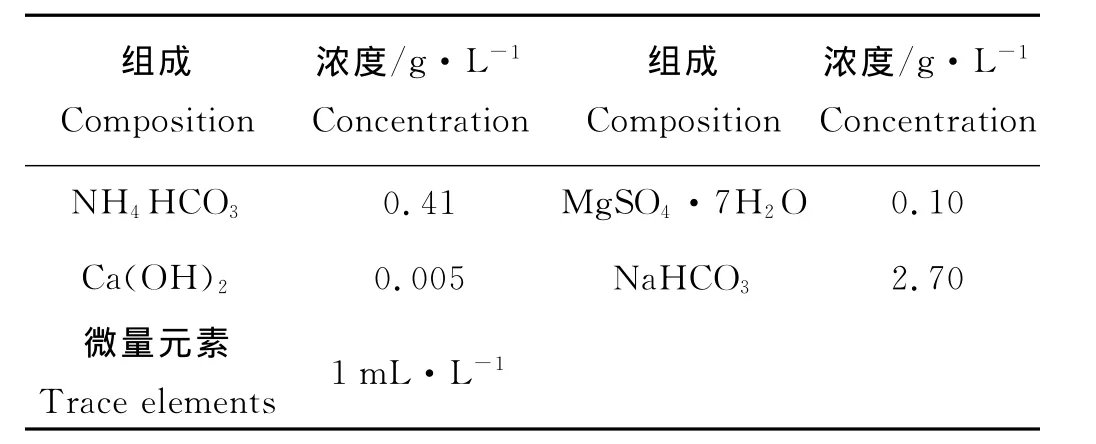
表1 基础培养基组成Table 1 Composition of basic medium
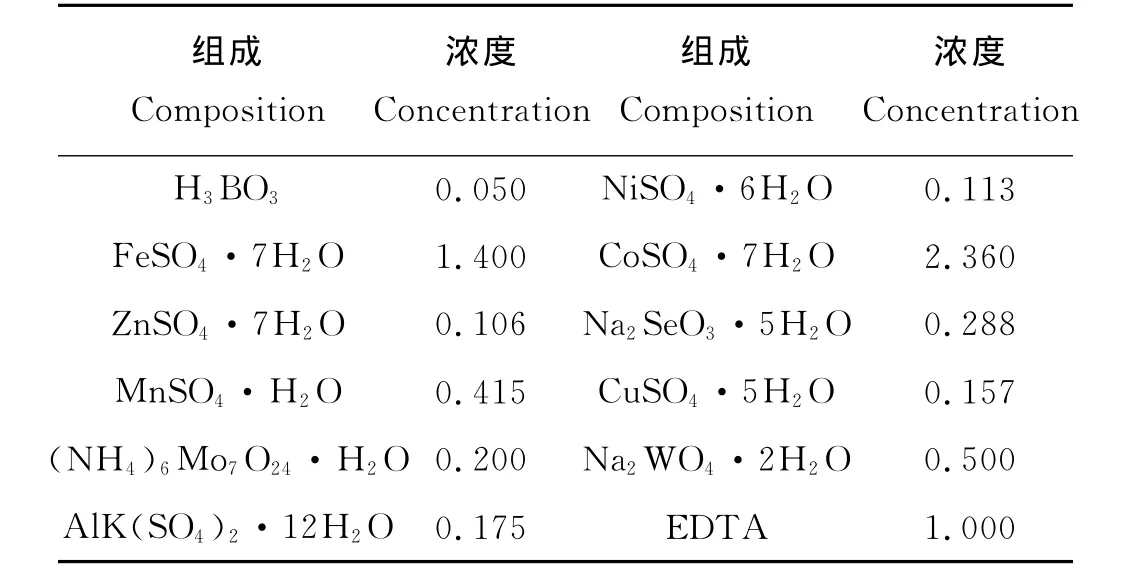
表2 微量元素组成Table 2 Composition of trace elements /g·L-1
1.2 分析方法
2 培养驯化过程
本研究采用周期运行培养方式,同时进行3个平行试验。将从污水处理厂取回的厌氧污泥静置5h后弃去上清液,厌氧污泥的 MLSS为17.06g/L,取50mL注入500mL的厌氧瓶中,加入经N2/CO2混合气(N2∶CO2=4∶1,V∶V)脱氧的250mL营养盐溶液。厌氧瓶中最初的浓度约为300mg/L,调节pH约为7.2,通入N2/CO2混合气体3min,排除其上部空间的氧气后,立即用丁基橡胶塞封住瓶口,再用铝封进一步密封。用注射器抽空反应器内液面上部的N2/CO2混合气体,将氢气发生器产生的H2(100mL/min)通过不锈钢针向反应器内注入直至饱和(约3min),保证厌氧瓶的上部空间充有一定量的氢气。将封装好的厌氧瓶固定于25℃恒温摇床中培养,振荡频率为120r·min-1。培养驯化过程中定期取样分析厌氧瓶中、、Cl-、pH、污泥浓度及微生物群落结构变化。当培养驯化周期稳定在一定值时,氢自养高氯酸盐还原菌培养驯化过程结束。
3 结果与讨论
3.1 培养驯化过程中浓度的变化
培养驯化过程中,厌氧瓶中高氯酸盐的起始控制浓度约为300mg/L,在厌氧条件下氢自养高氯酸盐还原菌以H2作为电子供体将高氯酸盐先还原为次氯酸盐和亚氯酸盐,最终还原为无毒的Cl-和O2,不同的培养驯化周期的浓度变化如图1所示。
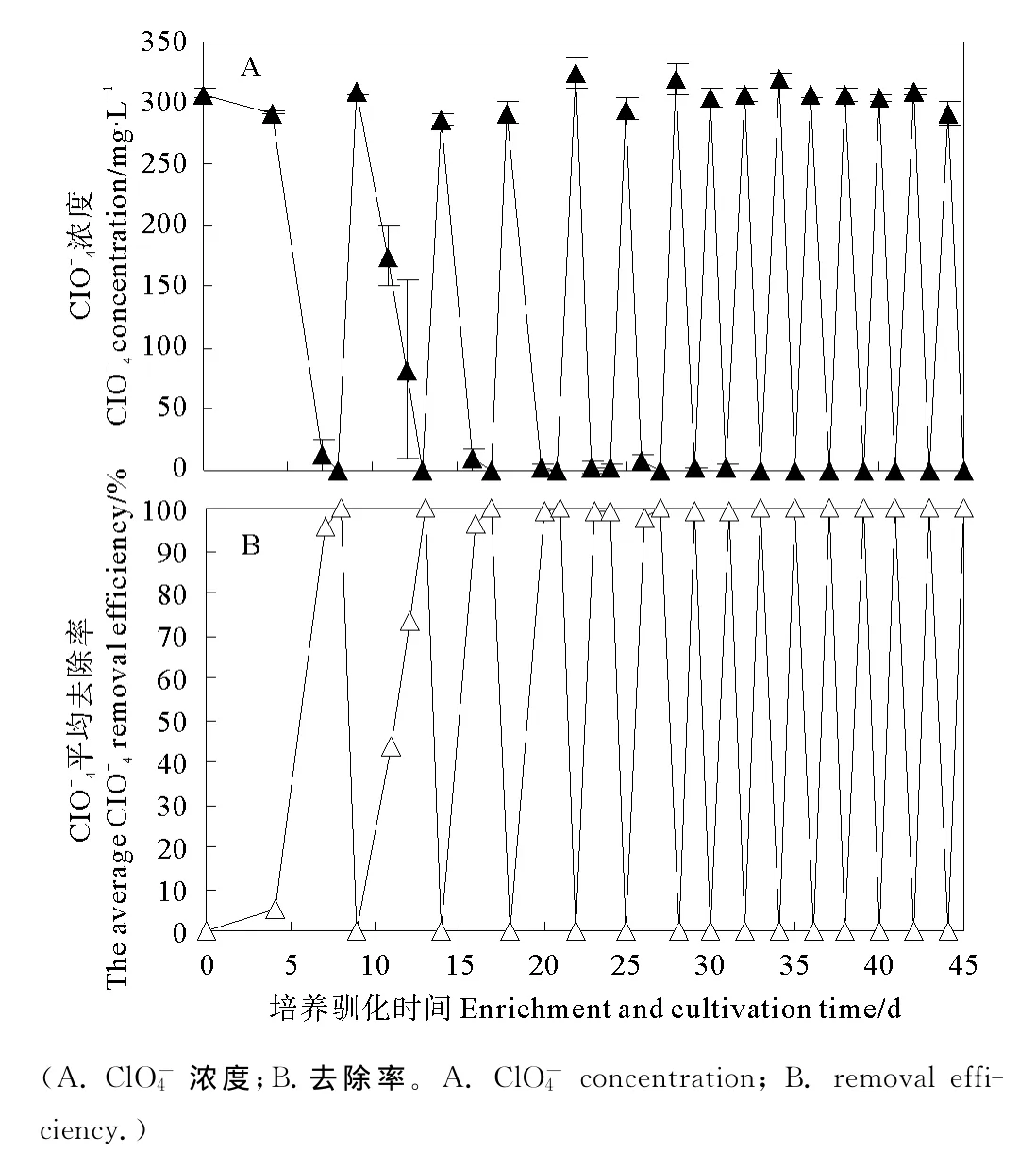
图1 培养驯化过程中ClO-4浓度及去除率的变化Fig.1 Change of ClO-4concentration and removal efficiency during the enrichment and cultivation
3.2 培养驯化过程中pH的变化
培养驯化氢自养高氯酸盐的适宜pH值为7左右。本研究采用磷酸盐缓冲液确保体系中pH值稳定,每个驯化周期初期pH值调至7.2左右,不同的培养驯化周期Cl-的浓度变化如图2所示。
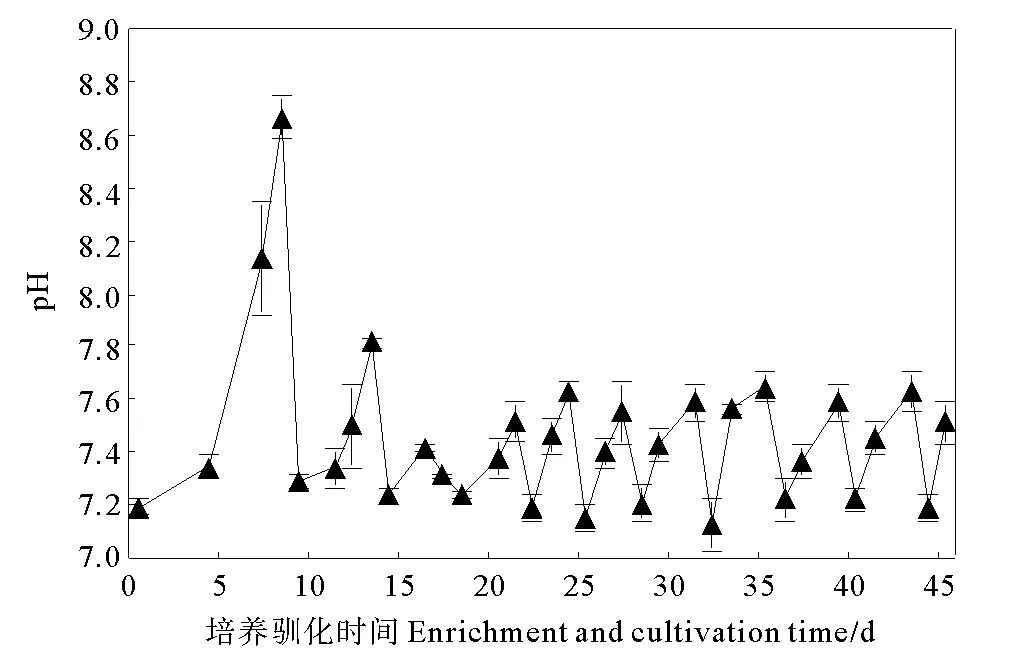
图2 培养驯化过程中pH的变化Fig.2 Change of pH during the enrichment and cultivation
由图2可知,在不同培养驯化周期内厌氧瓶反应体系中均出现了pH的上升,且培养驯化周期时间越长,pH上升幅度越大。第1培养驯化周期内,反应体系pH由最初的7.2逐步上升到8.7,但试验中及时更换培养基因,没有造成pH过高现象。第2培养驯化周期缩短至4天,反应体系pH由最初的7.3升至7.8。随着培养驯化时间的增加,每个驯化周期内反应体系pH上升幅度继续减小,反应体系pH稳定在7.1~7.6,满足氢自养高氯酸盐生长、发育和繁殖的条件。
3.3 培养驯化过程中污泥浓度的变化
污泥浓度以蛋白质浓度表征,不同的培养驯化周期蛋白浓度的浓度变化如图3所示。由图3可知,在整个培养驯化过程中厌氧瓶反应体系中蛋白质含量由最初的156mg/L到第8培养驯化周期末降至102mg/L,驯化后期有所上升,培养驯化结束时含量为117mg/L。在以厌氧泥为接种泥的氢自养高氯酸盐还原菌驯化过程中,驯化初期刚接种的污泥中有一部分细菌因不适应环境而被淘汰,驯化后期反应体系内氢自养高氯酸盐还原菌得到增殖,富集产生氢自养高氯酸盐还原菌污泥沉降性能较好,且具有较高的高氯酸盐还原活性。
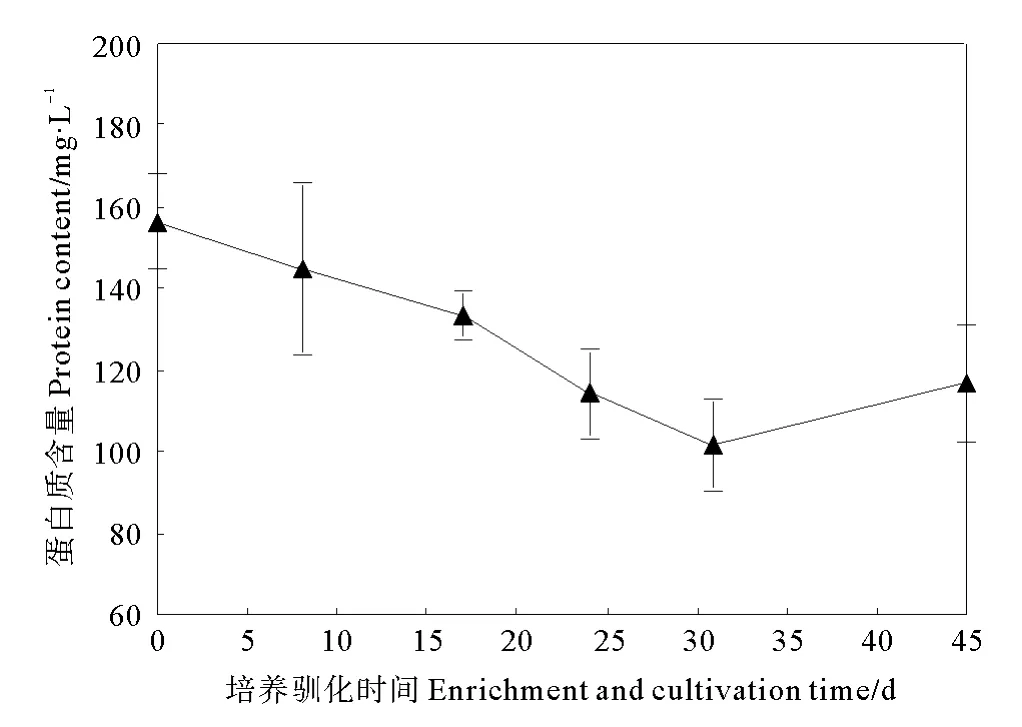
图3 培养驯化过程中蛋白质含量的变化Fig.3 Change of protein content during the enrichment and cultivation
3.4 培养驯化过程中微生物群落结构的变化
3.4.1 DNA提取与PCR扩增 为了系统地研究厌氧污泥培养驯化过程中微生物群落结构的演替变化,分别从厌氧接种污泥和第8、24和45天的样品中提取DNA,对应的编号分别为1、2、3、4,将样品的 DNA提取结果,与λ-Hind III digest DNA Marker相对照,其分子量在23kb左右,与细菌基因组的大小相同,所提DNA为较完整的细菌基因组DNA。与Marker相比,目标条带较清晰,亮度和纯度较好,没有出现明显的拖带现象,无短片段出现,说明已经获得了较完整的微生物总DNA且适宜于PCR扩增反应。将提取的DNA梯度稀释后进行16srDNA片段PCR扩增。扩增产物的凝胶电泳图如图4所示。
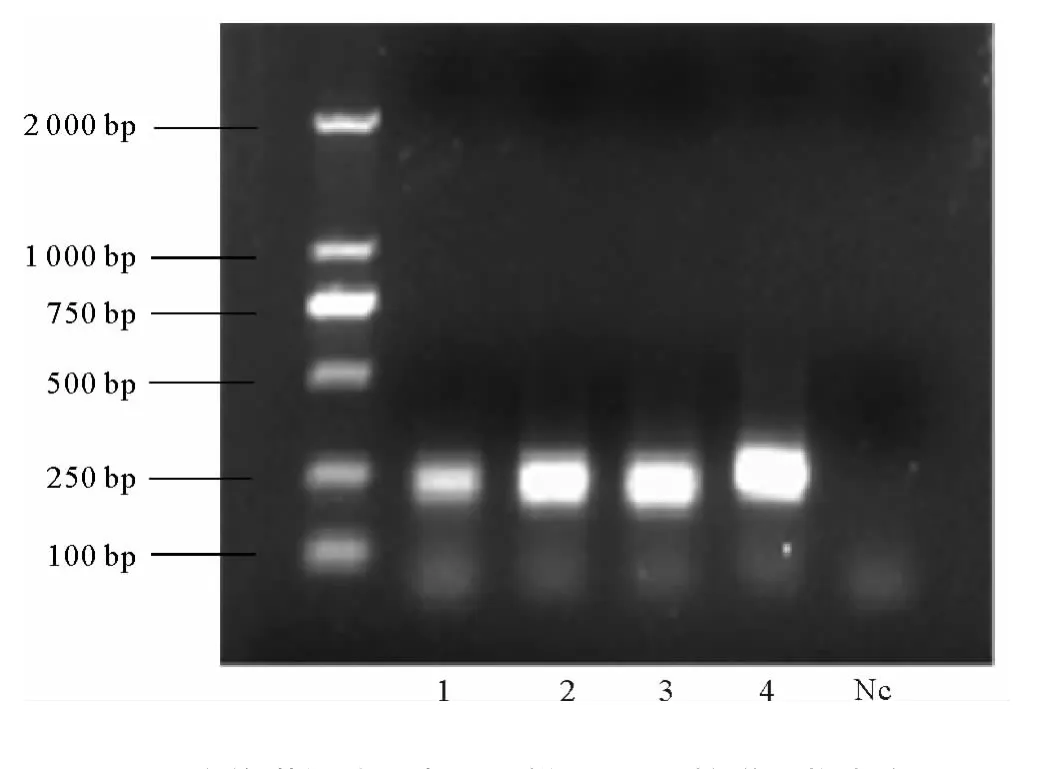
图4 培养驯化过程中污泥样品PCR扩增产物电泳图Fig.4 Agarose gel electrophoresis of PCR amplified 16SrDNA during the enrichment and cultivation
由图4可知,4个样品均得到良好的扩增效果,条带清晰且无非特异性扩增。与DL2000DNA Marker(M)对照发现,条带的亮度较好,且阴性对照(Nc)无污染,片段大小约为230bp,证实为16srDNA V3区特异性片段。
3.4.2 DGGE条带分析 不同驯化时期污泥样品的DGGE条带图谱见图5所示。污泥中微生物较高的菌种丰富度反映出系统良好的微生物多样性。DGGE图谱中不同样品的条带之间存在明显的差异,这说明微生物的种群结构在不断地发生着演替变化。
以样品1为标准,用Quantity One软件对DGGE凝胶各泳道的条带进行比较(见图6)。
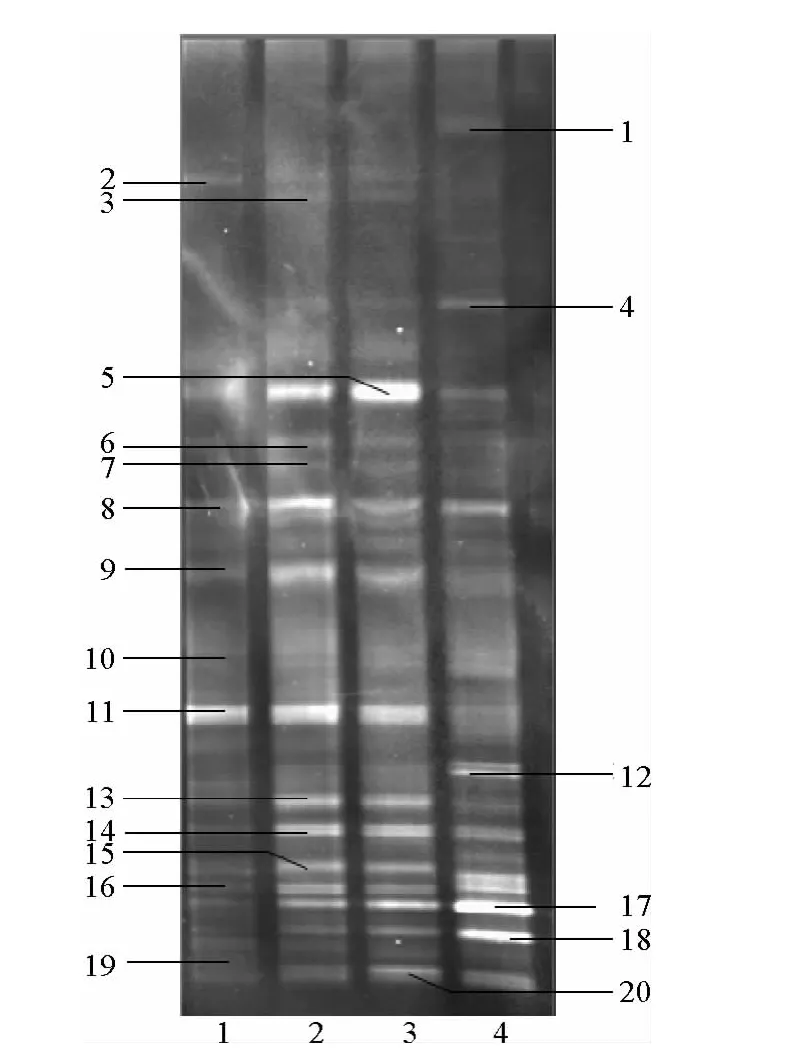
图5 培养驯化过程中污泥样品的DGGE谱图Fig.5 DGGE profile of sludge during the enrichment and cultivation
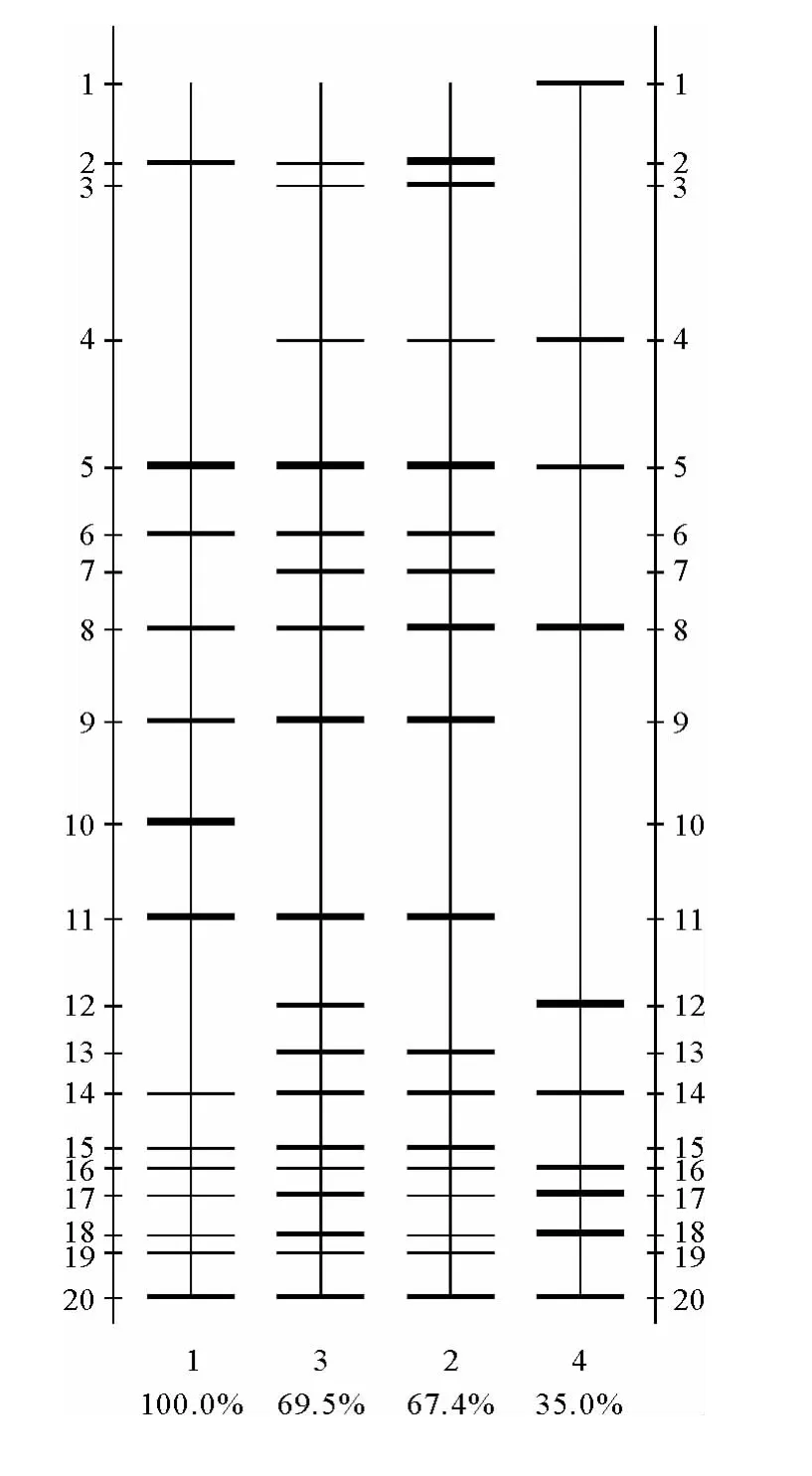
图6 不同泳道DGGE条带对比图谱Fig.6 Comparative profile of DGGE in different lanes
泳道中条带的粗细程度与样品条带在DGGE凝胶上的密度大小相对应。条带粗、黑表明细菌密度大,条带细、淡则表明细菌密度小。虽然在整个驯化过程中微生物种群结构发生了较大的改变,但是条带5、8、14、16、17、18、20保持了一定的稳定性,说明它们所代表的细菌一直存在于整个系统的运行期间,具有较强的适应性。条带1对应的微生物种群在泳道4(第45天)中才发现,而在此泳道中未发现条带2、6、9、10、11、15、19所对应的的微生物种群。条带3、7、13对应的微生物种群只出现在泳道2(第8天)、3(第24天)。同样在泳道2中未发现条带12所对应的微生物种群。这说明了在整个驯化过程中,微生物群落的结构和数量都发生了复杂的变化。
3.4.3 微生物种群结构相似性分析 采用戴斯系数(Dice coefficient)计算出各样品的相似性(见表3),从而对各样品之间的相似性进行比较。样品2(第8天)与接种污泥相似性较低,为67.4%,样品3(第24天)与接种污泥的相似性上升为69.5%,达到最高,随后相似性降低。样品4(第45天)与接种污泥的相似性达到最低,仅为35.0%。样品2和样品3相似性最高,可达83.6%。样品2和样品4的相似性仅为42.9%。这说明反应体系内微生物群落发生了复杂的变化,微生物系统存在较高的多样性。
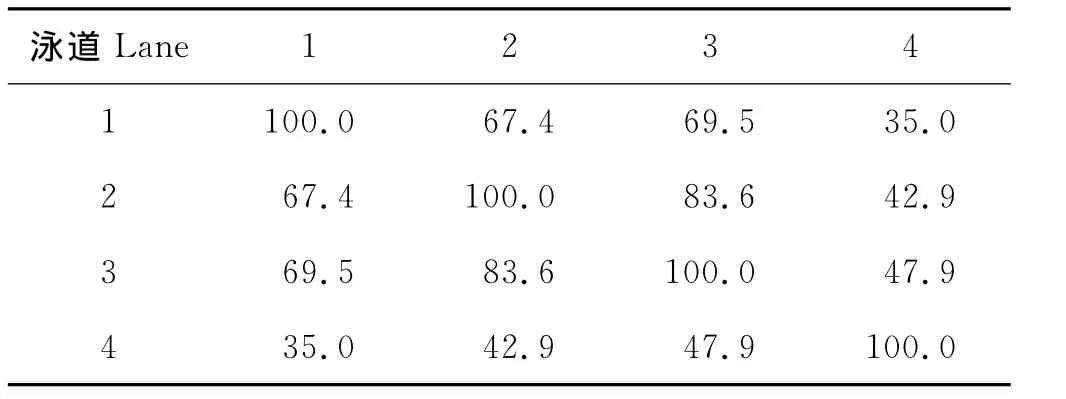
表3 DGGE图谱相似性矩阵Table 3 Dice coefficients(Cs)comparing the similarities of DGGE fingerprints
4 结论
(1)在45天的氢自养厌氧驯化过程中,厌氧接种污泥能在短暂的适应期后表现出较高的高氯酸盐降解活性,并且随着驯化过程的进行降解速度显著提高,最终实现对高氯酸盐的高效去除,适宜作为后续反应器的接种污泥。
(2)驯化各周期的高氯酸盐还原降解过程中都出现了pH的上升,且驯化周期时间越长,pH上升幅度越大。但实验中及时更换培养基使驯化过程中pH变化基本始终在中性范围内,因此没有造成对微生物还原高氯酸盐过程的抑制现象。
(3)驯化过程中,污泥蛋白含量相对驯化初期有一定程度的下降,但未影响高氯酸盐去除效果,表明驯化富集产生的还原菌具有较高的高氯酸盐还原活性。
(4)采用PCR-DGGE技术对接种厌氧污泥的反应体系内不同驯化时期的污泥进行微生物群落结构分析和对比,结果说明体系内具有良好的微生物多样性,驯化过程中微生物群落结构发生动态变化,逐渐形成具有高氯酸盐还原性能的微生物群落。
[1] 姜苏,李院生,马红梅,等.环境中高氯酸盐的来源、污染现状及其分析方法[J].地球科学进展,2010,25(6):617-624.
[2] 钱慧静,奚胜兰,何平,等.生物法降解高氯酸盐及其优化研究[J].环境科学,2009,30(5):1402-1407.
[3] Krynitsky A J,Niemann R A,Nortrup D A.Determination of perchlorate anion in foods by ion chromatographytandem mass spectrometry[J].Anal Chem,2004,76(18):5518-5522.
[4] Kirk A B,Martinelango P K,Tian K,et al.Perchlorate and iodide in dairy and breast milk[J].Environ Sci Technol,2005,39(7):2011-2017.
[5] 蔡亚岐,史亚利,张萍,等.环境中的环境污染问题[J].化学进展,2006,18(11):1554-1564.
[6] Liang S,Scott K N,Palencia L S,et al.American Water Works Association Water Quality Technology Conference[C].San Diego:社会人文机构,1998.
[7] Jaekyung Yoon,Yeomin Yoon,Gary Amy,et al.Use of surfactant modified ultrafiltration for perchlorate(ClO4-)removal[J].Water Research,2003,37:2001-2012.
[8] Rikken G B,Kroon A G M,Ginkel C G.Transformation of(per)chlorate into chloride by a newly isolated bacterium:reduction and dismutation[J].Appl Microbiol Biotechnol,1996,45:420-426.
[9] Logan B E,Lapoint D.Treatment of perchlorate and nitrate-contaminated groundwater in an autotrophic,gas phase,packed-bed bioreactor[J].Water Research,2002,36:3647-3653.
[10] Herman D C,Frankenberger J W T.Bacterial reduction of perchlorate and nitrate in water[J].Journal of Environmental Quality,1999,28:1018-1024.
[11] Bender K S,Shang C,Chakraborty R,et al.Identification,characterization and classification of genes encoding perchlorate reductase[J].Journal of Bacteriology,2005,187(15):5090-5096.
[12] Ju X M,Sierra-Alvarez R,Field J A,et al.Microbial perchlorate reduction with elemental sulfur and other inorganic electron donors[J].Chemosphere,2008,71(1):114-122.
[13] Nerenberg R,Kawagoshi Y,Rittmann B E.Kinetics of a hydrogen-oxidizing,perchlorate-reducing bacterium[J].Water Res,2006,40(17):3290-3296.
[14] Yu X Y,Amrhein C,Deshusses M A,et al.Perchlorate reduction by autotrophic bacteria in the presence of zero-valent iron[J].Environ Sci Technol,2006,40(4):1328-1334.
