尿液小分子物质检测及其应用前景
2013-10-16陈逸南于颖彦
陈逸南,于颖彦
当前,在疾病检查中,血尿便检查是简便而重要的手段之一。除此之外,再视患者病情而增加必要的内镜、X线检查等。但实践中人们普遍感到,传统的血尿便检测灵敏度和特异度尚不高,难以满足临床需求。而内镜、X线等检查又存在操作复杂、对受检者影响较大等而难以作为人群普查手段。多年来,研究人员一直探寻一种简便易行、创伤性小且适合于疾病检查的新方法。尿液是目前最方便获得的生物样本,其排泄物的变化不仅可以反映泌尿系统自身健康状况,还可以反映全身的代谢状况,围绕尿液生物标志物研究已有不少报道[1-8]。由于尿液中小分子含量极低,常规检测方法不易检测,故在尿液生物标志物研究中,检测方法的选择与建立就显得格外重要。
1 间接竞争酶联免疫法
20世纪70年代建立的酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)可以检测体液样本中的生物抗原。其基本原理是:将抗原或抗体结合到某种固相载体表面,并保持其免疫活性;将抗原或抗体与某种酶连接成酶标抗原或抗体,同时要保留其免疫活性和酶活性。在测定时,把受检标本(测定其中的抗体或抗原)和酶标抗原或抗体按不同的步骤与固相载体表面的抗原或抗体起反应,通过洗涤去除固相载体上其他物质,结合在固相载体上的酶量与标本中受检物质的含量成比例。加入酶反应底物后,底物被酶催化变为有色产物,产物的量与标本中受检物质含量相关,根据颜色反应深浅进行定性与定量分析。在酶催化反应中可放大反应效果,从而实现提高敏感度目的。ELISA具有快速、敏感、简便、易于标准化等优点,加之电脑化程度极高的ELISA检测仪的应用,该法已经成为应用最广泛的检测方法之一。ELISA技术主要有直接法、间接法、竞争法等。小分子抗原或半抗原因缺乏可做夹心法的2个以上抗原表位而不能用双抗体夹心法测定,需要采用竞争法检测。竞争ELISA法又分为直接竞争ELISA和间接竞争ELISA,以间接竞争ELISA的灵敏度较高。其原理是标本中的抗原和固相抗原竞争抗体,前者结合力强而优先与抗体结合反应,剩余抗体与固相抗原反应,故固相吸附的抗体与样本中的抗原浓度成反比;之后在板孔中加入酶标二抗,标本中的抗原含量越多,结合在固相上的酶标二抗愈少,最后的显色也愈浅(图1)。在固相包被抗原的板孔里分别加入待测抗原和特异性抗体,温育反应后通过洗板除去待测抗原、抗体复合物;而后在固相结合的抗体中加入酶标二抗,温育反应后洗板去除多余二抗,再加入底物显色,其颜色深度和待测样品浓度呈反比。对小分子激素、化合物和药物等的ELISA多采用此方法[9-14]。尿液中的小分子有机物抗原性弱,缺乏2个以上的抗原表位,故也应当选用间接竞争法检测。根据以往报道,间接竞争法的检测灵敏度可达到纳克(ng)水平,且成本较低,适合大样本检测,具有广泛的应用前景。

图1 间接竞争ELISA
2 实时定量免疫聚合酶链反应(polymerase chain reaction,PCR)
免疫PCR技术是Sano等[15]建立的一种超高灵敏度的检测方法,该方法综合了固相免疫反应和PCR两者的特点,在保证免疫测定特异性的同时又具有极高的灵敏度。免疫PCR的基本原理和常规标记免疫技术相似,只是标记抗原或抗体的标记物是DNA。若待测样品为人类样本,作为标记物的DNA最好来自细菌或噬菌体。在固相免疫结合反应步骤完成后再采用PCR对标记的DNA分子进行扩增,最后通过检测DNA扩增产物来实现对抗原或抗体的定性或定量。该方法正在不断改进与完善当中。在免疫PCR检测中,固相包被的抗原与生物素化抗体结合后,洗去多余抗体再加入亲和素后洗板;然后,加入生物素化的DNA,充分反应后洗板;最后进行PCR反应,因为PCR有很强的放大能力,可以定量检测DNA的拷贝数(图2)。该方法的敏感性和特异性远远高于ELISA。在包被待测抗原后,加入生物素化特异性抗体,温育后洗去多余生物素化抗体;随后加入亲和素,温育反应后洗去多余亲和素;再加入生物素化DNA反应,洗板去除多余生物素化DNA后,用实时定量免疫PCR扩增生物素化DNA,从而实现对待测小分子的定量。
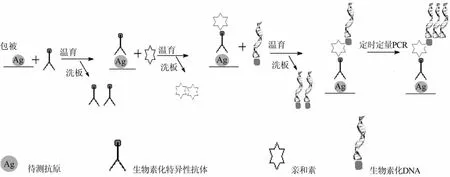
图2 免疫PCR方法
2.1 抗原、抗体反应系统 免疫PCR中的免疫反应和普通的ELISA类似,被检测的样品可以是抗原,或者是作为抗原的某种抗体。待检的抗原可以直接吸附于固相载体,而固相载体在免疫反应方面要求对抗原包被均匀,结合稳定。PCR反应要求固相载体导热性能好,耐高温,液面小且不易挥发。而抗体的特异性和亲合力将影响免疫PCR的特异性和敏感性。一般均选用单克隆抗体,这个抗体常采用生物素标记,通过亲和素再结合DNA。Sano等最早采用的是直接利用DNA-抗体复合物和固相抗原结合法,但直接包被待检抗原不适用于临床标本和难以吸附固相抗原的检测。随后陆续出现了夹心免疫定量 PCR法[16-19](图3)。其原理和普通夹心ELISA类似,特异性抗体吸附至固相载体上,先后加入样本、生物素化抗体、亲和素、生物素化DNA,最终固定于固相载体上的生物素化DNA与目标物质的含量相关,通过实时荧光定量PCR可以检测样本中的目标抗原。
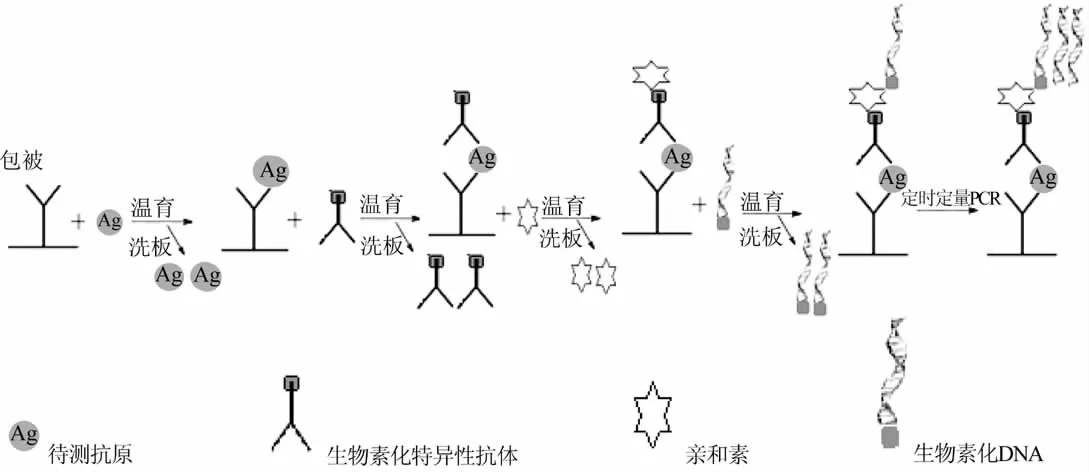
图3 夹心免疫定量PCR
2.2 连接系统 连接系统是指连接抗原-抗体反应系统与DNA分子之间的连接分子或复合物,是免疫PCR技术的关键环节。Sano等使用的是重组葡萄球菌A蛋白(staphylococcal protein A,SPA)-链亲和素嵌合蛋白。此嵌合蛋白的链亲和素部分能识别DNA上的生物素,SPA部分可以被特异性抗体的Fc段所识别,IgG便与生物素化的DNA连接成复合物。然而,SPA不但可以结合特异抗体的IgG,还可以与样品中吸附于固相载体的无关IgG结合,易导致本底高和特异性差。Ruzicka等[20]用商业化的亲和素建立了一种免疫PCR。其基本方法是先将亲和素和生物素化的DNA预结合成复合物,然后与结合固相的生物素化抗体反应。由于1个亲和素可以结合4个生物素分子,因此在预结合时如果生物素化的DNA分子过多,将亲和素完全饱和,亲和素就再无结合生物素化抗体的能力了。只有部分结合生物素化DNA的亲和素才能起到连接分子的作用。因此,每次制备的连接分子结合能力均有差异,导致可重复性较差。Zhou等[21]将连接分子改进成链亲和素,生物素和链亲和素都已商品化。
2.3 标记分子DNA和PCR反应系统 免疫PCR中的DNA是作为标记分子,用DNA聚合酶将结合于固相载体上的DNA进行扩增,由此定量检测抗原。免疫PCR中的DNA分子可以是任何DNA,但要确保DNA的纯度和较好的均质性,且引物容易设计、易于扩增和退火温度适中。此外,要与待检样品中可能存在的DNA非同源性。在分析人类生物样本时一般选用质粒或细菌DNA。DNA的生物素化是用生物素标记的脱氧腺苷三磷酸(deoxyadenosine triphosphate,dATP)或脱氧尿苷三磷酸(deoxyuridine triphosphate,dUTP)通过DNA聚合酶标记在DNA分子上。生物素化的DNA用量需预先选定,过多易出现非特异结合而引起本底过高,过低将导致敏感性低和出现不同浓度抗原得出同样结果的饱和现象。
2.4 检测系统 由于免疫PCR是检测扩增的DNA拷贝数,故可以实现定量检测目的,可以借助于凝胶电泳、微孔板技术、实时荧光检测等。电泳法虽然复杂耗时,但仍有一些报道[15,20,22-23]。微孔板技术包括PCR-ELISA[24],可以实现对大样本的平行检测。实时荧光检测技术在样本PCR的过程中直接收集荧光数字信号,成本较低且减少了样品的污染,是对PCR检测技术的发展。在实时荧光定量PCR反应中引入了一种荧光化学物质,随着PCR反应的进行,PCR反应产物不断累计,荧光信号强度也等比例增加。每经过一个循环,收集一个荧光强度信号,通过荧光强度变化监测产物量的变化,从而得到一条荧光扩增曲线。利用荧光信号的变化实时检测PCR扩增反应中每一个循环扩增产物量的变化。McKie等[25]首次将荧光定量PCR技术和免疫PCR技术结合起来对腮腺炎病毒特异性抗体进行了检测。他们将指示分子通过化学交联剂与抗体交联,利用荧光定量PCR仪检测指示分子,通过PCR测定出指示分子的量与检测标本中特异性抗体的水平呈正相关来推算样品中特异性抗体的含量。
随着灵敏度和再现性问题的解决,实时荧光定量免疫PCR技术得到了广泛的应用。在医学领域,有研究者利用该技术对血清中的病毒、细菌的抗原和抗体进行检测[17,26-29],也有学者将该法应用于肿瘤标志物检测[30-31],其检测灵敏度达到皮克(pg)水平。
3 气相色谱-质谱联用仪技术
代谢物组学是后基因时代的一门学科,由英国伦敦大学帝国学院的Nicholson教授于1999年提出,旨在对生物系统的小分子混合物进行分析,并对生物标本代谢物含量变化进行检测。其中,磁共振技术和质谱仪是用于代谢物检测的最常用技术。以质谱为基础的技术包括气相色谱-质谱联用仪(gas chromatography-mass spectrometer,GC-MS)、气相色谱-质谱/质谱联用仪(gas chromatography tandem mass spectrometer,GC-MS/MS)、液相色谱-质谱联用仪(liquid chromatography-mass spectrometry,LC-MS)、液相色谱-质谱/质谱联用仪(liquid chromatography tandem mass spectrometry,LC-MS/MS)。而 GC-MS技术由于其高分辨率、高灵敏度、可重复性而被广泛应用于代谢物组学研究中。近年来,人们逐渐把该技术引入尿液肿瘤标志物的研究,并在胃癌[7]、结肠癌[32]、膀胱癌[33]、肺癌[34]、肾癌[35]、前列腺癌[36]等疾病研究中取得了一系列发现。GC-MS技术在尿液检测中的作用已经得到了人们的认可。
3.1 气相色谱-质谱联用仪技术工作原理 气相色谱法是利用不同物质在固定相和流动相分配系数的差别,使不同化合物从色谱柱流出的时间不同,以达到分离的目的。气相色谱法提供保留时间和强度二维信息,得到的是二维谱图。其最大特点在于高效的分离能力和高的灵敏度,因此是分离混合物的有效手段。
质谱法是利用带电粒子在磁场或电场中的运动规律,按其质荷比实现分离分析,测定离子质量及其强度分布。主要特点是能给出化合物的分子量、元素组成、化学式及分子结构信息,具有定性专属性强、灵敏度高、检测快速的优势。
气相色谱法定性依据是色谱峰的保留时间,定量依据则是色谱峰高或峰面积。然而不同物质总避免不了同一色谱柱上保留时间相同的可能性,而且保留值测定的重复性仍是气相色谱法致力解决的一个问题。另一方面,质谱仪检测法对样品的检测要求较高,样品纯度越高,杂质形成的本底对质谱图产生的干扰越小,得到的质谱图越容易解析。两者的优劣正好互补,气相色谱对样品高效的分离能力正好满足质谱仪对样品高纯度的要求,而后者对纯物质准确的定性能力也填补了气相色谱无法定性的缺陷。样品混合物经过适当的衍生化处理后进入GCMS,在高温下、汽化后在离子源的作用下样品分子转化为离子,随后进入色谱柱,经过分离后各组分依次进入质谱仪检测(图4)。汽化后的混合物在气相色谱仪中分离,得到色谱图;随后,样品离子进入质谱仪检测,得到各物质质谱图。

图4 GC-MS工作原理
这样,混合物经过GC-MS测定后,通过气相色谱得到保留时间和强度信息,再从质谱仪得到质荷比和强度信息,从而实现三维信息的建立,保留时间和质谱图的双重定性,大大提高了定性的准确性,而后从质谱峰强度信息得到样品的含量信息。
3.2 GC-MS的定性与定量 GC-MS的定性主要手段是谱库检索。通常GC-MS的数据系统软件都配有不同的质谱数据库和谱库检索程序,较通用的是国家标准与技术研究院(National Institute of Standards and Technology,NIST)检索系统。该质谱数据库收集的质谱图用正常(70 eV)的电离方式,在一定条件下获得纯化合物的质谱图以及化合物相关信息,该质谱图又称为“标准谱图”。实际应用中,数据库系统会将未知化合物和谱库中标准谱图逐一进行比较,然后按相似系数(又称匹配率)由高到低顺序排列。比较的方法有两种,一种为“正检索”,即未知谱图和参考谱图逐个峰比较,看谱库中是否存在与未知谱相同的参考谱图;反之,看参考谱中的各质量峰是否出现在未知谱中,称为“逆检索”。正检索、逆检索的匹配率最大值均为1 000,一般大于900则结果可靠性大,如小于600则可靠性较差(不同仪器有不同表示方法)。但实际上并不是匹配率高就能定性,因为“标准谱图”是在特定条件下的纯物质质谱图,而每次检测时GC-MS条件不同,所用仪器类型也不完全相同,得到的谱图也会有所偏差。另一方面,异构体、同系物、结构相似化合物谱图相近,检索结果匹配率也相近,无法简单的按匹配率高低来确定,此时则需要依赖保留时间来辅助。
GC-MS分析中,计算机将采集的质谱信号处理后以不同的谱图形式再现,除了质谱图外,还有总离子流色谱图(total ion current,TIC)、质量色谱图(mass chromatography,MC)等,是对几个目标化合物的特征离子进行检测,而不检测不需要的质量离子。由图5可见,MC图明显简洁明了,不仅能排除基质和杂质峰的干扰,还极大地提高检测灵敏度,该方法为目前GC-MS定量的首要方法。TIC图相当于色谱图(图6),显示的是经色谱柱流出的所有组分的色谱峰。质量色谱图是由TIC图重新建立的特定质量离子强度随扫描时间变化的离子流图,其显示为具有所选择特征质量的那些组分的色谱峰(图5)。由于一次进样只能检测选定的某几个离子,其他离子都不检测,因此其扫描灵敏度远远高于全扫描;另外,其色谱图比TIC图简洁,消除了背景的干扰,因此GC-MS定量分析多采用质量色谱峰面积定量。GC-MS常用的定量方法和色谱一样,有归一化法、外标法、内标法等。现代GC-MS的分离度和分析速度、灵敏度、专属性和通用性,至今仍是其他联用技术难以达到的。因此,只要待测成分适用于GC分离,GC-MS就成为联用技术中首选的分析方法。

图5 质量色谱图(MC图)

图6 GC-MS总离子流色谱图(TIC图)
4 尿液标本的前处理
尿液中含有丰富的代谢产物,成分复杂,因此进行检测时,需进行一定的前处理,以更好地适应检测方法学要求。对于ELISA和实时定量免疫PCR而言,由于尿液中可能存在的蛋白、有机物与抗体的非特异性结合会对结果产生干扰,因此对收集的尿样,应首先10 000 r/min×20 min离心后置于-80℃冰箱保存,必要时,可考虑再以截留相对分子质量为10×103的超滤离心管5 000 r/min×20 min离心去除样品中其余的干扰组分。相对而言,GC-MS的前处理要求较高,只有当样品能挥发且遇热稳定时才能直接进行GC-MS分析。而尿液中许多代谢物具有亲水性化学基团,常规的GC-MS显然不适于研究极性和亲水性化合物。衍生化方法可以将难挥发或热不稳定化合物通过化学反应转变成易挥发和遇热稳定的化合物,然后再进行GC-MS分析。目前,常用的衍生化法中有硅烷化反应、酰化反应、烷基化反应、酯化反应等。其中,硅烷化是GC-MS分析中最广泛使用的衍生化方法,但其不足之处在于衍生化需花费较多时间。Qiu等[37]最近建立了一种以氯甲酸乙酯(ethyl chloroformate,ECF)作为衍生试剂的衍生化方法,并在尿液、血液中取得成功。该方法能将尿液中的氨基酸、胺类、有机酸等物质迅速酯化,操作简便,周期较短,稳定性较高,适合尿液GC-MS样品的衍生化要求。
5 尿液小分子物质检测临床应用前景
尿液中含有丰富的机体代谢产物,这些代谢产物以小分子化合物为主,尿液小分子化合物检测与鉴定对技术的要求较高。前述几种方法各有利弊,ELISA技术是目前应用最广泛的检测技术之一。该方法成熟而成本低,特别是对于大样本的检测具有明显优势。但是如果选用ELISA法,则必须考虑无关蛋白与抗体的非特异性结合,可能出现假阳性或假阴性。免疫PCR技术因其特异性强、灵敏性高,更适合于极微量抗原、抗体的检测,但存在操作步骤比ELISA技术繁琐的缺陷,而且免疫PCR技术处于起步阶段尚未标准化。GC-MS是一项较为成熟技术,在低含量物质检测中灵敏度高且方法稳定;其不足之处是设备昂贵,对操作人员的技术要求较高,且操作过程烦琐,样本前处理复杂,总体检测耗时较长。对于临床大样本的检测分析,GC-MS成本较高,作为临床常规应用尚有困难。尿液小分子具有采集方便、无创等优点,尿液小分子的检测可以发现与疾病相关的生物标志物并进行分子诊断,实现分子医学向临床转化[38]。综上所述,目前GC-MS主要用于科学研究中样品定量的金标准;ELISA技术仍然是临床最常用的检测方法,对于大样本的检测筛查仍然首选ELISA法,如能进一步提高ELISA法灵敏度和特异度,其可在在临床中发挥更大作用;实时定量免疫PCR技术灵敏度高而具有较大的发展空间,如其仪器、试剂能进一步标准化、商品化,其前景将更加广阔。
[1]Dong LM,Shu XO,Gao YT,et al.Urinary prostaglandin E2 metabolite and gastric cancer risk in the Shanghai women's health study[J].Cancer Epidemiol Biomarkers Prev,2009,18(11):3075-3078.
[2]Szajda SD,Snarska J,Jankowska A,et al.Isoenzymes A and B of N-acetyl-beta-D-hexosaminidase in serum and urine of patients with pancreatic cancer[J].Hepatogastroenterology,2008,55(82/83):695-698.
[3]El-Masry S,El-Sayed IH,Lotfy M,et al.Utility of slotblot-ELISA as a new,fast,and sensitive immunoassay for detection of carcinoembryonic antigen in the urine samples of patients with various gastrointestinal malignancies[J].J Immunoassay Immunochem,2007,28(2):91-105.
[4]Skipworth RJ,Stewart GD,Bhana M,et al.Mass spectrometric detection of candidate protein biomarkers of cancer cachexia in human urine[J].Int J Oncol,2010,36(4):973-982.
[5]Saito J,Imamura Y,Itoh J,et al.ELISA measurement for urinary 3-hydroxyproline-containing peptides and its preliminary application to healthy persons and cancer patients[J].Anticancer Res,2010,30(3):1007-1014.
[6]Kim KB,Yang JY,Kwack SJ,et al.Toxicometabolomics of urinary biomarkers for human gastric cancer in a mouse model[J].J Toxicol Environ Health A,2010,73(21/22):1420-1430.
[7]Hu JD,Tang HQ,Zhang Q,et al.Prediction of gastric cancer metastasis through urinary metabolomic investigation using GC/MS[J].World J Gastroenterol,2011,17(6):727-734.
[8]Guadagni R,Miraglia N,Simonelli A,et al.Solid-phase microextraction-gas chromatography-mass spectrometry method validation for the determination of endogenous substances:urinary hexanal and heptanal as lung tumor biomarkers[J].Anal Chim Acta,2011,701(1):29-36.
[9]Yue L,Xia Q,Luo GH,et al.Urinary connective tissue growth factor is a biomarker in a rat model of chronic nephropathy[J].Transplant Proc,2010,42(5):1875-1880.
[10]Li X,Zhang G,Deng R,et al.Development of rapid immunoassays for the detection of ractopamine in swine urine[J].Food Addit Contam Part A Chem Anal Control Expo Risk Assess,2010,27(8):1096-1103.
[11]Ahn KC,Kasagami T,Tsai HJ,et al.An immunoassay to evaluate human/environmental exposure to the antimicrobial triclocarban[J].Environ Sci Technol,2012,46(1):374-381.
[12]Wyns C,Derycke L,Soenen B,et al.Production of monoclonal antibodies against hop-derived(Humulus lupulus L.)prenylflavonoids and the development of immunoassays[J].Talanta,2011,85(1):197-205.
[13]Liu Y,Huang L,Wang Y,et al.Tissue depletion and concentration correlations between edible tissues and biological fluids of 3-amino-2-oxazolidinone in pigs fed with a furazolidone-medicated feed[J].J Agric Food Chem,2010,58(11):6774-6779.
[14]Park HM,Lee SH,Chung H,et al.Immunochromatographic analysis of hippuric acid in urine[J].J Anal Toxicol,2007,31(6):347-353.
[15]Sano T,Smith CL,Cantor CR.Immuno-PCR:very sensitive antigen detection by means of specific antibody-DNA conjugates[J].Science,1992,258(5079):120-122.
[16]Dong J,Hasan S,Fujioka Y,et al.Detection of small molecule diagnostic markers with phage-based open-sandwich immuno-PCR[J].J Immunol Methods,2012,377(1/2):1-7.
[17]He X,Qi W,Quinones B,et al.Sensitive detection of Shiga Toxin 2 and some of its variants in environmental samples by a novel immuno-PCR assay[J].Appl Environ Microbiol,2011,77(11):3558-3564.
[18]Singer D,Soininen H,Alafuzoff I,et al.Immuno-PCR-based quantification of multiple phosphorylated tau-epitopes linked to Alzheimer's disease[J].Anal Bioanal Chem,2009,395(7):2263-2267.
[19]Niemeyer CM,Adler M,Wacker R.Detecting antigens by quantitative immuno-PCR[J].Nat Protoc,2007,2(8):1918-1930.
[20]Ruzicka V,Marz W,Russ A,et al.Immuno-PCR with a commercially available avidin system[J].Science,1993,260(5108):698-699.
[21]Zhou H,Fisher RJ,Papas TS.Universal immuno-PCR for ultra-sensitive target protein detection[J].Nucleic Acids Res,1993,21(25):6038-6039.
[22]Komatsu M,Kobayashi D,Saito K,et al.Tumor necrosis factor-alpha in serum of patients with inflammatory bowel disease as measured by a highly sensitive immuno-PCR[J].Clin Chem,2001,47(7):1297-1301.
[23]Sugawara K,Kobayashi D,Saito K,et al.A highly sensitive immuno-polymerase chain reaction assay for human angiotensinogen using the identical first and second polyclonal antibodies[J].Clin Chim Acta,2000,299(1/2):45-54.
[24]Niemeyer CM,Adler M,Blohm D.Fluorometric polymerase chain reaction(PCR)enzyme-linked immunosorbent assay for quantification of immuno-PCR products in microplates[J].Anal Biochem,1997,246(1):140-145.
[25]McKie A,Samuel D,Cohen B,et al.Development of a quantitative immuno-PCR assay and its use to detect mumps-specific IgG in serum[J].J Immunol Methods,2002,261(1/2):167-175.
[26]Barletta JM,Edelman DC,Constantine NT.Lowering the detection limits of HIV-1 viral load using real-time immuno-PCR for HIV-1 p24 antigen[J].Am J Clin Pathol,2004,122(1):20-27.
[27]Fischer A,von Eiff C,Kuczius T,et al.A quantitative realtime immuno-PCR approach for detection of staphylococcal enterotoxins[J].J Mol Med(Berl),2007,85(5):461-469.
[28]Tian P,Mandrell R.Detection of norovirus capsid proteins in faecal and food samples by a real time immuno-PCR method[J].J Appl Microbiol,2006,100(3):564-574.
[29]Barletta JM,Edelman DC,Highsmith WE,et al.Detection of ultra-low levels of pathologic prion protein in scrapie infected hamster brain homogenates using real-time immuno-PCR[J].J Virol Methods,2005,127(2):154-164.
[30]Jiang X,Cheng S,Chen W,et al.Comparison of oligonucleotide-labeled antibody probe assays for prostate-specific antigen detection[J].Anal Biochem,2012,424(1):1-7.
[31]Lind K,Kubista M.Development and evaluation of three real-time immuno-PCR assemblages for quantification of PSA[J].J Immunol Methods,2005,304(1/2):107-116.
[32]Cheng Y,Xie G,Chen T,et al.Distinct urinary metabolic profile of human colorectal cancer[J].J Proteome Res,2012,11(2):1354-1363.
[33]Jobu K,Sun C,Yoshioka S,et al.Metabolomics study on the biochemical profiles of odor elements in urine of human with bladder cancer[J].Biol Pharm Bull,2012,35(4):639-642.
[34]Niu Y,Jiang Y,Xu C,et al.Preliminary results of metabolite in serum and urine of lung cancer patients detected by metabolomics[J].Zhongguo Fei Ai Za Zhi,2012,15(4):195-201.
[35]Ganti S,Taylor SL,Abu Aboud O,et al.Kidney tumor biomarkers revealed by simultaneous multiple matrix metabolomics analysis[J].Cancer Res,2012,72(14):3471-3479.
[36]Wu H,Liu T,Ma C,et al.GC/MS-based metabolomic approach to validate the role of urinary sarcosine and target biomarkers for human prostate cancer by microwave-assisted derivatization[J].Anal Bioanal Chem,2011,401(2):635-646.
[37]Qiu Y,Su M,Liu Y,et al.Application of ethyl chloroformate derivatization for gas chromatography-mass spectrometry based metabonomic profiling[J].Anal Chim Acta,2007,583(2):277-283.
[38]陈志南.分子医学与转化医学的未来[J].转化医学杂志,2012,1(2):65-68.
