降冰片烯的合成研究进展
2013-10-13宋月潇史家乐许惠明孙春水傅建松谢家明
张 岩,宋月潇,史家乐,刘 学,姚 臻,曹 堃,许惠明,孙春水,傅建松,谢家明
(1浙江大学化工系聚合与聚合物工程研究所化学工程联合国家重点实验室,浙江 杭州 310027;2中国石化上海石油化工股份有限公司精细化工事业部,上海 200540)
降冰片烯(norbornene,NB),化学名为双环[2.2.1]-2-庚烯,分子式C7H10,相对分子质量94.16,沸点 96 ℃,熔点 44~46 ℃,闪点−15 ℃,密度0.950 g/cm3,折光率1.4475,常温下为白色透光结晶,易升华。工业上从乙烯和环戊二烯(cyclopentadiene,CPD)出发,经 Diels-Alder反应合成NB,其中,CPD主要来源于石油烃类裂解制乙烯过程中副产的 C5馏分中分离出来的双环戊二烯(dicyclopentadiene,DCPD)热分解产物,其来源丰富、价格低廉,且有利于促进C5馏分的综合利用[1]。目前,NB主要用于环烯烃共聚物(copolymer of cycloolefin,COC)合成。COC兼具低密度、低吸湿性、高透明性、高耐热性、高折光指数以及优良的加工性等优势,是近年来在工业界和学术界引起高度重视的无定形热塑性高分子材料[2-3]。1941年,Joshel等[4]首次描述了NB的合成反应以来,不断有NB合成工艺开发和研究的专利和文献报道,但至今为止公开的文献多为专利,且缺乏较为系统的评述。
1 反应机理
降冰片烯类化合物主要由环戊二烯(CPD)和亲双烯体通过Diels-Alder反应制得,如图1所示。
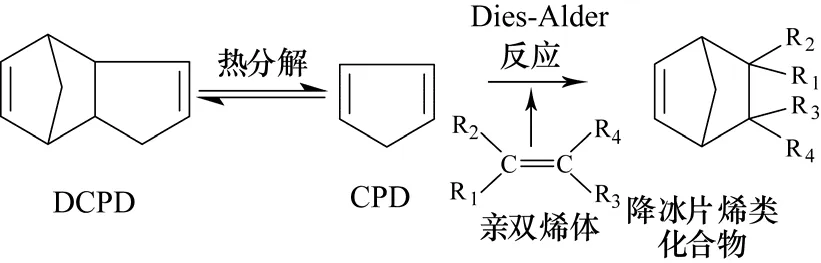
图1 降冰片烯的合成反应机理
CPD通过双环戊二烯(DCPD)在170 ℃以上高温分解得到,此反应需要消耗热量 ΔrH0=195700 J/mol[5]。CPD与亲双烯体的反应为放热反应,亲双烯体上的R1、R2、R3、R4可以是相同或不相同的H、—OH、—CN、—CHO、—COOH、—COOR、—COR、—CH2OH及其它含杂原子的基团。
Staudinger等[6]研究发现,DCPD在空间构型上有桥环式(endo-form)和封环式(exo-form)两种异构体,见图2。
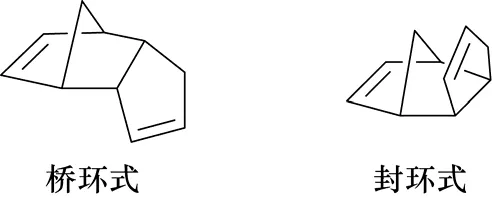
图2 DCPD的空间构型
两种异构体在物理性质和化学性质上均略有区别。桥环式为CPD在常温下的二聚体,封环式只有在高温下或经特殊处理才有少量存在。如将CPD在100 ℃二聚,可得到主要为桥环式和少量封环式DCPD的混合物。
Diels-Alder反应是一步进行的环加成协同反应,也称双烯合成。该类反应具有以下特点:反应进行时键的断裂和生成是同时进行的,反应过程中只有键变化的过渡态,一步发生成键和断键,没有自由基或离子等活性中间体产生[7]。如果亲二烯体上含有强吸电子基团,如腈基、羧基,所需反应温度可降低,反应相对容易。该特征可用前线轨道理论加以讨论。
降冰片烯常用乙烯作为亲二烯体与CPD反应,反应如式(1)。
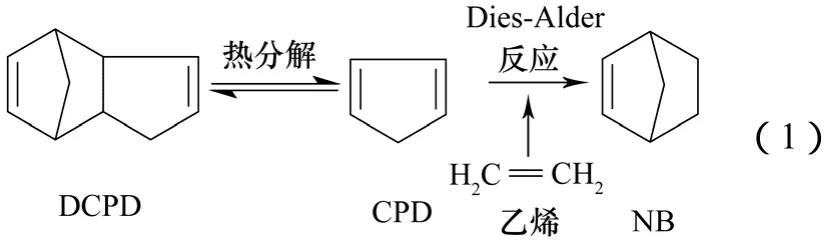
由于乙烯不含吸电子性质的取代基,在作为亲二烯体发生Diels-Alder反应时,因匹配轨道间的能级差较大,反应比较困难。目前,针对乙烯反应活性不足的补偿方法可归纳为两类:提高压力,是热力学和动力学上都有利的因素(实际为提高乙烯/CPD的摩尔比);升高温度,动力学有利,却是热力学不利的因素(CPD和亲双烯体的反应为放热反应)。
热力学研究表明,在175 ℃、150 bar(1 bar= 105Pa)条件下,DCPD热解聚生成CPD,平衡向生成CPD的方向移动。乙烯与CPD的反应是强放热反应,ΔH0298=-92000 J/mol。联合碳化物公司的Ahmed等[8]通过差示扫描量热法(DSC)分析发现,CPD经加热可在下述温度连续发生放热反应:265 ℃,形成DCPD低聚物(ΔH=−36400 J/g);335 ℃,低聚物转化为聚合物(ΔH=−44000 J/g);440 ℃,聚合物分解,生成大量气体(ΔH=−49800 J/g)。
按照CPD的不同来源,所报道的上述温度可以有30 ℃的变化差异,原因不明[8-9],这些因素增加了NB生产过程爆炸的可能性。为了保证生产工艺安全稳定,预测反应进行程度即动力学建模显得尤为重要。
此外,在这些反应条件下,还可能发生其它的副反应。
(1)CPD与NB进行Diels-Alder反应,生成四环十二碳烯(tetracyclo,[4.4.0.12,5.17,10]-3 dodecene,TCD),如式(2)。
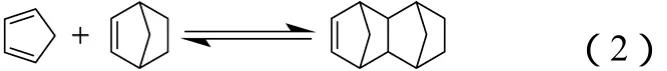
(2)CPD与DCPD进行Diels-Alder反应,生成环戊二烯三聚体(CPD Trimer,TM),如式(3)。

2 动力学建模
DCPD的解聚为单分子反应,根据分解条件不同可分为液相解聚和气相解聚。在 79~150 ℃,DCPD在纯液相中的解聚反应速率常数如式(4)[10]。
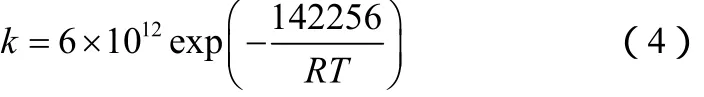
Herndon等[11]得到了 DCPD两种异构体在200~350 ℃时气相中的解聚反应速率常数,如式(5)、式(6)。

窦晓冬等[12]综合考虑了 DCPD分解的正逆反应和副反应,对DCPD解聚为CPD的过程进行了模型简化,如式(7)。将所有副产物归为一类 S,并以可逆-串连反应模型来描述。
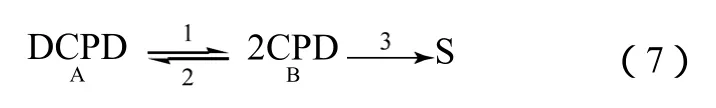
根据上述 DCPD解聚过程反应方程式简化模型,按一级反应作表观动力学处理,如式(8)、式(9)。
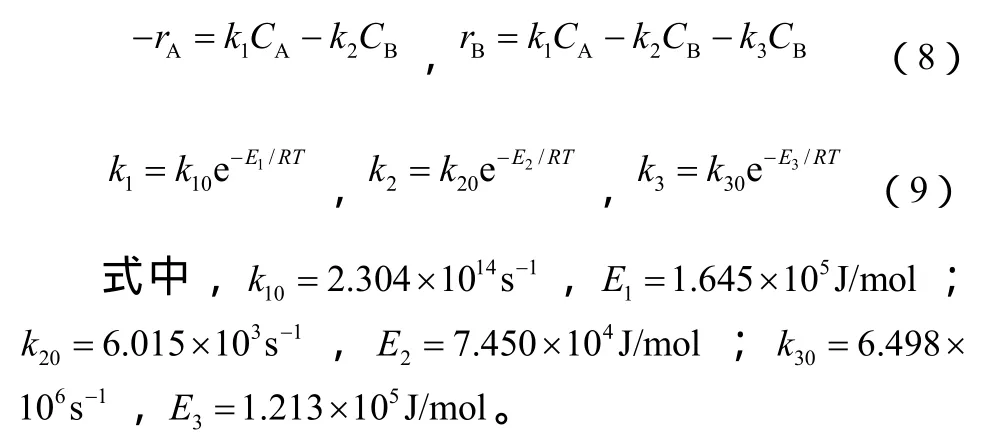
CPD与乙烯生成NB的反应为二级反应。杨春育等[13]研究了 CPD与乙烯在气相条件下进行环加成反应生成NB的动力学参数。反应在内循环式无梯度反应釜中进行,反应釜出口组成由气相色谱仪进行在线分析。实验测得在574 K时NB的生成速率常数为kNB=0.028 L/(s·mol),与DCPD分解速率常数相比可以忽略不计,因此在适当温度下,可认为 NB的合成反应是决速步骤。另外,当认为 NB的合成过程只与温度有关时,得到的反应速率表达式如式(10)。

Lee等[14]在半间歇釜(乙烯连续加入)中系统地研究了NB合成动力学,假设仅存在式(11)~式(13)3个反应,建立NB合成动力学模型,并结合实验数据拟合得到各动力学速率常数,结果见表1。
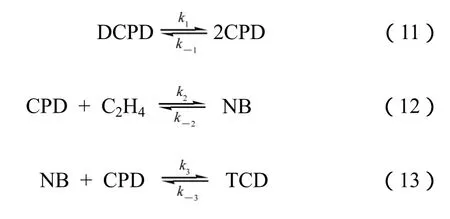
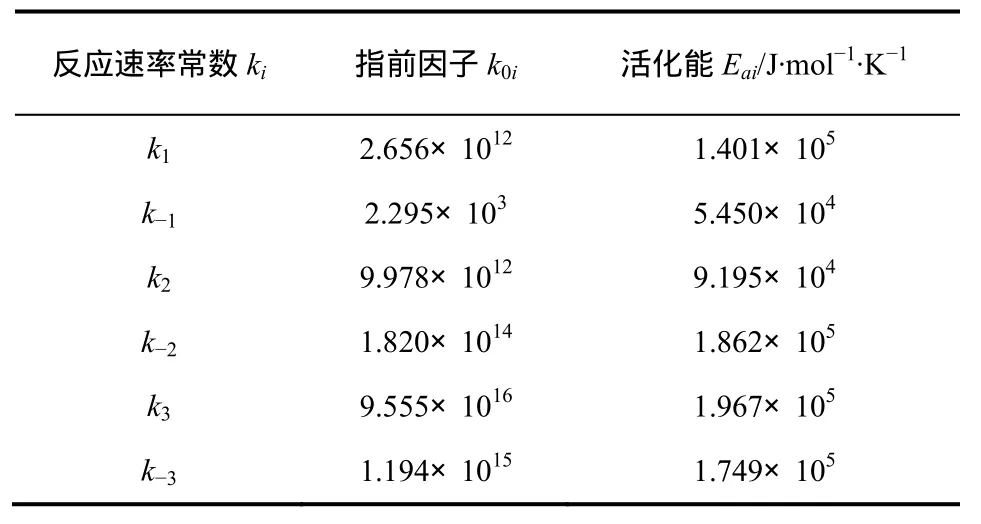
表1 动力学参数测定值
3 合成技术进展
根据操作条件下CPD或DCPD状态的不同,NB及其衍生物的生产工艺可分为液相反应工艺和气相反应工艺两种。液相反应工艺中,CPD或DCPD在反应过程中呈液态,乙烯气体溶于液相后进行加成反应;气相反应工艺则是先对CPD或DCPD进行加热,使之气化,与乙烯混合后进入反应器进行反应[15]。
3.1 液相反应工艺
Joshel[16]在美国专利中介绍了无溶剂液相条件下NB的间歇合成及其分馏提纯技术。在室温下将33 g新蒸馏的DCPD与200 mL(8.76 MPa)的乙烯加入密闭反应釜中,加热到200 ℃,压力升至36.54 MPa反应23 h,反应结束时压力降至31.72 MPa,釜中DCPD几乎完全转化为降冰片烯;蒸馏反应产物并收取 95~96 ℃的馏分。同年,美国环球油品公司(UOP)的Thomas[17]描述了DCPD与乙烯、丙烯、烯丙醇等一系列物质进行反应生成取代基不同的环烯烃。200 ℃左右、5~10 MPa或更高压力条件下在高压反应釜中间歇反应,确定了影响反应结果的3个影响因素:温度、压力和进料摩尔比。此后,Hill等[18]通过改变原料中CPD、DCPD比例来控制反应区的反应温度,反应在液相中进行,原料在130~220 ℃下预热后进料,反应温度为150~250 ℃,压力为3.45~68.95 MPa,乙烯以气态存在,反应时要将其溶解在液相中。以上均是无溶剂的液相反应工艺,缺点是副反应严重,容易产生多聚物或聚合物,造成反应器及有关设备的堵塞。
Lorette等[19]则提出在溶剂存在下进行反应的改良工艺,所用的溶剂是沸点高于100 ℃的惰性溶剂。将一定质量分数的DCDP溶液(溶剂为商业级二甲苯,分别含邻、间、对二甲苯17%、52%、9%以及22%的乙苯),用泵加入长0.99 m、外径3.175 cm并填有直径0.635 cm、孔隙体积340 cm3的派热克斯玻璃球的不锈钢反应器中,乙烯用压力钢瓶从反应器底部注入。加入反应器中的乙烯/DCPD摩尔比范围为(1∶0.5)~(10∶1),反应温度为200~325 ℃,压力为0.69~13.79 MPa,反应时间为0.2~5 h。该工艺DCPD的转化率可达97%以上,NB的选择性最高达89.8%。几年后,Schneider[20]采用卤代烃(特别是氯代烃)作为惰性溶剂,以抑制双环戊二烯树脂化。杜邦加拿大公司的Dokurno[21]还提出在合成过程中加入惰性脂肪族溶剂(正戊烷、正已烷、正庚烷、环已烷等以及它们的混合物)稀释DCDP,以抑制其树脂化、提高选择性,NB的收率可达99%。
晁建平等[22]尝试了在较低压力(0.71~1.73 MPa)下合成 NB,并通过正交实验对反应温度、乙烯初压、反应时间3个因素进行了优化,得出反应温度200 ℃、乙烯初压1.22 MPa、反应时间7 h为低压下合成降冰片烯的最佳条件,产率为32.9%。近年来,周崎[23]在半间歇高压反应釜中进行了 NB合成研究,反应釜中预投一定量的甲苯溶剂,加热至反应温度,通过加入乙烯使其达到预设压力,然后连续滴加DCPD甲苯溶液反应。随着反应的进行,当反应压力低于预设压力时,通过乙烯增压系统加入乙烯。从反应时间、压力和温度等方面对NB选择性、DCPD转化率进行了考察,确定了最终的优化条件:220 ℃、15 MPa、加料时间40 min、加完料后继续反应20 min。最优条件下NB选择性达到90%以上,DCPD转化率接近90%。将优化条件下反应得到的反应液在精馏塔上进行常压精馏,得到纯度为99.8%的NB产品,收率为91.2%。
有专利[9]披露了一种特别设计的 NB合成反应器及其相应的生产工艺。该反应器为一直立轴式圆筒形反应器,包括一种注入反应物的设备,其排列类似两根同心放置的管子。具有以下操作特点:①CPD在进入反应区前预热以使之部分分解为CPD,乙烯在进入反应区前使之处在反应区的温度和压力条件下;②乙烯以高压状态由反应器内部两个同心放置的管子之间的空间进入反应器,DCPD和CPD的混合物从反应器内部两个同心放置的管子内管进入反应器;③借助同心管顶部的喷嘴形状来增加乙烯的速度,使反应物达到良好混合从而分散DCPD,并在反应器顶部形成强混合区。
3.2 气相反应工艺
美国陶氏化学公司[24]早在 1973年就开发了一种通过加入过量烯烃来减少副产物的气相工艺法,确定了NB气相反应合成方法的雏形,具有选择性高、反应时间短等特点。在乙烯/CPD摩尔比为6、反应温度300 ℃、压力1.03 MPa、反应时间为8 min的条件下,转化率为74%,选择性可高达98%。
德国专利[25]披露了一种连续生产NB的方法,采用了在反应物和产物NB均处于气相的条件下进行DCPD和/或CPD与乙烯的反应。照此方法,使1 mol的DCPD与2~50 mol的乙烯混合,在250~340 ℃、2~20 MPa下进行反应,在反应压力及低于 190 ℃的温度下先将过量乙烯在反应区之前引入,穿过DCPD液体,接着在反应区进行反应得到NB,并将NB以气态形式从反应区顶部引出。德国专利[26]涉及一种连续生产NB的方法,其反应条件不仅可使反应物乙烯与 CPD均保持气相,也可使NB也处于气相。在249.85~339.85 ℃的温度和2~20 MPa的压力下使1 mol的CPD与1~25 mol的乙烯进行反应。其工艺包括混合与反应两个过程,混合温度159.85~199.85 ℃,停留时间10~30 min,混合区内形成的高沸点化合物从底部抽出;混合区之后的反应区内进行生成NB的反应,从反应区顶部抽出反应产物,并通过两段蒸馏区对产物加以分离提纯。
与液相反应工艺相比,气相反应工艺中物料混合得更加充分,极大地遏制了副反应的发生,选择性高。但由于气相反应工艺的反应物和产品均处于气相状态,摩尔体积大幅提高,受反应器体积和处理量的制约,气相工艺停留时间较液相工艺大大缩短,虽然反应温度要高出液相工艺100 ℃左右,其最终转化率仍相对偏低。由于气相工艺产量较低,目前实际生产中大多采用液相反应工艺。
4 结 语
NB制备工艺复杂,一直以来只有少数几个国家和老牌企业掌握其生产技术,价格昂贵,我国长期依赖进口。本文从反应机理的剖析入手,指出NB合成条件苛刻的原因在于乙烯活性不足,认为补偿乙烯活性的方法中提高反应压力是热力学和动力学上都有利的因素。由于NB合成过程中存在高温、高压及强放热反应等,为了保证生产工艺的安全稳定,对其动力学建模以预测不同条件下反应进行程度的相关研究就显得尤为重要。对现有的液相工艺和气相工艺进行了对比,认为改变反应温度和压力及控制反应场所(在气相或液相中发生反应)可以优化反应条件,而针对液相工艺混合效果差、气相工艺产量低等缺点,设计相应的特种结构反应器也是合成工艺优化的主要举措。
[1]Morgan M. C-5 hydrocarbons and derivatives:New opportunities[J].Chemistry & Industry,1996(17):645-648.
[2]Liu S J,Cao K,Yao Z,et al. Model development for semicontinuous production of ethylene and norbornene copolymers having uniform composition[J]. AIChE Journal,2009,55(3):663-674.
[3]姚臻,戴斌斌,刘少杰,等. 乙烯和降冰片烯加成共聚合催化体系[J]. 化学进展,2010(10):2024-2032.
[4]Joshel L M,Butz L W. The synthesis of condensed ring compounds.VII. The successful use of ethylene in the Diels-Alder reaction[J].Journal of The American Chemical Society,1941,63:3350-3351.
[5]Lenz T G,Vaughan J D. Employing force-field calculations to predict equilibrium-constants and other thermodynamic properties for the dimerization of 1,3-cyclopentadiene[J]. Journal of Physical Chemistry,1989,93(4):1592-1596.
[6]Staudinger H, Rheiner A. Über die konstitution des Dicyclopentadiens[J]. Helvetica Chimica Acta,1924,7(1):23-31.
[7]Smith J G. The Diels-Alder Reaction. Organic Chemistry[M]. 3rd ed.New York,NY:McGraw-Hill,2011:588-589.
[8]Ahmed M,Lavin M. Exothermic reactions of DCPD and protection against them[J]. Plant/Operations Progress,1991,10(3):143-154.
[9]埃勒夫阿托化学有限公司. 降冰片烯的生产方法及反应器:法国,1284052[P]. 2001-02-14.
[10]Wilson P J,Wells J H. The chemistry and utilization of cyclopentadiene[J]. Chemical Reviews,1944,34(1):1-50.
[11]Herndon W C,Grayson C R,Manion J M. Retro-Diels-Alder reactions .3. Kinetics of thermal decompositions of exo- and endo-dicyclopentadiene[J]. Journal of Organic Chemistry,1967,32(3):526.
[12]窦晓冬,袁向前,张濂. 双环戊二烯解聚制环戊二烯的工程开发研究[J]. 化学工业与工程技术,2000(6):7-9.
[13]杨春育,丁明,晁建平,等. 由环戊二烯合成降冰片烯的动力学[J].石油化工高等学校学报,1999(3):35-38.
[14]Lee S B,Cho S H,Park Y W,et al. Kinetics of norbornene synthesis and continuous reactor modeling study[C]//4th Asia-Pacific Chemical Reaction Engineering Symposium on New Opportunities of Chemical Reaction Engineering in Asia-Pacific Region,Gyeongju,South Korea,2006.
[15]陈亚,潘凡峰. 降冰片烯的合成技术[J]. 石油化工技术与经济,2009(2):42-45.
[16]Joshel L M. Manufacture of alicyclic compounds:US,2349232[P].1944-05-16.
[17]Thomas C L. Hydrocarbon synthesis:US,2340908[P]. 1944-02-08.
[18]Hill A B,Maisel D S,Wood D W. Manufacture of norbornylene:US,3007977[P]. 1961-11-07.
[19]Lorette N B,Jackson L. Preparation of norbornenes:US,3766283[P].1973-10-16.
[20]Schneider W. Process for the preparation of substituted norbornene derivatives:US,4168282[P]. 1979-09-18.
[21]Dokurno M G. Manufacture of norbornene:CA,1215399[P].1986-12-16.
[22]晁建平,焦玉梅. 降冰片烯的合成[J]. 石油化工高等学校学报:自然科学版,1995,8(3):9-10.
[23]周崎. 降冰片烯合成工艺的研究[J]. 石油化工技术与经济,2011(3):40-44.
[24]Wing M S,Mathews G W,Jackson L. Vapor phase preparation of norbornenes:US,3763253[P]. 1973-10-02.
[25]Deckert H,Ehrig R,Jauch R,et al. Kontinuierliches verfahren zur herstellung von norbornen:DD,140874[P]. 1980-04-02.
[26]Moll K,Steinbrecher M,Ramhold K,et al. Verfahren zur kontinuierlichen herstellung von reinem norbornen:DD,215078[P].1984-10-31.
