两种分析miRNA相对表达量方法的比较研究*
2013-10-11郑传浩第三军医大学新桥医院检验科重庆400037
郑传浩,姚 磊,李 毅(第三军医大学新桥医院检验科,重庆 400037)
相对定量法广泛应用于实时反转录-聚合酶链反应(RTPCR)中,然而PCR产物的准确定量需要可用于数据分析的数学模型,目前2(-ΔΔCT)方法已经常规运用于实时 RT-PCR的相对定量分析,但是它没考虑PCR过程中的各种影响因素[1-5]。本文介绍了一种简便、准确的基因表达相对定量实时RT-PCR的GenEx软件分析方法,现报道如下。
1 材料与方法
1.1 标本来源 HK-2细胞系(本实验室提供)、3例健康者和3例乙型肝炎患者血清(已向患者交代血清的用途,并征求了患者的同意)。
1.2 方 法
1.2.1 最优PCR退火温度的选择 以HK-2细胞cDNA为模板,利用锐博生物购买的miR-16的PCR引物,按照TaKaRa TaqTM(DR001A)试剂说明书配制反应体系,分别设定4个重复管,进行退火温度为62℃、59℃、55℃、53℃的PCR反应,各反应温度设定2个重复管。然后通过20g/L琼脂糖凝胶电泳评价最适退火温度。
1.2.2 实时荧光PCR采用SYBR premix Ex TaqTM(Tli RNaseH Plus)(Takara DRR420)试剂盒和相应miRNA引物(锐博生物提供)。20μL反应体系中含SYBR Green Mix 10 μL、cDNA 2μL、miRNA、Bulge-LoopTMmiRNA Forward Primer(锐博生物提供,62.5nmol/L)0.8μL 、Bulge-LoopTMmiRNA Reverse Primer(锐博生物提供,62.5nmol/L)0.8μL 、RNase-free H2O 6μL。在ABI StepOne仪器上按照如下顺序进行反应:95℃预变性2min,95℃变性10s,以得到的最优退火温度反应30s,循环40次。反应结束后立即行融解曲线分析,检测温度为70~95℃,升温速率为0.4℃/次,恒温时间为1分钟/次。
1.2.3 计算扩增效率 以10倍系列稀释的 HK-2细胞cDNA为模板,进行荧光定量PCR检测。由对数浓度值为横坐标,Ct值为纵坐标制作标准曲线。通过公式E=10(-1/s)分别计算出miR-16和miR-122的扩增效率。式中E代表扩增效率,S代表标准曲线的斜率。
1.2.4 RNA的提取 收集3例健康者和3例乙型肝炎患者血清各1mL,将其分为500μL的2管,然后按照Trizol LS(Invitrigen)说明书操作,提取血清总RNA。
1.2.5 cDNA的合成 在无核酸酶污染的EP管中加入RNA 2μL,逆转录引物(锐博生物提供)1μL,按 M-MLV(Promega)的说明书操作合成cDNA。
1.2.6 数据分析 实验分别采用GenEx软件分析和2(-ΔΔCT)计算两种方法来进行miRNA相对定量分析。GenEx软件可通过http://www.qpcrforum.com/下载,将内参基因和目的基因的扩增效率和测定得到的Ct值输入该软件中,按软件说明进行操作,然后得到表达比值及统计分析结果。2(-ΔΔCT)分析是按照文献[2]提供的公式进行相应的计算。
2 结 果
2.1 最优PCR退火温度的选择 以HK-2细胞cDNA为模板,分别以退火温度为62℃、59℃、55℃、53℃来进行PCR。20g/L琼脂糖凝胶电泳发现,退火温度为55℃时,PCR扩增后的产量最多,图1。

图1 HK-2细胞系cDNA PCR扩增产物电泳图。
2.2 扩增效率的计算 以10倍系列稀释的HK-2细胞cDNA为模板,进行荧光定量PCR检测。由对数浓度值为横坐标,Ct值为纵坐标制作标准曲线。由图2可知,miR-16的斜率为-3.449,miR-122的斜率为-3.304,通过公式 E=10(-1/s)可计算出 EmiR-16=0.97,EmiR-122=1.1。
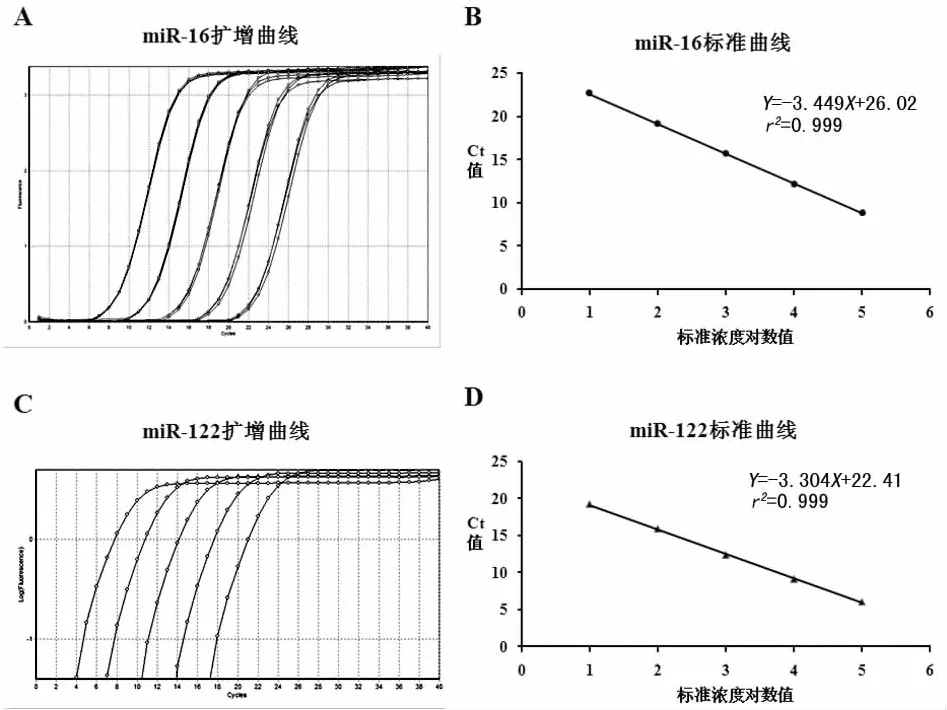
图2 HK-2细胞cDNA经过荧光定量PCR后所得的扩增曲线及根据所得的Ct值绘制标准曲线。
2.3 miR-122基因相对定量分析
2.3.1 GenEx软件相对定量分析 按照实验分组,将相应的Ct值(表1)导入GenEx软件中,进行数据的预处理。把miR-16和miR-122的扩增效率:0.97和1.1的输入软件,就可轻松地得到其校正后的Ct值,见表2。设定miR-16为参考基因,miR-122为目的基因,然后软件可自动计算重复测定同血清来源miRNA的均值,然后进行相对定量分析最终得到乙型肝炎患者血清中miR-122的表达量是健康者的54.06倍,两者比较差异有统计学意义(P<0.05)。

表1 健康者和乙型肝炎患者qPCR结果
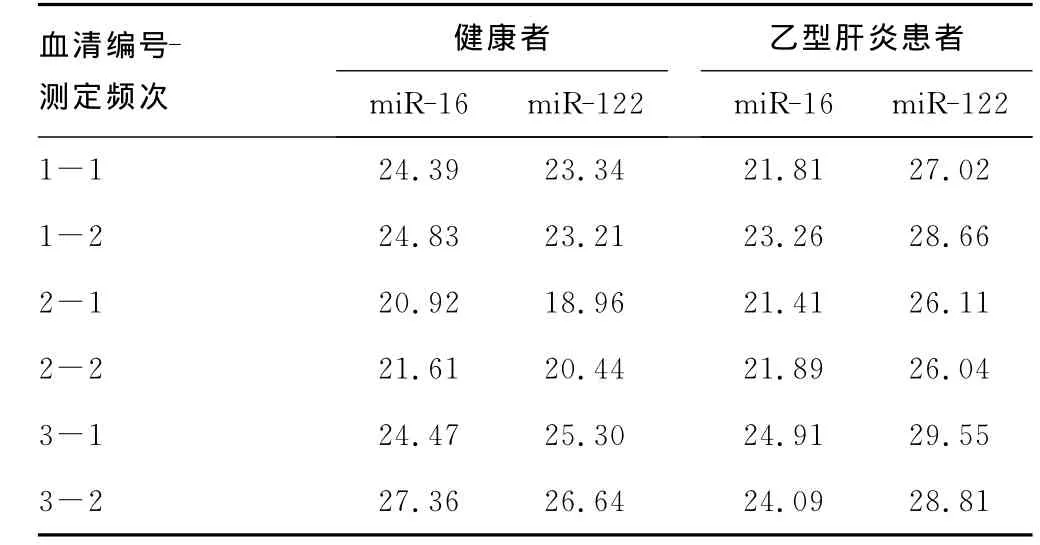
表2 健康者和乙型肝炎患者的E值校正后数据
2.3.2 2(-ΔΔCT)法数据分析 将表1的数据采用2(-ΔΔCT)法计算后,最终得到乙肝患者血清中miR-122的表达量是正常人群的44.30倍,两者比较差异有统计学意义(P<0.05)。
总结以上实验数据,分别采用2(-ΔΔCT)法及GenEx软件分析来进行相对定量分析,用2(-ΔΔCT)得出乙型肝炎患者血清中miR-122的表达量是健康者的44.30倍,而采用GenEx软件分析为54.06倍,可见采用 GenEx分析的比值较2(-ΔΔCT)高。
3 讨 论
采用的实时RT-PCR技术进行基因表达分析包括绝对定量及相对定量法。由于研究者多关注目的基因的表达变化,即实验组与对照组的基因表达比值的变化。相对定量已经成为基因表达分析最常用的手段。但是目前大多数相对定量的研究都用于mRNA的水平上,对于 miRNA的研究还很少[6-8],miRNA具有高度保守性、时序性和组织特异性,在逆转录的时候变异较小,本实验着重于miRNA的研究。用两种数据分析方法研究HBV患者血清相对于健康者血清中miR-122相对表达量的改变。

本文将2(-ΔΔCT)法与GenEx软件分析进行了比较,表明采用2(-ΔΔCT)法计算的表达比值比GenEx软件分析低10%,最好采用GenEx软件分析。
目前市场上销售的荧光定量PCR仪如Stratagene公司、Life Technology公司等多采用的2(-ΔΔCT)相对定量法。因其将PCR的扩增效率设定为1,但实际的扩增效率不可能达到1,因此该法计算出的相对定量结果通常不太精确[9]。GenEx软件是专门设计用于实时RT-PCR技术相对定量基因表达分析,其考虑了各方面的因素,因此相对于2(-ΔΔCT)的方法来说具有更高的精确度。总之,GenEx软件分析较2(-ΔΔCT)法更适用于相对定量的数据分析。
[1]Huang Y,Zou Q,Wang SP,et al.The discovery approaches and detection methods of microRNAs[J].Mol Biol Rep,2011,38(6):384125-384135.
[2]Braconi C,Henry JC,Kogure T,et al.The role of microRNAs in human liver cancers[J].Semin Oncol,2011,38(6):752-763.
[3]van Malenstein H,van Peh J,Verslype C.Molecular classification of hepatocellular carcinoma anno 2011[J].Eur JCancer,2011,47(12):1789-1797.
[4]时姗姗,王建东.miRNA在肿瘤分子病理学研究中的应用[J].临床与实验病理学杂志,2011,27(10):1111-1113.
[5]Mestdagh P,Van Vlierberghe P,De Weer A,et al.A novel and universal method for microRNA RT-qPCR data normalization[J].Genome Biol,2009,10(6):R64.
[6]Ye KP,Zhang QQ,Jiang Y,et al.Rapid detection of viable Listeria monocytogenes in chilled pork by real-time reverse-transcriptase PCR[J].Food Control,2012,25(1):117-124.
[7]McCabe EM,Burgess CM,Walsh D,et al.Development and evaluation of DNA and RNA real-time assays for food analysis using the hilA gene of Salmonella enterica subspecies enterica[J].Food Microbiology,2011,28(3):447-456.
[8]Miller ND,Davidson PM,D′Souza DH.Real-time reversetranscriptase PCR for Salmonella typhimurium detection from lettuce and tomatoes[J].LWT-Food Sci Technol,2011,44(4):1088-1097.
[9]张驰宇,徐顺高,黄新祥.一种新颖简便的荧光实时RTPCR相对定量方法的建立[J].生物化学与生物物理进展,2005,32(9):883-887.
