N-亚硝基新烟碱类化合物的合成
2013-10-09王涛涛康静静胡昊嵚杨福斌刘崇波温辉梁
王涛涛,康静静,胡昊嵚,杨福斌,刘崇波,温辉梁*
(1.南昌大学食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌航空大学环境与化学工程学院,江西 南昌 330063)
含氮杂环化合物因具有广泛的生物活性和药用价值而备受重视[1],已有许多品种作为除草剂、杀虫剂、植物生长调节剂和药物及医药中间体得到成功的开发和应用[2]。结构不同的含氮杂环化合物具有不同的生物活性,研究开发新结构类型的含氮杂环化合物己成为该类化合物的研究热点,特别是烟碱类化合物[3-4]。研究发现,新烟碱类化合物与许多人类重大疾病和病理生理现象如帕金森氏症、早老性痴呆和疼痛等的发病机制有密切关系[5],因此该类化合物已经成为新药开发的重要目标[6-7]。
目前,新烟碱的合成主要有Rouchaud等[8]用吡啶在LiAlH4的作用下反应得到,该方法不但反应时间长,反应机理复杂,副产物多,而且产率较低。目前较为简便合成新烟碱的方法是Williams等[9]以3-氨甲基吡啶和二苯甲酮亚胺为原料的路线,但该方法没有详尽的报道目标产物的产率。Deo等[10]人曾用3-氨甲基吡啶为原料合成新烟碱,以苯作为溶剂,不但毒性大而且产率仅为60%,Gärtner等[5]有过关于氘代 N-亚硝基新烟碱的合成报告,但没有详尽的给出反应条件和产率。为此,笔者以3-氨甲基吡啶和二苯甲酮为原料,选择甲苯做带水剂,对甲苯磺酸作催化剂,先合成N-二苯亚甲基-3-氨甲基吡啶,再合成新烟碱,以新烟碱为先导,合成了假木贼碱和N-亚硝基新烟碱,以假木贼碱合成了N-亚硝基假木贼碱。通过1H NMR,MS等方法对其结构进行了证实。探索了N-二苯亚甲基-3-氨甲基吡啶和N-亚硝基新烟碱的合成条件。
1 实验部分
1.1 试剂与仪器
3-氨甲基吡啶、二苯甲酮,AR,阿拉丁试剂上海有限公司;顺式-1,4-二氯-2-丁烯、甲苯、碳酸钾、氢氧化钠、对甲苯磺酸、盐酸、冰乙酸、三氯化铝、甲醇、二氯甲烷、三氯甲烷、乙酸乙酯、石油醚、亚硝酸钠,AR,国药集团化学试剂有限公司;二异丙基氨基锂(LDA:2mol/L in THF),阿拉丁试剂上海有限公司。
Bruker 400Ultrashield型核磁共振仪,Bruker公司;Agilent 6410三重串联四级杆-飞行时间串联质谱仪,美国Agilent公司。
1.2 合成路线与方法
以3-氨甲基吡啶和二苯甲酮为原料,甲苯作带水剂,对甲苯磺酸作催化剂,合成N-二苯亚甲基-3-氨甲基吡啶、新烟碱、假木贼碱、N-亚硝基新烟碱和N-亚硝基假木贼碱的路线见图1。
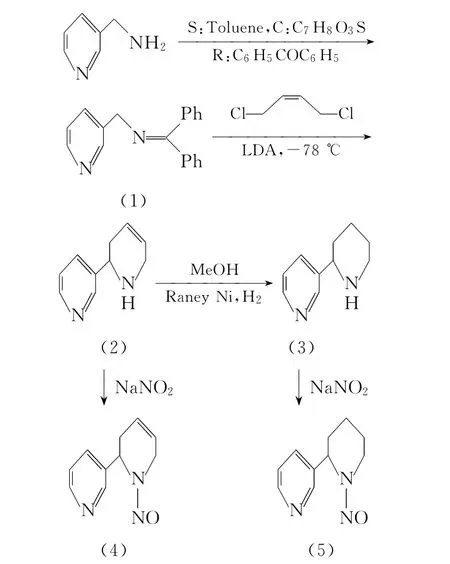
图1 N-亚硝基新烟碱合成路线
1.2.1 N-二苯亚甲基-3-氨甲基吡啶(化合物1)的合成
取3-氨甲基吡啶0.108g(1mmol)溶解于5 mL甲苯中,在搅拌情况下加入0.228g(1.25 mmol)二苯甲酮使其完全溶解,再加入0.015g对甲苯磺酸,在反应装置上接上分水器,回流分水反应3h(TLC跟踪反应),原料反应完全后,将溶剂旋干,粗品硅胶柱层析纯化[V(乙酸乙酯)∶V(石油醚)=1∶5]得到0.235g白色晶体,收率86.4%,m.p.:264~267℃,MS(TOF)m/z:273.1844[M+H]+。
1.2.2 新烟碱(化合物2)的合成
氩气保护下,将0.544g(2.0mmol)化合物1溶解在5mL干燥的四氢呋喃中,体系冷却到-78℃。在此温度下滴加2.2mL(2.2mmol)LDA,反应0.5h。然后反应体系自然升温至-45℃,此温度下滴加顺式-1,4-二氯-2-丁烯0.38 g(3.0mmol),加完后搅拌状态下体系自然升温至室温,室温搅拌反应3.0h时原料反应完全(TLC跟踪检测),用10mL 10%的盐酸淬灭反应,乙醚萃取除去杂质,水相用20%NaOH溶液调pH=12,再用三氯甲烷萃取(3×5mL),合并有机相,旋干,粗品硅胶柱层析纯化[V(甲醇)∶V(二氯甲烷)=1∶8],得到0.273g棕黄色油状液体,收率85.5%。
1.2.3 假木贼碱(化合物3)的合成
取新烟碱(0.160g,1mmol),用5mL甲醇溶解,加入0.1g的Raney Ni,充入 H2,回流搅拌,(TLC跟踪反应)2.0h时原料反应完全,滤去固体杂质,旋干溶剂,硅胶柱层析[V(甲醇)∶V(二氯甲烷)=1∶9],得到目标产物纯品0.14g,收率87.5%。
1.2.4 N-亚硝基新烟碱(化合物4)的合成
取新烟碱0.160g(1.0mmol)溶解于5mL 4 mol/L的盐酸中,然后冰水浴下搅拌10min,使新烟碱充分溶解。取亚硝酸钠0.138g(2.0 mmol)溶解在2mL的冰水中,然后在搅拌情况下将亚硝酸钠溶液加入到反应体系中。0℃当反应6.0h时原料反应彻底(TLC跟踪反应),然后用5mol/L NaOH水溶液调pH=12,然后用三氯甲烷萃取(5mL×3),合并有机相,无水硫酸钠除水后过滤旋干得粗品,硅胶柱层析纯化[V(甲醇)∶V(二氯甲烷)=1∶20],得0.15g黄色油状产物,收率率81.0%。
1.2.5 N-亚硝基假木贼碱(化合物5)的合成
以合成N-亚硝基新烟碱类似的方法以假木贼碱合成N-亚硝基假木贼碱,收率80.1%。
2 结果与讨论
2.1 产物结构的确证
产物(2),(3),(4)和(5)的 MS,1H NMR数据列于表1中。从表1可以看出:各化合物的1H NMR谱中H的数量和化学位移与产物结构中的H相对应,MS数据也在合理误差范围内,所合成的化合物是目标产物。
2.2 合成N-二苯亚甲基-3-氨甲基吡啶(化合物1)的影响因素
N-二苯亚甲基-3-氨甲基吡啶的合成是实验中很重要的一步,目前仅有用甲醇做溶剂,盐酸做催化剂合成的报道,但是产率很低。实验中选用甲苯做溶剂,回流分水反应,考察了催化剂的种类、3-氨甲基吡啶和二苯甲酮的摩尔比以及反应时间对该步反应产率的影响。
2.2.1 催化剂
固定反应时间为4.0h,甲苯做溶剂,n(3-氨甲基吡啶)∶n(二苯甲酮)=1∶1.5,回流分水进行反应,考察了选用浓盐酸、三氯化铝、冰乙酸和对甲苯磺酸对产率的影响,结果见表2。由表2可知:选用对甲苯磺酸最催化剂时,收率最高。
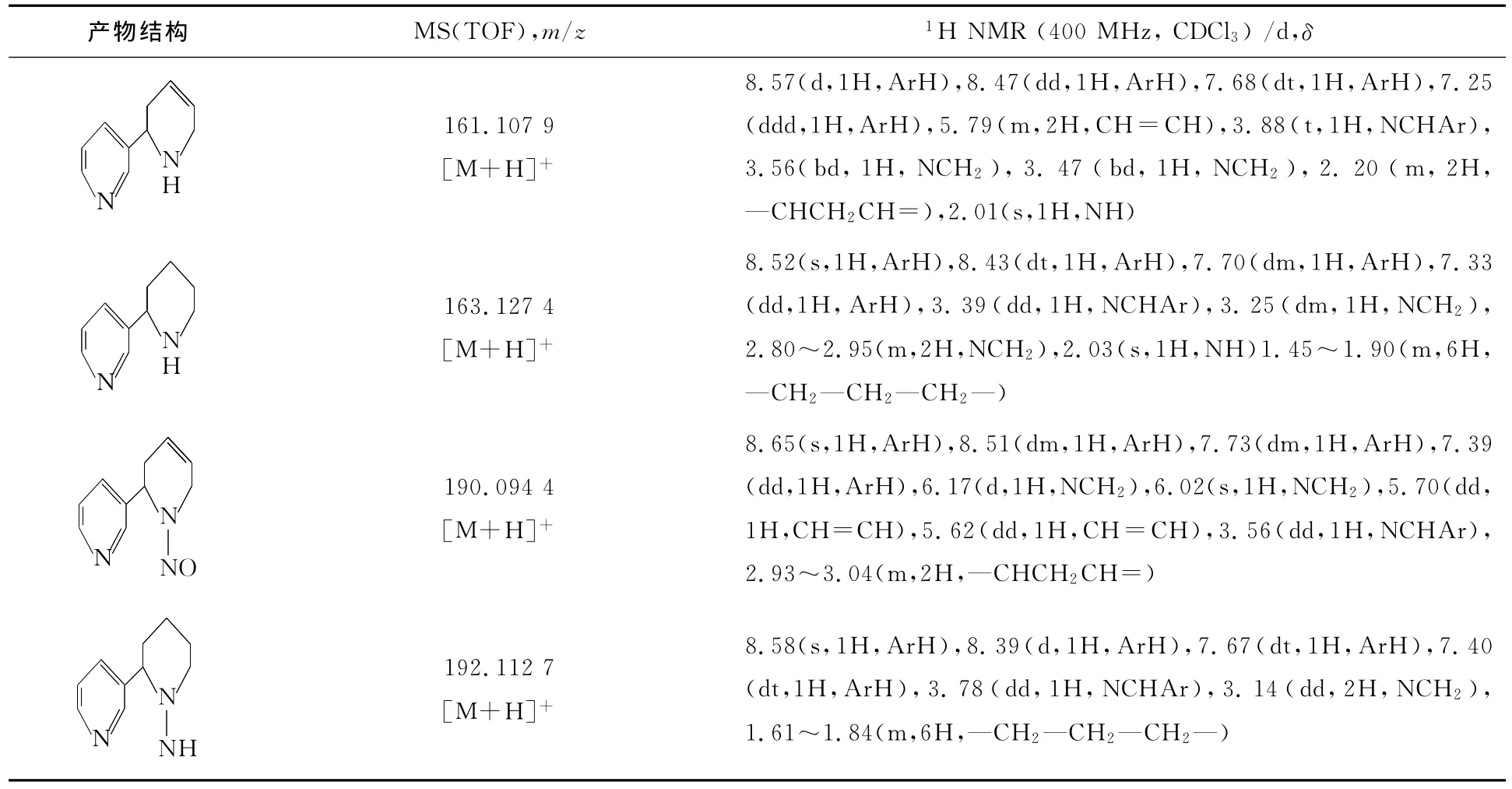
表1 合成化合物的MS和1 H NMR数据

表2 催化剂对产率的影响
2.2.2 原料摩尔比
固定反应时间为4.0h,甲苯做溶剂,对甲苯磺酸为催化剂,回流分水进行反应,考察3-氨甲基吡啶和二苯甲酮摩尔比对产率的影响,其结果见表3。由表3可知,当n(3-氨甲基吡啶)∶n(二苯甲酮)=1∶1.25时,收率最高可达81.5%。

表3 原料摩尔比对产率的影响
2.2.3 反应时间
以甲苯作溶剂,对甲苯磺酸作催化剂,n(3-氨甲基吡啶)∶n(二苯甲酮)=1∶1.25,回流分水反应,考察了反应时间对产率的影响,结果见表4。由表4可知:当反应时间为3.0h时,N-二苯亚甲基-3-氨甲基吡啶的收率最高可达82.5%。
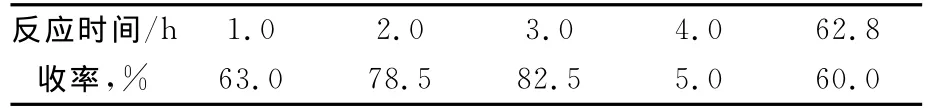
表4 反应时间对产率的影响
综上所述,以甲苯作溶剂,对甲苯磺酸作催化剂,n(3-氨甲基吡啶)n(二苯甲酮)=1∶1.25,回流分水反应3.0h时,N-二苯亚甲基-3-氨甲基吡啶的收率最高,达82.5%。
2.3 新烟碱及假木贼碱的合成
由于新烟碱的合成条件比较苛刻,需在-78℃下进行反应,实验中采用液氮和石油醚的混合体系达到要求,考虑到LDA用量会对新烟碱产率有很大的影响。考察LDA对新烟碱产率的影响,结果见表5。由表5可知:当n(化合物1)∶n(LDA)∶n(顺式-1,4-二氯-2-丁烯)=1∶1.1∶1.5时,新烟碱的收率最高,可达85.5%。

表5 LDA比例对产率的影响
2.4 合成N-亚硝基新烟碱的影响因素
N-亚硝基新烟碱和N-亚硝基假木贼碱的合成比较相似,实验中考察了温度和时间对N-亚硝基新烟碱收率的影响,不对N-亚硝基假木贼碱的合成条件进行讨论。
2.4.1 反应温度
控制反应时间为2.0h,n(新烟碱)∶n(亚硝酸钠)=1∶2,考察反应温度对N-亚硝基新烟碱收率的影响,结果见表6。

表6 反应温度对N-亚硝基新烟碱合成的影响
由表6可知:产率随着温度的升高而降低,经分析,产生的原因主要是亚硝酸根离子在酸性条件下以亚硝酸的形式存在,温度升高时亚硝酸会分解成NO和NO2,因此低温时有利于反应的正向进行。
2.4.2 反应时间
控制温度为0℃,n(新烟碱)∶n(亚硝酸钠)=1∶2,考察了反应时间对收率的影响,结果见表7。由表7可知:当反应时间为6.0h时,产率最高为81.0%

表7 反应时间对N-亚硝基新烟碱合成的影响
综上可得:当n(新烟碱)∶n(亚硝酸钠)=1∶2、反应温度为0℃、反应时间为6.0h时,N-亚硝基新烟碱的收率最高。
3 结 论
以3-氨甲基吡啶和二苯甲酮为原料,在n(3-氨甲基吡啶)∶n(二苯甲酮)=1∶1.25、选择甲苯作溶剂、对甲苯磺酸作催化剂、回流反应3h的条件下,N-二苯亚甲基-3-氨甲基吡啶的收率最高,达到86.4%;当n(化合物1)∶n(LDA)∶n(顺式-1,4-二氯-2-丁烯)=1∶1.1∶1.5时,新烟碱的产率最高,可达85.5%;在n(新烟碱)∶n(亚硝酸钠)=1∶2、反应温度为0℃、反应时间为6.0 h的条件下,N-亚硝基新烟碱的收率最高,达81.0%。新烟碱及其衍生物的合成,不仅为研究这类化合物的生物活性提供了基础,而且为合成其它新烟碱类化合物特别是亚硝胺类化合物提供了理论和实验依据。
[1]唐振华.新烟碱类杀虫剂的结构与活性及药效集团[J].现代农药,2002,1(1):1-6.
[2]贾俊超,苑建勋,范志金.新烟碱类杀虫剂选择作用的分子机理[J].农药,2007,46(4):227-230.
[3]左天觉.烟草的生产、生理和生物化学[M].上海:远东出版社.1993.
[4]翟波译.烟碱类有关化合物的构效关系[J].农药译丛,1995,17(4):10-18.
[5]Gärtner P,Bica K ,Einzinger C.Synthesis of Partially Deuterated N-Nitrosamines-New Standards in Tobaccosmoke Analysis[J].Monatshefte für Chemie,2004,135:549-555.
[6]Desai D,Lin G,Morimoto H,et al.Synthesis of(±)-[5-3 H]-N′-nitrosoanatabine,a tobacco-specific nitrosamine[J].Journal of Labelled Compounds & Radiopharmaceuticals,2002,45(13):1133-1141.
[7]师华,陆峰,熊家锦,等.芳胺的 N-烷基化反应[J].精细化工中间体.2008,38(6):8-11.
[8]Rouchaud A,Kem W R.A convenient racemic synthesis of two isomeric tetrahydropyridyl alkaloids:Isoanatabine and anatabine[J].Journal of Heterocyclic Chemistry,2010,47(3):569-581.
[9]Williams J R,Wright C.Nutraceutical product containing anatabine and Yerba maté:US,2012/0003341A1[P].2012-01-05.
[10]Deo N M,Crooks P A.Regioselective alkylation of N-(diphenylmethylidine)-3-(aminomethyl)pyridine:a simple route to minor tobacco alkaloids and related compounds[J].Tetrahedron Letters,1996,37(8):1137-1140.
