布鲁氏菌omp28基因的克隆、表达及重组蛋白的反应原性分析
2013-10-09王秀丽蒋玉文毛开荣丁家波程君生
王秀丽,蒋玉文,毛开荣,丁家波,程君生,王 楠
(中国兽医药品监察所,北京 100081)
随着分子生物学和免疫学技术的不断发展,目前报道的布鲁氏菌外膜蛋白有7种,免疫印迹从羊种布鲁氏菌中发现外膜蛋白28(OMP28)是用于诊断的重要抗原。在印度也有不同的实验室用OMP28-ELISA检测布鲁氏菌的抗体,且效果良好[1-3]。将OMP28蛋白的核酸序列在 GenBank中BLAST搜索,发现有21个布鲁氏菌株含有与羊种布鲁氏菌16M株的omp28序列同源性为100%的序列,11株同源性为99%,且细微的差别对蛋白的生物活性不造成影响,证明omp28在布鲁氏菌中是非常保守的序列,所以对omp28基因的克隆与表达对于新的布鲁氏菌抗体检测方法的研究有十分重要的意义。
1 材料与方法
1.1 菌株及试剂 羊种布鲁氏菌16M株、羊种布鲁氏菌M28株、犬种布鲁氏菌、绵羊附睾种布鲁氏菌、牛种布鲁氏菌A19株、猪种布鲁氏菌S2株由中国兽医药品监察所保存;羊布鲁氏菌病阳性血清由哈尔滨兽医研究所提供,感受态细胞BL21、DH5α由天根生化科技有限公司提供;pET32a载体由本实验室保存,rTaq酶、Eco RⅠ内切酶、XhoⅠ内切酶、simple pMD18-T载体由大连宝生物(TaKaRa)公司提供。
1.2 方法
1.2.1 目的基因的扩增 用DNA快速提取试剂盒提取羊种布鲁氏菌16M株、羊种布鲁氏菌M28株、犬种布鲁氏菌、绵羊附睾种布鲁氏菌、牛种布鲁氏菌A19株、猪种布鲁氏菌S2株的基因组,参考GenBank公布的布鲁氏菌16M株的omp28基因序列,用Mega4.0分析软件对omp28基因进行序列分析,设计上游引物Fomp28和下游引物Romp28,在上游和下游引物上分别添加Eco RⅠ和XhoⅠ 酶切位点。并将omp28基因的终止子TAA去掉,并添加一个碱基A使其在载体中正确表达。引物序列如下:Fomp28,CGGAATTCATGAACACTCGTGCTAG,(划线部分为 Eco RⅠ的酶切位点),Romp28,CGGCTCGAGACTTGATTTCAAAAAC(划线部分为XhoⅠ的酶切位点),以Fomp28、Romp28为引物,按94℃ 10 min,94 ℃ 30 s,56 ℃ 30 s,72 ℃2 min(30 个循环),72℃ 10 min的程序扩增目的片段。用1%的琼脂糖凝胶电泳验证PCR扩增的结果,用琼脂糖凝胶DNA玻璃奶纯化回收试剂盒回收目的片段。
1.2.2 omp28基因的克隆、核酸序列/氨基酸序列比对及亲水性分析 估算T载体与目的片段之间的摩尔比,控制在1∶3~1∶8之间,将扩增的不同种布鲁氏菌omp28基因分别与T载体连接,筛选阳性克隆,送上海生工生物技术有限公司测序。将不同种布鲁氏菌omp28基因的测序结果以及基因编码的氨基酸序列用Mega4.0分析并进行序列比对。分别对omp28基因编码蛋白的氨基酸序列进行亲水性分析。
将羊种布鲁氏菌16M株的omp28基因序列在GenBank中BLAST,搜索与omp28基因核苷酸序列相似性较高的基因。
1.2.3 pET32a-omp28表达载体的构建及鉴定
将羊种布鲁氏菌16M株的omp28基因的T载体克隆和pET32a载体同时用Eco RⅠ和XhoⅠ双酶切,回收酶切产物,将omp28基因亚克隆到pET32a表达载体中,筛选阳性克隆,经PCR鉴定和酶切鉴定正确后送上海生工生物技术有限公司测序,阳性克隆命名为pET32a-omp28。
1.2.4 重组菌的诱导表达及表达产物的鉴定 取鉴定为阳性的重组质粒以及pET32a空质粒分别转化到BL21宿主细胞中,挑取pET32a-omp28重组菌单菌落接种于100 mL含100μg/mL Amp的 LB液体培养基中,在37℃以200 r/min的速度振荡培养5 h。加入IPTG至终浓度为1 mmol/L,分别在37℃和28℃ 200 r/min诱导表达6 h。挑取pET32a空质粒重组菌单菌落在37℃同上振荡培养5 h后加入终浓度为1 mmol/L的IPTG继续诱导表达6 h,作为对照。
将诱导后菌液45 mL以10000 r/min离心,将沉淀重悬于15 mL PBS中,超声波裂解菌体,裂解条件为工作5 s,间歇5 s,20个循环。处理后再次离心。沉淀再次用30 mL pH 7.4的PBS重悬,分别取菌液离心后上清、经超声波处理后上清、超声波处理后沉淀200μL,加入50μL 5×loading buffer混匀后煮沸10 min,各取10μL上清液与标准分子量蛋白Maker上样,恒压120 V,SDS-PAGE至溴酚蓝电泳至凝胶底部。取下凝胶用30 mL考马斯亮蓝染色液染色30 min,加50 mL脱色液在脱色摇床上脱色三遍,1 h/次,至条带清晰,观察结果,分析表达形式。
1.2.5 重组蛋白的 Western-blot分析 SDSPAGE结束后,通过Bio-Rad电转仪将蛋白条带转移至PVDF膜上。120 mA恒流,低温转印1.5 h。转印完毕,用TBST漂洗后,置于5%的脱脂奶粉中,于4℃冰箱过夜封闭。然后TBST洗三次,每次5 min。将膜置于1∶50倍稀释的羊布鲁氏菌阳性血清中,37℃摇床低速结合1 h。TBST洗三次,每次5 min。再将膜置于1∶20000倍稀释的HRP标记的兔抗羊IgG抗体中,作用1 h。TBST洗三次,每次5 min。最后用OPD底物缓冲系统显色并观察结果。
2 结果
2.1 不同种布鲁氏菌omp28基因扩增结果 以羊种布鲁氏菌16M株、羊种布鲁氏菌M28株、犬种布鲁氏菌、绵羊附睾种布鲁氏菌、牛种布鲁氏菌A19株、猪种布鲁氏菌S2株的基因组为模板,以Fomp28、Romp28为引物扩增出大小为751 bp的omp28基因片段,与预期结果相符(图1)。
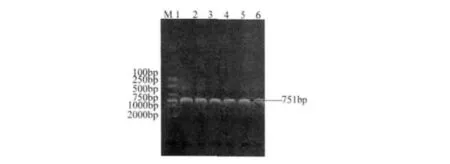
图1 不同种布鲁氏菌omp28基因扩增结果
2.2 不同种布鲁氏菌omp28基因的克隆、序列比对及亲水性分析 将羊种布鲁氏菌16M株、羊种布鲁氏菌M28株、犬种布鲁氏菌、绵羊附睾种布鲁氏菌、牛种布鲁氏菌A19株、猪种布鲁氏菌S2株的omp28基因的T载体克隆为模板,以Fomp28和Romp28为引物,分别进行PCR扩增,经1%琼脂糖凝胶电泳,结果显示,PCR可以扩增出与预期大小(751 bp)一致的条带,初步证明克隆的质粒是正确的(图2)。
用Mega 4.0对不同种布鲁氏菌的omp28基因测序结果及基因编码蛋白氨基酸的序列进行比对,结果显示,omp28基因的核苷酸序列在不同种布鲁氏菌中总共有6个位点存在差异,但编码的蛋白质仅有2个氨基酸发生变化。序列之间碱基的差异以及对编码氨基酸的影响见表1。不同种布鲁氏菌OMP28亲水性分析结果显示,OMP28的亲水性区域主要集中在1~130个氨基酸形成的多肽段,个别氨基酸的变化对整个蛋白亲水性影响不大,而蛋白的抗原决定位点主要集中在亲水区域,因此推断,该两个氨基酸的变化对OMP28蛋白的抗原性无影响。
将羊种布鲁氏菌16M-omp28基因在GenBank中BLAST,搜索结果显示,不同种布鲁氏菌及疫苗株omp28基因的相似性在99%以上,而在沙门氏菌、大肠杆菌O∶157、小肠结肠炎耶尔森菌O∶9中不存在。

表1 不同种布鲁氏菌omp28基因序列差异及对氨基酸的影响
2.3 重组表达载体pET32a-omp28的构建及鉴定
以重组质粒pET32a-omp28为模板,Fomp28、Romp28为引物PCR扩增,能扩增出与预期大小相符合的核酸条带(图3)。用Eco RⅠ和XhoⅠ对重组质粒进行双酶切,切下的小片段与预期大小一致,与PCR方法扩增的片段大小一致,结果见图4。
将重组的pET32a-omp28质粒送上海生工测序,测序结果与GenBank中的序列比对,发现与公布的16M株omp28基因的相似性为100%,核酸序列、编码氨基酸序列也与公布的完全一致,说明插入载体的序列完全正确且不存在移码或核苷酸的缺失等现象。
2.4 重组菌的诱导表达及表达产物的鉴定 将37℃和28℃诱导的菌体分别经超声波处理后,将菌液离心后的上清、超声波处理后的上清、超声处理后的沉淀经SDS-PAGE分析,结果显示37℃诱导的重组蛋白主要在超声波处理后的沉淀中,说明主要是以包涵体的形式存在,而28℃诱导表达的菌体重组蛋白主要在超声波处理后的上清中,说明重组蛋白主要是以可溶性的胞浆蛋白的形式存在(图5)。
2.5 重组蛋白的反应原性分析 Western-blot分析结果表明,pET32a-OMP28重组蛋白无论是以包涵体形式存在还是以可溶性形式存在,都能与布鲁氏菌的阳性血清发生反应,说明该蛋白的反应原性良好,结果见图6。
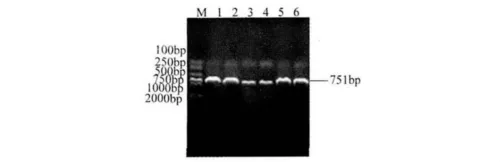
图2 不同种布鲁氏菌omp28基因PCR鉴定结果
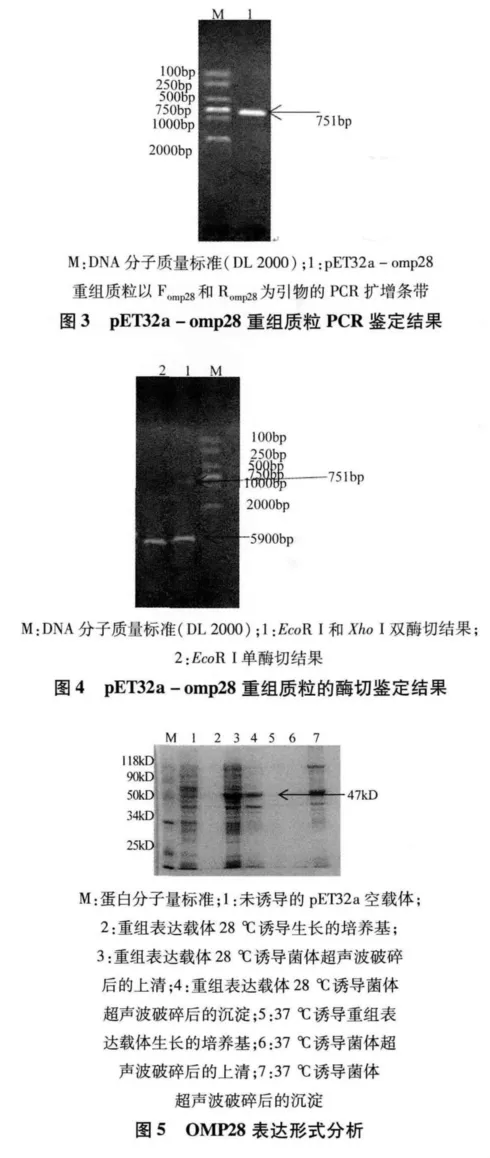
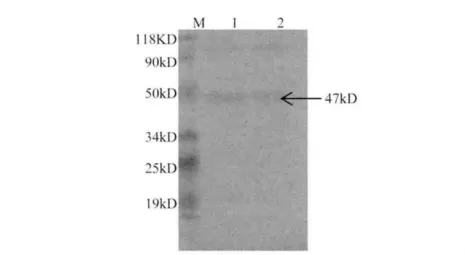
图6 OM P28蛋白W estern-blot反应原性分析
3 讨论
关于布鲁氏菌的蛋白能否用于布鲁氏菌病的诊断,国内外进行了大量的研究。不同株布鲁氏菌的外膜蛋白在20世纪80年代首次被鉴定具有免疫原性和抗原保护力[4]。布鲁氏菌的 OMP10、OMP25、OMP31、BCSP等蛋白也都曾经有人用原核表达系统或真核表达系统表达及对重组蛋白的抗原性进行研究,且证明以上蛋白都有不同程度的反应原性[5-8]。
文献报道用重组布鲁氏菌OMP28蛋白作抗原检测布鲁氏菌病 IgG抗体效果良好[1-3]。基因序列分析和蛋白亲水性分析预测,个别氨基酸的差异不会影响OMP28蛋白的抗原性;在GenBank中搜索omp28基因的相似序列,结果显示不同种布鲁氏菌omp28基因的相似性大于99%,且仅存在布鲁氏菌中。因此本研究仅构建了具有代表性的羊种布鲁氏菌16M-omp28的重组表达载体,分析OMP28蛋白的反应原性。Western-blot结果表明本研究所获得的重组OMP28反应原性良好,可以作为抗原检测布鲁氏菌病IgG抗体,解决脂多糖(LPS)作为抗原无法检测粗糙型布鲁氏菌感染的问题。
布鲁氏菌pET32a-OMP28重组蛋白在37℃诱导表达时由于蛋白表达速度过快,来不及折叠即以包涵体的形式沉淀,而通过28℃低温诱导,该蛋白主要以可溶性形式表达。选择28℃低温诱导表达OMP28蛋白不仅有利于OMP28蛋白更好的恢复天然结构,提高抗原的反应原性,而且便于蛋白的纯化。
在GenBank中搜索布鲁氏菌omp28基因的同源序列结果显示,omp28基因在与布鲁氏菌存在血清学交叉反应的小肠结肠炎耶尔森菌O∶9、都柏林沙门氏菌、大肠杆菌 O∶157中不存在,因此,用OMP28蛋白作抗原检测布鲁氏菌病,可以有效解决布鲁氏菌病与小肠结肠炎耶尔森菌等血清学诊断中的交叉反应,显示其有良好的应用前景。
[1] Michel S Zymunt,Sylvie B aucheron,Niees Vizcino,et al.Sigle Step Purification and Evaluation of Recombinant BP26 Protein for Serological Diagnosisof Brucella ovis Infection in Rams[J].Veterinary Microbiology,2002,87:213 -220.
[2] Pallab Chaudhuri,Rajeev Prasad,Vinth Kumar,et al.Recombinant OMP28 Antigen-based Indirect ELISA for Serodiagnosis of Bovine Brucellosis[J].Molecular and Cellular Prubes,2010,24:142-145.
[3] Gupta V K,Ranjeeta Kumari,Jyoti Vohra,et al.Comparative Evaluation of Recombinant BP26 Protein for Serological Diagnosis of Brucella melitensis Infection in Goats[J].Small Ruminant Resarch,2010,93:119 -125.
[4] Cloeckaert A,Vizanio N,Paquet J Y.Major Outer Membrane Protein of Brucella spp.Past,Present and Future[J].Veterinary Microbiology,2002,90:229 -248.
[5] 陈伟业,王淑杰,王 永.重组布鲁氏菌BP26蛋白和OMP31蛋白作为间接ELISA诊断抗原的研究[J].中国人兽共患病学报,2006,22(6):518 -521.
[6] 杨春华,邱昌庆,曹小安.流产布鲁氏菌omp28基因的克隆与原核表达[J].中国兽医科学,2007,37(6):465 -468.
[7] 宫晓为,景 涛,王国治.布鲁氏菌BP26蛋白的表达纯化及抗原性的研究[J].中国人兽共患病学报,2009,25(11):1085-1088.
[8] Duraipandian Thavaselvan,Ashu Kumar,Sapana Tiwari,et al.Cloning and Expression of Immunoreactive Brucella melitensis 28 kDa Outer-membrane Protein(OMP28)Encoding Gene and Evaluation of the Potential of OMP28 for Clinical Diagnosis of Brucellosis[J].Med Microbiol,2010,59:421.
