脂蛋白相关磷脂酶A2酶活性水平及其I198T基因多态性与2型糖尿病的相关性研究
2013-10-09岳志红李珊珊
岳志红,贾 玫,李珊珊
(北京大学人民医院 检验科,北京100044)
2型糖尿病在中国是一项重大的公共卫生问题,最近报道在我国糖尿病的发病率已经增加到9.7%,已经远远超过了预计2025年中国糖尿病发病率将增加到8%[1]的推论。糖尿病慢性血管并发症是患者死亡及致残的首要原因,糖尿病加速动脉粥样硬化发生发展是引起血管并发症的重要机制。脂蛋白相关磷脂酶 A2(lipoprotein-associated phospholipase A2,Lp-PLA2)是新近发展的炎症反应因子,是动脉粥样硬化发生的独立危险因子[2-4],在动脉粥样硬化的发生发展的各个阶段发挥着重要作用[5]。但是,目前,对Lp-PLA2酶活性及其基因多态性与2型糖尿病发生发展的关系研究甚少。因此,本实验收集了117例2型糖尿病患者和203例健康对照者,探讨Lp-PLA2的酶活性水平及其I198T点突变与2型糖尿病患者动脉粥样硬化发生的遗传机制。
1 对象与方法
1.1 对象
1.1.1 2型糖尿病组:收集2009年10月至2010年5月,北京大学人民医院糖尿病住院患者117例,均符合1999年世界卫生组织(WHO)诊断标准,且排除:(1)1型糖尿病、继发性糖尿病及近期发生过糖尿病并发症患者;(2)严重肝、肾功能不全患者;(3)心力衰竭及风湿瓣膜性心脏病患者;(4)感染性疾病及肿瘤患者;(5)免疫性及血液性疾病患者。根据是否服用降脂药分为两组:T2DM1为服用降脂药组;T2DM2为未服用降脂药组。
1.2.2 健康对照组:收集2011年3月至2011年5月,北京某单位职工体检者203名,均无2型糖尿病病史,且均无内科系统器质性病变。
1.2 方法
1.2.1 血液生化指标的测定 超敏C反应蛋白(High sensitivity C-reactive protein,Hs-CRP)、脂蛋白a(lipoprotein a,Lp(a))、胆固醇(Cholesterol,CHO)、甘油三酯 (Triglyceride,TG)、空腹血糖(Glucose,GLU)、高密度脂蛋白胆固醇(High-density lipoprotein cholesterol,HDL)、低密度脂蛋白胆固醇(Low-density lipoprotein cholesterol,LDL)测定使用日立7600全自动生化分析仪;试剂、校准品及质控品均由日本和光公司提供。
1.2.2 血清Lp-PLA2活性水平的检测 采用美国Cayman公司提供的PAF-AH活性测定试剂盒,使用BioTek Elx808全自动酶标仪,测定血浆中Lp-PLA2活性水平。
1.2.3 人全血标本基因组DNA的提取 采用日本东洋纺(TOYOBO)磁珠法(编号 NPK-101)DNA提取试剂盒,用乙二胺四乙酸二钾抗凝新鲜全血标本,严格按试剂盒要求进行操作,提取基因组DNA标本-80℃保存备用。
1.2.4 引物及TaqMan探针设计 引物设计采用Primer 5.0软件,由北京天一辉远生物技术有限公司合成,北京赛百盛生物技术公司合成TaqMan探针(5’– TGCAGCAGATTGGTCCTTGAAATAGTA-3’)。I198T点突变扩增片段长度164bp,野生和突变上游引物3’端-2位引入错配碱基“G”(正配碱基应为“T”)(野生引物5’– GAGCCAAGACTTGTCCCCGA-3’;突 变 引 物 5’-GAGCCAAGACTTGTCCCCGG-3’)。TaqMan探针与上游引物扩增的模板链互补。TaqMan探针5’端标记荧光报告基团FAM,3’端标记淬灭基团TAMRA。
1.2.5 TaqMan-ARMS方法反应体系及测定条件:使用BIO-RAD Opticon 2荧光定量PCR仪检测TaqMan探针FAM荧光信号。反应体系:人基因组 DNA(2.8μg/ml)2μl,2.5×realMasterMix,8 μl,上、下游引物各0.25μmol/L,探针0.25μmol/L,20×Probe Enhancer solution 1μl,ddH2O 6μl。反应条件94℃2min,94℃20sec,56℃35sec,45个循环。
1.2.6 基因型判断标准 野生型为Δct>7.13±0.55或 M引物无扩增曲线;杂合突变型为-0.21<Δct<0.71-7.98;纯合突变型为 Δct<-7.98±3.97或W引物无扩增曲线。当W、M引物均有扩增曲线,且Δct值在-4.01<Δct<-0.21或0.71<Δct<6.58范围时复查或测序。随机抽取40份标本进行测序,与TaqMan-ARMS检测I198T点突变的结果一致,符合率为100%(注:M引物:突变引物;W引物:野生引物)。
1.3 统计学分析
采用HWE软件分析两组的Hardy-Weinberg平衡;采用SPSS16.0软件,符合正态分布的计量资料用¯x±s表示,不符合正态分布者选用中位数(25%,75%)表示,并转化为以10为底的对数值进行统计分析。应用独立样本t检验对2型糖尿病组和健康对照组的基本特征与Lp-PLA2的酶活性水平进行分析;应用方差分析对不同基因型的酶活性水平进行分析;应用卡方检验对基因频率进行分析:应用logistic回归分析对Lp-PLA2的酶活性水平与2型糖尿病相关性进行分析。P<0.05为差异有统计学意义。
2 结果
2.1 研究对象的基本特征
由表1可见,T2DM2组、T2DM1组和对照组的平均年龄分别是(69.70±9.48)(67.94±10.87)岁和(68.77±11.65)岁,无统计学意义。T2DM2组和T2DM1组糖尿病患者均进行严格血糖控制,GLU间差异并无统计学意义。T2DM2组和T2DM1组HDL-C较对照组低,组间差异均有统计学意义(P<0.001)。Hs-CRP、Lp(a)高于对照组,组间差异均有统计学意义(P<0.005)。但是,TG在3组组间差异无统计学意义(P>0.05),但T2DM2组和T2DM1组CHO和LDL-C较对照组低,组间差异均有统计学意义(P<0.001)。糖尿病患者为了防止并发症,采取严格降脂治疗。而健康对照组为老年人,且未服用降脂药,故T2DM组的CHO及LDL值会低于健康对照组。?

表1 研究对象的基本特征(¯x±s)
2.2 Lp-PLA2的酶活性水平与2型糖尿病的相关性
随机选择部分标本测量Lp-PLA2的酶活性水平。Lp-PLA2的酶活性水平在T2DM2(未服用降脂药n=39)、T2DM1(服用降脂药n=26)和Control(n=116)组成依次递减趋势[29.44(16.10,55.81),21.39(12.42,52.82),19.77(14.63,26.61)nmol·ml-1·min-1],且组间差异有统计学意义,图1。
进一步按照Lp-PLA2的酶活性水平根据3个四分位数将研究对象分为不同水平组Q1-Q4,评估具有不同Lp-PLA2酶活性水平2型糖尿病的患病风险。表2给出了较高的三个组与最低组相比2型糖尿病OR值及95%CI。校正年龄和性别后,与最低组(Lp-PLA2<14.79nmol·ml-1·min-1)相比,最高组(Lp-PLA2>34.17nmol·ml-1·min-1)2型糖尿病的 OR是5.05(95%CI,1.88~13.60)(模型1)。进一步校正传统冠心病危险因素包括CHO、TG、Hs-CRP、Lp(a)后,关联更加显著(OR =12.21,95%CI,2.88~51.80)(模型2)。在模型2基础上进一步校正LDL和HDL(模型3),关联依然显著(OR =9.49,95%CI,2.02~44.63)。

图1 Lp-PLA2的T2DM与健康对照组的酶活性水平
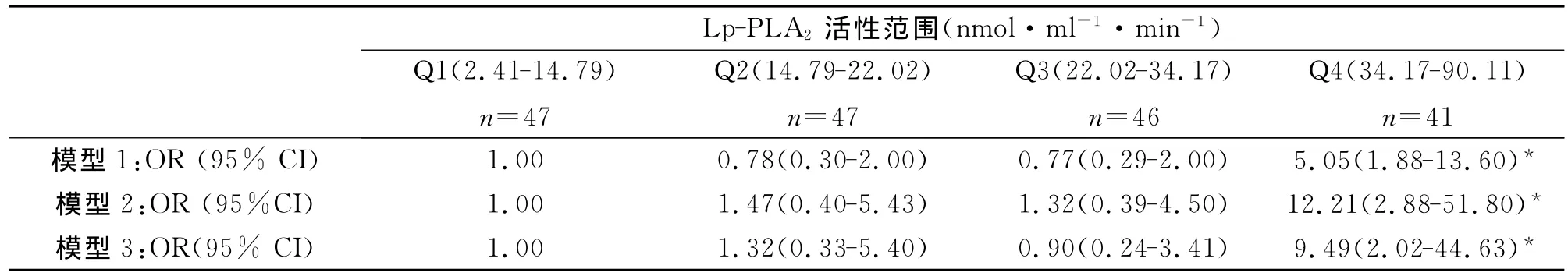
表2 Lp-PLA2酶活性水平与2型糖尿病的相关性
2.3 基因多态性
2.3.1 I198T基因型及等位基因频率比较 2型糖尿病组和健康对照组所有多态符合Hardy-Weinberg平衡。I198T点突变有3种基因型II型、IT型、TT型(表3)。与健康对照组比较,2型糖尿病组的II基因型频率与健康对照组无显著差异(P>0.05),IT基因型频率高于健康对照组(P<0.05),TT基因型频率低于健康对照组(P<0.05);组间等位基因频率比较,差异无统计学意义。
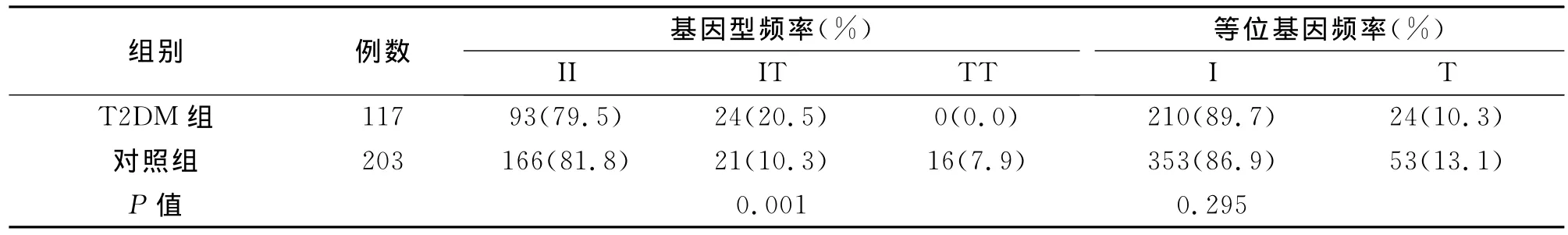
表3 T2DM组和对照组I198T基因型及等位基因频率比较(%)
2.3.2 基因型分组Lp-PLA2酶活性水平的比较由表4可知,与基因型IT相比,基因型II的Lp-PLA2酶活性最高[22.79(15.49,36.11)nmol·ml-1·min-1,P<0.05]。基因型 TT 的 Lp-PLA2酶活性最低[15.70(8.83,22.60)nmol·ml-1·min-1,P<0.05](图2)。

表4 I198T点突变不同基因型的Lp-PLA2酶活性水平
2.3.3 I198T基因型与2型糖尿病相关性 见表5,以T2DM(是,否)为因变量,基因型(II,或IT和TT)为自变量,Binary logistic回归分析显示,与基因型II相比,基因型TT与2型糖尿病的关联不显著(P>0.05),基因型IT与2型糖尿病的关联显著(OR:2.13CI:(1.11-4.07)P<0.05)。

表5 I198T点突变不同基因型的发生2型糖尿病的危险性及其95%可信区间
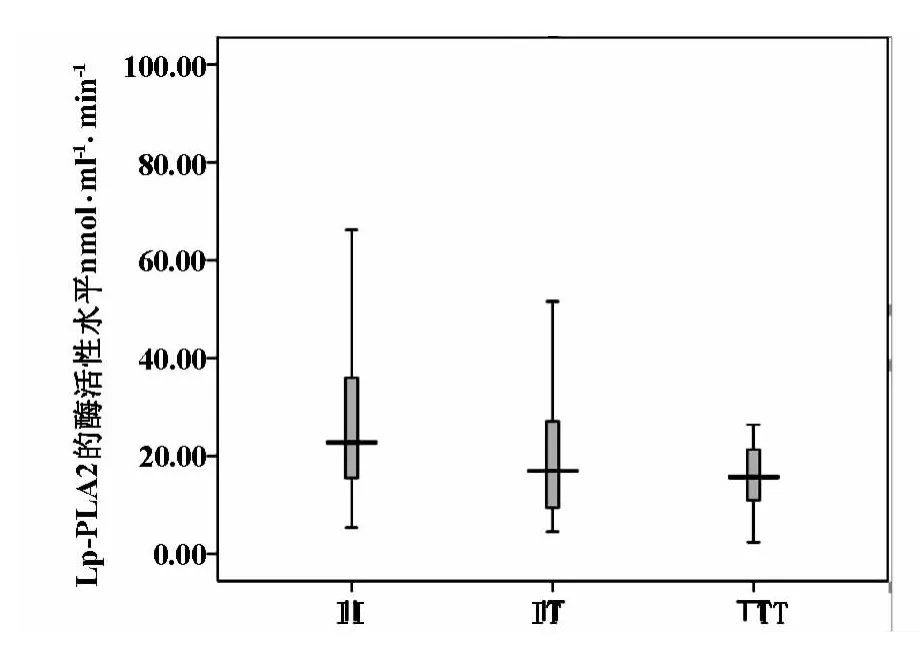
图2 Lp-PLA2在I198T不同基因型的酶活性水平
3 讨论
3.1 Lp-PLA2酶活性水平与2型糖尿病相关性
Lp-PLA2又称为血小板活化因子乙酰水解酶(PAF-AH),是由441个氨基酸残基组成的一种丝氨酸酯酶,属于磷脂酶家族,分子量50kDa。人血清中Lp-PLA2主要由成熟的巨噬细胞和淋巴细胞分泌,并受炎性介质的调节,而血小板活化因子(PAF)促进其分泌。在血浆中,约85%Lp-PLA2与LDL结合,尤其是与小而密的负电性LDL结合,其余与HDL或极低密度脂蛋白(VLDL)结合[6]。最近,国外几个较大的流行病学和临床前瞻性研究认为,血清Lp-PLA2是心血管事件的独立危险因素,参与炎症反应,与动脉粥样硬化关系密切。
本研究发现Lp-PLA2的酶活性水平在2型糖尿病患者中显著升高,logistic回归在校正了各项混杂因素包括年龄、性别、CHO、TG,、Hs-CRP、Lp(a)后,Lp-PLA2酶活性的最高组与最低组相比,2型糖尿病的OR值为12.21(2.88-51.80)。以上结果表明,2型糖尿病病人具有较高的Lp-PLA2酶活性,Lp-PLA2可作为糖尿病独立危险因素之一,严重影响临床最终事件的发生。这与来自美国的一项研究结果一致[7]。另一项研究结果也证实,Lp-PLA2的浓度与2型糖尿病并不相关,但是其酶活性水平在2型糖尿病患者中却显著升高[8]。
国内研究表明[9],罗格列酮能明显减轻糖尿病大鼠血管病变程度,降低血管局部及外周血Lp-PLA2表达。最新国外研究表明[10],2型糖尿病患者通过强化血糖控制治疗,能够起到抗动脉粥样硬化作用,包括小颗粒LDL减少,结合于HDL的Lp-PLA2的比例增多。这些研究均提示Lp-PLA2水平有可能作为2型糖尿病的治疗目标。本研究还发现,服用降脂药的T2DM1比未服用降脂药的T2DM2的Lp-PLA2的酶活性明显降低。但是,降脂机制需要进一步的研究。
3.2 I198T点突变与2型糖尿病的相关性
本研究表明T2DM组中基因型TT的基因频率显著低于健康对照组,并且其Lp-PLA2酶活性水平最低;基因型IT与2型糖尿病的关联显著。目前,对于1198T多态性与2型糖尿病的研究甚少。一项来自美国杜克大学的研究表明,无论是在家系研究中,还是在病例对照研究中,I198T基因多态性与冠心病的关联不明显[11]。但是,另一项来自德国的研究表明,1198T多态性与冠心病关联显著,杂合子IT患冠心病的风险要显著低于基因II[12]。
综上所述,Lp-PLA2可能成为早期预测2型糖尿病的指标,并在早期发挥作用。但是,Lp-PLA2酶活性水平及其基因多态性在2型糖尿病过程中的确切作用机制尚有待于更深入的研究,明确他们之间的关系,筛查高危人群,将为2型糖尿病疾病的早期诊断和防治提供新的线索。因此,我们需要在不同种族、不同区域、不同性别的人群中进行重复验证,进一步研究Lp-PLA2在2型糖尿病中的发病机制。
[1]Hou L,Chen S,Yu H,et al.Associations of PLA2G7gene polymorphisms with plasma lipoprotein-associated phospholipase A2 activity and coronary heart disease in a Chinese Han population:the Beijing atherosclerosis study[J].Hum Genet,2009,125(1):11.
[2]Jenny N S,Solomon C,Cushman M,et al.Lipoprotein-associated phospholipase A(2)(Lp-PLA(2))and risk of cardiovascular dis-ease in older adults:results from the Cardiovascular Health Study[J].Atherosclerosis,2010,209(2):528.
[3]Oei H H,van der Meer I M,Hofman A,et al.Lipoprotein-associated phospholipase A2activity is associated with risk of coronary heart disease and ischemic stroke:the Rotterdam Study[J].Circulation,2005,111(5):570.
[4]Zalewski A,Macphee C,Nelson J J.Lipoprotein-associated phospholipase A2:apotential therapeutic target for atherosclerosis[J].Curr Drug Targets Cardiovasc Haematol Disord,2005,5(6):527.
[5]Hou L,Chen S,Yu H,et al.Associations of PLA2G7gene polymorphisms with plasma lipoprotein-associated phospholipase A2 activity and coronary heart disease in a Chinese Han population:the Beijing atherosclerosis study[J].Hum Genet,2009,125(1):11.
[6]Caslake M J,Packard C J,Suckling K E,et al.Lipoprotein-associated phospholipase A(2),platelet-activating factor acetylhydrolase:apotential new risk factor for coronary artery disease[J].Atherosclerosis,2000,150(2):413.
[7]Hatoum I J,Hu F B,Nelson J J,et al.Lipoprotein-associated phospholipase A2activity and incident coronary heart disease among men and women with type 2diabetes[J].Diabetes,2010,59(5):1239.
[8]Nelson T L,Kamineni A,Psaty B,et al.Lipoprotein-associated phospholipase A(2)and future risk of subclinical disease and cardiovascular events in individuals with type 2diabetes:the Cardiovascular Health Study[J].Diabetologia,2011,54(2):329.
[9]余 娇,王宁荐,赵丽娟,等.罗格列酮对1型糖尿病大鼠血管结构及磷脂酶A2表达的影响[J].上海交通大学学报(医学版),2010,30(6):665.
[10]JoséL.Sánchez-Quesada,Irene Vinagre,Elena de Juan-Franco,et al.Effect of Improving Glycemic Control in Patients With Type 2Diabetes Mellitus on Low-Density Lipoprotein Size,Electronegative Low-Density Lipoprotein and Lipoprotein-Associated Phospholipase A2Distribution[J].Am J Cardilo,2012,110:67.
[11]Winkler K,Abletshauser C,Friedrich I,et al.Fluvastatin slowrelease lowers platelet-activating factor acetyl hydrolase activity:aplacebo-对照led trial in patients with type 2diabetes[J].J Clin Endocrinol Metab,2004,89(3):1153.
[12]Hoffmann M M,Winkler K,Renner W,et al.Genetic variants and haplotypes of lipoprotein associated phospholipase A2and their influence on cardiovascular disease (The Ludwigshafen Risk and Cardiovascular Health Study)[J].J Thromb Haemost,2009,7(1):41.
