稻田中藻类的生长状况及其对肥料氮的固持
2013-10-08曹彦圣田玉华朱兆良
曹彦圣,田玉华,尹 斌*,朱兆良
(1土壤与农业可持续发展国家重点实验室,中国科学院南京土壤研究所,江苏南京210008;2中国科学院大学,北京100049)
稻田生态系统的环境条件有利于藻类的生长—满足了藻类生长对光照、水分、高温及养分的需求[1],这导致了藻类在稻田生态系统中的广泛分布。稻田生态系统中广泛分布的藻类已经受到研究人员越来越多的关注。自2000年起,本研究组对太湖地区稻田中藻类的生长进行了多年连续的观察,发现在最初几年,每次施肥后不久,田面水表面均产生大量的藻类,一周后则逐渐消失;在水稻生长的中后期也很少有藻存在。然而,经过多年大量施肥后,该地区稻田生态系统中藻类的生长已经发生了明显的变化,最显著的特征是藻类在稻田中存在的时间变长了,甚至到水稻收获时,在土壤表层往往都存在一层灰色或褐色的主要由藻类残体形成的“干皮”(crust)状物体。考虑到藻类的生理特性[2-4],持续大量存在的藻类可对稻田生态系统中氮素的转化与迁移过程产生较大的影响。这主要表现为两个方面:一方面,藻类在进行光合作用的过程中导致田面水pH值的升高,使得NH3挥发损失加剧[5],而部分藻类,如蓝藻,属于好氧光合生物,它们在进行光合作用的过程中释出大量的O2,从而促进氮素的硝化—反硝化损失[3];另一方面,藻类在生长过程中除了可以固定大气中的N2外,还可以直接吸收和利用施入稻田的无机态氮以合成自身的细胞物质[6-9]。藻类通过对无机态氮的固持作用,可以减少其在稻田土壤中的累积,从而有效减少氮素损失。为了确定藻类对稻田生态系统中氮素固持与迁移过程的影响程度,就必须首先了解藻类在整个水稻生育期中的生长、衰减及残留等基本状况,研究藻类生物量与氮素固持量等最基本的问题。为此,本研究在2007年6月至10月观察并测定了不同时期稻田施肥小区藻类的生长状况、生物量及氮素固持量等;在此基础上,又在2009年6月至10月连续观察了施肥小区藻类的群落演替特征,并利用15N示踪试验测定了藻类生物量的变化及其对化肥氮的固持量。以上研究,可以为下一步深入研究藻类在稻田生态系统的养分转化、迁移及固持中的作用奠定基础,而且也为研发有效提高氮肥利用率,减少环境污染的新技术和方法提供科学的依据。
1 材料与方法
1.1 试验站概况
田间试验在中国科学院常熟国家农业生态实验站内进行。实验站位于北纬31°32'45″,东经120°41'57″,海拔1.3 m,地处太湖流域。区域气候为亚热带季风气候,年平均气温为15.5℃,年平均降水量为1 038 mm。实验站土壤类型属于湖泊沉积物发育的潜育型水稻土。表层(0—20 cm)土壤的pH值为7.36,土壤有机质含量35.0 g/kg、全氮2.09 g/kg、全磷0.93 g/kg、速效磷5.00 mg/kg和速效钾123.1 mg/kg,阳离子交换容量17.7 cmol/kg。
1.2 田间试验设计及管理措施
本研究分别于2007年6月至10月利用小区试验定量测定了水稻不同生育期内藻类的生物量和氮素固持量;2009年6月至10月连续观察了施氮小区藻类群落的演替特征,并利用微区15N示踪试验定量测定了水稻不同生育期藻类的生物量及对施入肥料氮的固持量。具体试验设计如下:
小区试验的目的在于观测藻类在整个水稻生育期内的生长状况、生物量与氮素固持量的变化以及藻类的衰减规律。于2007年6月30日移栽稻秧,苗间距为20 cm×20 cm,小区面积为40 m2,小区之间筑田埂并用塑料薄膜覆盖以防侧渗。小区试验设置不施氮的对照(磷钾肥的施用同常规处理)和当地常规施氮两个处理,重复4次。肥料使用尿素(N 46%)、过磷酸钙(P2O516%)和氯化钾(K2O 60%),施用量分别为 N 300 kg/hm2、P2O590 kg/hm2和 K2O 90 kg/hm2。氮肥按4∶3∶3 的比例分3次施用,磷、钾肥作为基肥一次性施入。基肥于稻秧移栽前混施入稻田中,而分蘖肥和穗肥则分别于7月13日和8月13日施入。田面水层一般维持约5 cm深,7月下旬排干田面水烤田,收获前1周停止灌溉,10月31日收获水稻。
微区15N示踪试验的目的是确定藻类对当季施入肥料氮的固持状况及数量以及研究藻类的衰减规律。设计在藻类生长相对稳定的几个时期同时也对应水稻生长的几个主要阶段:如拔节期、抽穗期、成熟期以及水稻收获时各取样1次,每次取重复样3个,由于是破坏性采样,采样后的微区试验不再进行,因此共需要12个15N微区。微区试验设置在小区中,小区试验与前面一样按不施氮的对照和按当地常规施氮两个处理进行,微区施肥与前面小区试验完全一致,只是施用的尿素由普通尿素换成15N丰度为5%的标记尿素。微区由长、宽和高分别为0.50、0.25和0.65 m的PVC塑料框围成,塑料框压入土壤约0.50 m深,以防止15N向四周土壤扩散,而微区上沿高出地面约0.15 m,以防止15N随田面水流失。加上对照共计设置24个微区。6月16日移栽稻秧,每个微区植3穴。分蘖肥和穗肥分别于6月23日和8月13日施入。水分管理方式与前面小区试验相同。10月24日收获水稻。
1.3 藻类样品的收集及测定
2007年稻季,依次在分蘖期、拔节期、抽穗期、成熟期和水稻收获时(分别为稻秧移栽后第20、40、71、102和132天)采集小区内具有代表性的直径为0.40 m范围内的藻类样品。采样时,把内径为0.40 m的PVC框插入土壤中。在排干框中田面水后,用刮刀从土壤表面直接刮取藻类样品,每次取重复样3个。2009年则分别为稻秧移栽后第41、72、103和133天采集微区内全部的藻类样品。采集方法同上。藻类样品经清洗和去除杂质后,烘干、称重,然后贮存在干燥器中直至测定。
采用凯氏消解法测定藻类的总氮含量。消解液蒸馏产物在滴定测定总氮含量后,加入数滴浓度为3 mol/L的硫酸溶液。经过蒸发浓缩后,用Finnigan-MAT-251型质谱仪测定其15N原子百分数。藻类15N固持量按照如下公式进行计算:
藻类15N固持量=藻类生物量×藻类总氮含量×藻类中15N原子百分超/氮肥的15N原子百分超。
2 结果与讨论
2.1 藻类群落演替特征
在水稻秧苗移栽后的次日,不施氮的小区只有少量藻或没有藻生长;而施氮小区的田面水表面则出现规模不等的浮游泡沫状生物。这些生物主要由球状藻类组成(图1左)。此后,从第4日一直到第6日,在对照和施氮小区的田面水表面均未发现浮游藻类生长。原因可能在于,这个时期的藻类群落并不稳定,当环境条件发生较大变化时,如灌溉、降雨或大风,藻类群落可能就会“消失”。另一个原因可能在于,藻类易于被土壤生物摄食或被微生物分解。在第7日,对照小区无变化,而在施氮小区却发现在土水界面邻近水稻茎部处开始出现丝状藻类团聚体(图1右)。从此时起,在其后的水稻生育期内,丝状藻类始终是优势种群,即使在水稻生育的后期,水稻冠层覆盖浓密的情况下,丝状藻类仍然处于支配地位。
在整个水稻生育期,由于光照差异等原因,藻类细胞色素组成及含量会发生显著的变化。在稻田表面光照充足时,藻类呈现绿色,而在光照不足时,藻类呈现棕色。在水稻收获时,藻类则已经呈灰色,而在对照小区则几乎不见藻残留物,由于对照小区采集不到藻,因此,以下的数据中没有对照的数据。

图1 稻田中藻类群落的形态Fig.1 Algal community morphology in flooded paddy field
2.2 藻类的生物量和氮素固持量
正如上文所述,对于施氮小区在稻秧移栽初期形成的球状藻类群落并不稳定,灌溉、降雨及大风都可能使浮游藻类群落“消失”。因此,稻秧移栽后最初大约1周内,在微区内均未发现肉眼可见的藻类群落。1周以后,藻类的生物量和氮素固持量均开始逐渐增加(表1和表2),并在拔节期达到最大值。此后,藻类的生物量和氮素固持量均开始逐渐下降。水稻收获时,藻类生物量和氮素固持量均已经下降至最低值。这些结果表明,藻类群落在稻田中的生长大致可分为两个阶段,即生长期和衰亡期。其中,生长期从稻秧移栽初期开始,持续至拔节期,而从拔节期开始至水稻收获这段时期对应于衰亡期。曲线回归分析的结果(图2)显示,在2007和2009年的衰亡期,藻类生物量随时间的变化均符合生长曲线模式(P<0.05),回归方程可分别表示为:
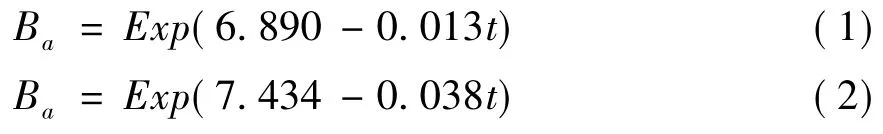
式中:Ba—藻类的生物量(kg/hm2);t—稻秧移栽后的天数(d);6.890、-0.013,7.434、-0.038分别为2007和2009年的回归系数。与小区相比,微区内单位面积藻类的生物量和氮素固持量均明显较低。这可能主要与微区内光照度较低不利于藻类的生长有关。

表1 2007年水稻生育期藻类的生物量和氮素固持量Table 1 Algal biomass and nitrogen immobilization during the 2007 rice growth period
在整个水稻生育期内,藻类生物量动态变化的原因在于:1)在水稻生育前期,由于作物冠层稀疏,稻田表面的光照度相对较高,而且氮、磷、钾养分供应充足,因而有利于藻类的生长;2)而在水稻生育中后期,一方面,作物冠层覆盖浓密,降低了稻田表面的光照度;另一方面,作物对氮素的有效吸收减少了藻类生长的基质,从而导致藻类逐渐消亡并分解。而且,分蘖末期的排水烤田也在很大程度上抑制了藻类在稻田中的生长[10]。研究还发现,水稻生育中期藻类生物量减少的速率高于水稻生育末期,2007年尤其显著。这可能主要与水稻生育末期藻类群落组分微生物分解耐受性较高有关。Roger和Kulasooriya[11]已经报道,不同种类藻的微生物分解耐受性具有显著的差异。正是由于这个原因,在水稻收获时,藻类在稻田中产生了明显的残留效应(土壤表面存在一层主要由藻类组成的干皮)。

表2 2009年水稻生育期藻类的生物量、氮素固持量和15N固持量Table 2 Algal biomass,nitrogen immobilization and15N immobilization during the 2009 rice growth period
2007和2009 年水稻生育期藻类生物质干重的变化范围分别为 205~610 kg/hm2和12~353 kg/hm2。这处于 Roger和 Kulasooriya[11]报道范围内的每公顷稻田可以生产2~480 kg藻类干物质;藻类生物质的鲜重则可高达每公顷数吨。另一个报道也表明,在适宜的条件下,藻类可以在稻田中大量生长,每公顷平均可生产6~8 t(鲜重)藻类生物质[12]。在水稻生育前期,藻类对肥料氮的固持将有助于减少氮肥损失。水稻生育前期氮肥施用量较高(在本研究中,前期氮肥施用量占稻季总施用量的40% ~80%),然而作物氮肥利用率较低,大部分氮肥将通过NH3挥发、硝化—反硝化和淋溶等途径损失至环境中,从而造成氮素环境污染。藻类由于可以通过固持作用把施入土壤中的肥料氮暂时转化为较稳定的有机态氮[13],减少无机态氮在土壤中的累积,因而有利于减少氮肥损失。在乌拉圭进行的一个研究中,Irisarri等[14]发现,在作物收获后,接种蓝藻的处理,其土壤回收的肥料氮显著高于未接种的处理(P<0.08);接种处理土壤回收的肥料氮大于植株,而接种处理植株回收的肥料氮与未接种处理之间无显著的差异。研究认为,这是由于接种蓝藻增加了土壤中微生物氮素固持量。但是,一些研究也发现,藻类进行光合作用时消耗田面水中的CO2,提高田面水的pH值,从而促进NH3挥发的发生[3]。而且,藻类在光合作用过程中可以释放大量的O2,提高田面水和表层土壤的氧化还原电位,从而有利于施入稻田中的尿素或其他铵态氮肥发生硝化反应,形成硝态氮。硝态氮扩散至毗邻的厌氧层,在反硝化细菌的作用下转化为N2,后者最终被扩散至大气中[3]。藻类通过这两种途径加剧氮肥损失的发生。然而,到目前为止,尚未发现关于藻类对稻田生态系统氮肥损失正反两方面影响的定量比较,这也是下一步要深入进行研究的重要方向。在水稻生育中后期,藻类的氮素固持量与生物量均呈逐渐下降的趋势(表1和表2)。这表明,随着藻类的死亡,藻类固持的氮素将通过微生物的分解逐渐释放至土壤环境中,并最终被作物吸收利用[3,14]。通过对藻类已固持肥料氮矿化作用的研究,Irisarri等[14]发现,在培养25 d后,在植株中就可以检测到藻类通过矿化作用释放出来的已固持肥料氮;在整个水稻生育期,植株可以利用5% ~12%的藻类氮素;在培养40 d后,接种藻类土壤无机氮含量高于未接种土壤。部分藻类群落组分微生物分解耐受性较高,因而导致水稻收获时仍然有相当一部分肥料氮以有机氮的形式存在,这将有助于提高土壤肥力。有研究表明,在稻田中接种藻类可以使土壤总氮含量从1.6%增加至 2.9%[15]。

图2 水稻生育期藻类生物量随时间的变化Fig.2 Variation in algal biomass over the rice growth season
与氮素总固持量一致,藻类15N固持量在拔节期也达到最大值,为N 6.0 kg/hm2。此后,藻类15N固持量逐渐下降。在水稻收获时,藻类15N固持量已降至最低值,为N 0.3 kg/hm2。但是,藻类15N固持量(表2)占氮素总固持量比例的变化较小,其变化范围为54% ~68%,平均为57%。这表明,藻类固持的氮素中大部分来源于当季施入的化肥氮,而从大气中固定的和从土壤体系中固持的氮素相对较少。这是因为,藻类固持尿素水解产生的累积在田面水或表层土壤中的铵态氮消耗的能量更少,而且无机氮肥的大量施用也抑制了藻类的固氮作用[3]。
3 结论
在大量施用化肥的情况下,稻田中藻类的生长状况已经发生了明显的变化。稻秧移栽初期以球状藻为主,而在中后期则以丝状藻为优势种。藻类在稻田中存在的时间更长,而且具有显著的残留效应。藻类在稻田中的生长总体上可分为生长期和衰亡期。其中,在衰亡期藻类生物量随时间的变化符合生长曲线模式(P<0.05)。水稻移栽初期,适宜的光照条件及化肥的大量施用刺激了藻类的生长,藻类氮素固持量也随之增加;在拔节期,藻类生物量和氮素固持量达到高峰;而随着水稻的生长,水稻冠层逐渐封闭稻田表面,藻类的生长将受到抑制直至消亡,藻类的氮素固持量也随之减少。藻类在水稻生育前期对肥料氮的固持有助于减少氮肥损失,而在水稻生育中后期,随着藻类的消亡,藻类固持的肥料氮将在微生物的作用下释放至环境中,最终被植物吸收利用。由于藻类吸收无机氮时消耗的能量更少以及氮肥施用对藻类固氮作用的抑制,藻类固持的氮素中大部分来源于肥料氮,从大气中固定的及从土壤体系中固持的氮素相对较少。
[1] Roger P A.Blue-green algae in rice fields:their ecology and their use as inoculant[DB/OL].http://horizon.documentation.ird.fr/exl-doc/pleins_textes/pleins_textes_5/b_fdi_23-25/29755.pdf.2012-5-1.
[2] De P K.The role of blue-green algae in nitrogen fixation in ricefields[J].Proc.R.Soc.London,Ser.B,Biol.Sci.,1939,127(846):121-139.
[3] Mandal B,Vlek P L G,Mandal L N.Beneficial effects of bluegreen algae and Azolla,excluding supplying nitrogen,on wetland rice fields:a review[J].Biol.Fert.Soils,1999,28(4):329-342.
[4] Prasanna R,Jaiswal P,Kaushik B.Cyanobacteria as potential options for environmental sustainability-promises and challenges[J].Ind.J.Microbiol.,2008,48(1):89-94.
[5] 张启明,铁文霞,尹斌,等.藻类在稻田生态系统中的作用及其对氨挥发损失的影响[J].土壤,2006,38(6):814-819.Zhang Q M,Tie W X,Yin B et al.Algae function in paddy field ecosystem and its effect on reducing ammonia volatilization from paddy fields[J].Soils,2006,38(6):814-819.
[6] Meyer M L,Bloom P R,Grava J.Transformation and losses of applied nitrogen-15 labeled ammonium in a flooded organic soil[J].Soil Sci.Soc.Am.J.,1989,53(1):79-85.
[7] Ariosa Y,Carrasco D,Quesada A,Femandez V E.Incorporation of different N sources and light response curves of nitrogenase and photosynthesis by cyanobacterial blooms from rice fields[J].Microbiol.Ecol.,2006,51(3):394-403.
[8] Vlek P L G,Stumpe J M,Byrnes B H.Urease activity and inhibition in flooded soil systems[J].Nutr.Cycl.Agroecosys.,1980,1(3):191-202.
[9] 铁文霞,贺发云,田玉华,等.长期试验的水稻土上藻类培养生长状况的研究[J].土壤,2010,42(2):319-322.Tie W X,He F Y,Tian Y H et al.Study of algae growth in longterm site-specific experiment paddy soils under incubation chamber[J].Soils,2010,42(2):319-322.
[10] Okuda A,Yamaguchi M.Algae and atmospheric nitrogen fixation in paddy soils.II.Relation between the growth of blue-green algae and physical or chemical properties of soil and effect of soil treatments and inoculation on the nitrogen fixation[J].Mem.Res.Inst.Food Sci.Kyoto Univ.,1952,4:1-11.
[11] Roger P A,Kulasooriya S A.Blue-green algae and rice[M].Los Baňos,Philippines:IRRI,1980.
[12] Roger P A,Grant I F,Reddy P M et al.The photosynthetic aquatic biomass in wetland rice fields and its effect on nitrogen dynamics[DB/OL].http://horizon.documentation.ird.fr/exldoc/pleins_textes/pleins_textes_5/b_fdi_18-19/25627.pdf.2012-5-1.
[13] Roger P A.Biology and management of the floodwater ecosystem in rice fields[M]. Manila, Philippines: IRRI &ORSTOM,1996.
[14] Irisarri P,Gonnet S,Deambrosi E,Watanabe I.Cyanobacterial inoculation and nitrogen fertilization in rice[J].World J.Microbiol.Biotechnol.,2007,23(2):237-242.
[15] Dhar D W,Prasanna R,Singh B V.Comparative performance of three carrier based blue green algal biofertilizers for sustainable rice cultivation[J].J.Sustain.Agric.,2007,30(2):41-50.
