不同培肥模式对茶园土壤微生物活性和群落结构的影响
2013-10-08林新坚邱珊莲陈济琛王利民
林新坚,林 斯,邱珊莲,陈济琛,王 飞,王利民
(1福建省农业科学院土壤肥料研究所,福建福州350003;2福州大学生物科学与工程学院,福建福州350108)
茶园红壤广泛分布在中国南部和部分中部热带亚热带地区,因其pH值低,淋洗作用强,有机质及养分流失严重[1],加之土地的过度开发和不合理施肥等人为活动,造成土壤理化性质恶化,导致土壤肥力下降。但是,施肥能激活休眠细胞参与土壤物质循环[2],是改善土壤理化性质,提高作物产量,改善茶叶品质的重要环节。近年来,人们对施肥与茶园土壤生态环境因子之间的响应做了大量的研究,徐华勤等[3-4]、邓欣等[5]和林新坚等[6]分别报道了各地茶园土壤在不同培肥措施下对微生物群落功能、微生物碳、微生物数量和茶叶产量等的影响,阐明了施肥与土壤质量及茶树生长状况之间的内在联系。但是,在红黄壤区茶园,何种培肥模式更合理?以及其对土壤酶活性和微生物有何影响尚不清楚。因此,本文以闽东地区红壤茶园长期定位实验地为平台,通过测定茶园土壤微生物生物量、微生物数量、酶活性和PLFAs定性分析,探讨不同培肥处理对土壤微生物特征和酶活性的影响,阐明各指标与土壤质量及各指标间的相互关系。为红壤区茶园高产高效、安全环保可持续发展培肥模式提供科学依据。
1 材料与方法
1.1 供试材料
1.1.1 供试土壤 试验设在福建省福安市市郊天香茶叶有限公司长期培肥定位区,位于福建省东北沿海(119°23'~119°51'E ,26°41'~27°24'N),属于中亚热带海洋性季风气候。地貌以中、低山,丘陵为主,适宜茶树生长。试验区年均气温19.3℃,年日照时数1836.6 h,年降水量1539.9 mm,3~9月份为雨季,占年降水总量的81.5%,10月份至翌年2月份为旱季。
试验区内的土壤母质为侵入岩和火山岩,地带性土壤为红黄壤。供试土壤基础肥力:有机质含量7.40 g/kg、全氮0.40 g/kg、水解氮58.34 mg/kg、有效磷 0.87 mg/kg、速效钾 77.20 mg/kg、pH值5.19。
1.1.2 供试肥料 有机肥为“农地乐牌”精制有机肥,其有机质含量368.90 g/kg、全氮9.00 g/kg、全磷(P2O5)22.90 g/kg、全钾 (K2O)5.29 g/kg。化肥分别为尿素、磷酸一铵和氯化钾,每年冬季进行条施。绿肥品种为圆叶决明(Cassia rotundifolia,34721品系),播种量7.50 kg/hm2,每年冬季自然枯萎并覆盖于茶园行间的表土上,种子成熟后随之散落,次年春天萌芽。
1.1.3 供试茶树 黄观音(Camelliasinensis‘huangguanyin’)。
1.2 试验设计
定位试验始于2006年,设6个处理,3次重复,随机区组排列,小区面积13.65 m2。6个处理分别为:1)CK,不施肥;2)NPK,全量化肥(年施 N 102.90 kg/hm2、P2O533.90 kg/hm2、K2O 33.90 kg/hm2);3)NPKO,半量化肥(年施 N 51.45 kg/hm2、P2O516.95 kg/hm2、K2O 16.95 kg/hm2)+半量有机肥(年施量5716.50 kg/hm2);4)O,全量有机肥(年施量11433.00 kg/hm2);5)NPKL,全量化肥(年施 N 102.90 kg/hm2、P2O533.90 kg/hm2、K2O 33.90 kg/hm2)+豆科绿肥;6)NPKOL,半量化肥(年施 N 51.45 kg/hm2、P2O516.95 kg/hm2、K2O 16.95 kg/hm2)+半量有机肥(有机肥年施量5716.50 kg/hm2)+豆科绿肥,且以后每年均按照此试验设计连续进行。
1.3 样品采集及处理
土样采集时间为2011年5月,各试验小区内按“S”形取样,随机布点采集茶园0—20 cm土层样品,混匀,每处理3个重复。湿土去除石砾和植物残根等杂物,过2 mm筛,测定理化性质;供土壤酶活性、微生物生物量和微生物数量分析的土样贮于4℃冰箱;供PLFAs分析的土壤样品在-70℃超低温冰箱冷冻保存。
1.4 测定方法
1.4.1 土壤化学指标测定 pH值用电位法,有机质用重铬酸钾氧化—外加热法,全氮用半微量凯氏法,水解氮用碱解—扩散法,有效磷用 0.03 mol/L NH4F-0.025 mol/L HCl浸提法,速效钾用1 mol/L乙酸铵浸提—火焰光度法[7]测定。
1.4.2 土壤可培养微生物测定 土壤可培养微生物采用平板分离计数法[8];细菌采用牛肉膏蛋白胨培养基分离培养;放线菌采用高氏1号培养基;真菌采用孟加拉红培养基。
1.4.3 土壤微生物生物量碳、氮测定 将新鲜土壤样品于25℃下密封预培养7~10 d,然后采用氯仿熏蒸—K2SO4提取法[9]提取土壤中微生物碳、氮:称取预处理湿土20.0 g(烘干基重)于25 mL培养皿中,置于底部含少量NaOH、少量水(约200 mL)和去乙醇氯仿的真空干燥器中,将密封的真空干燥器抽真空至氯仿沸腾并保持3~5 min。而后将干燥器放入25℃培养箱中黑暗培养24h。将干燥器再次抽真空除尽土壤中吸附的氯仿,置于200 mL提取瓶中,加入50 mL 0.5 mol/L K2SO4提取液,在25℃下,300 r/min振荡 30 min,再 3000 r/min离心 5 min,取上清液过滤。采用Shimadzu TOC 500测定仪自动测定提取液中的微生物量碳、氮。
1.4.4 土壤酶活性测定 过氧化氢酶参照Trasar-Cepeda[10]的方法测定; 转化酶采用3,5- 二硝基水杨酸 比 色 法[8]测 定; 脲 酶 采 用 Kandeler和Gerber[11]的 方 法 测 定; 酸 性 磷 酸 酶 按 照Tabatabai[12]方法测定。
1.4.5 土壤微生物PLFAs分析 磷脂脂肪酸的提取过程和分析参考 Frostegård[13]和 Kourtev[14]方法:1)脂肪酸的释放与甲酯化 取10 g土样于50 mL离心管中,加入15 mL 0.2 mol/L的KOH甲醇溶液,斡旋震荡5 min,并于37℃水浴温浴1 h,每10 min斡旋样品一次;2)中和溶液pH 加入3 mL 1.0 mol/L的醋酸溶液中和,充分摇匀;3)脂肪酸的萃取 加入10 mL正己烷,充分摇匀,800 r/min离心15 min,打开管盖,上层正己烷于干净玻璃试管中,氮气吹干使溶剂挥发;4)转移 在玻璃试管中加入0.5 mL体积比为1∶1的正己烷甲基丁基醚溶液,充分溶解3~5 min,转入GC小瓶,同时加入10 μL浓度为1 g/L的内标物19∶0,并上机测定。
PLFAs的检测采用美国MIDI公司生产的微生物自动鉴定系统(Sherlock Microbial Identification System Sherlock MIS4.5)进行,包括 Agilent 6890N型气相色谱仪,全自动进样装置、石英毛细管柱及氢火焰离子化检测器。在下述色谱条件下平行分析磷脂脂肪酸甲酯混合物标样和待检样本:二阶程序升高柱温,170℃ 起始,5℃/min升至 260℃,而后40℃/min升温至310℃,维持 90 s;汽化室温度250℃,检测器温度300℃;载气为H2(2 mL/min),尾吹气为N2(30 mL/min);柱前压68.95 kPa;进样量1 μL,进样分流比100 ∶l,电子轰击电离源(EI)到质谱检测,峰面积通过计算机自动积分。
土壤微生物种类的磷脂脂肪酸(PLFAs)的生物标记识别采用 Cavigelli[15]和 Zelles[16]的方法。
1.5 数据分析
数据采用SPSS(PASW)18.0软件进行ANOVA方差分析和Duncan’s新复极差法多重比较,并进行相关性分析。
2 结果与分析
2.1 不同施肥处理对土壤化学性质的影响
土壤pH值与土壤微生物活性、土壤肥力以及作物生长等密切相关。茶园红黄壤经培肥后,不同处理的土壤pH,未有明显差异,为5.40~5.68,属于弱酸性或酸性(表1)。土壤有机质含量与土壤肥力水平呈正相关,可表征土壤肥力的高低。由表1可知,土壤有机质、全氮、全磷、水解氮、有效磷和速效钾均以全量有机肥处理(O)最高,其次为NPKOL处理。与CK处理相比,3种含有机肥的培肥处理(NPKO、O和NPKOL)的土壤有机质含量明显增加,分别增加 89.19%、227.84%和 129.26%,CK、NPK、NPKL处理间差异不显著。NPK、NPKO、O、NPKL、NPKOL处理土壤全氮含量分别比CK增加了 14.29%、123.81%、360.32%、39.68%、171.43%,NPKO、O、NPKOL处理的土壤全磷含量分别是CK处理的3.10、6.75、4.05倍;NPKO、O、NPKOL处理的水解氮含量分别比CK处理增加了84.86%、175.22%、159.40%;有效磷含量分别增加了11.66、16.19、41.54、34.35、10.02倍;NPK、NPKO、O、NPKL、NPKOL处理土壤速效钾含量分别比 CK增加了 73.06%、209.61%、367.25%、86.52%、334.64%。
2.2 不同施肥处理对土壤可培养微生物的影响
由表2可知,CK和NPK处理的可培养微生物数量无显著差异。NPK配施有机肥(NPKO)、单施有机肥(O)、NPK配施豆科牧草(NPKL)、NPK配施有机肥和豆科牧草(NPKOL)处理的可培养细菌、放线菌和真菌数量与CK比较均有显著提高,提高幅度分别为255.3% ~455.3%、172.1% ~286.0%和60.8% ~190.2%。其中NPKOL可培养细菌的数量高于其他处理,与CK相比,提高幅度达455.3%;O和NPKOL处理可培养放线菌的数量显著高于其他处理,分别比CK提高了286.0%和225.6%;NPKL处理的可培养真菌数量达到最大,比 CK提高了190.2%。
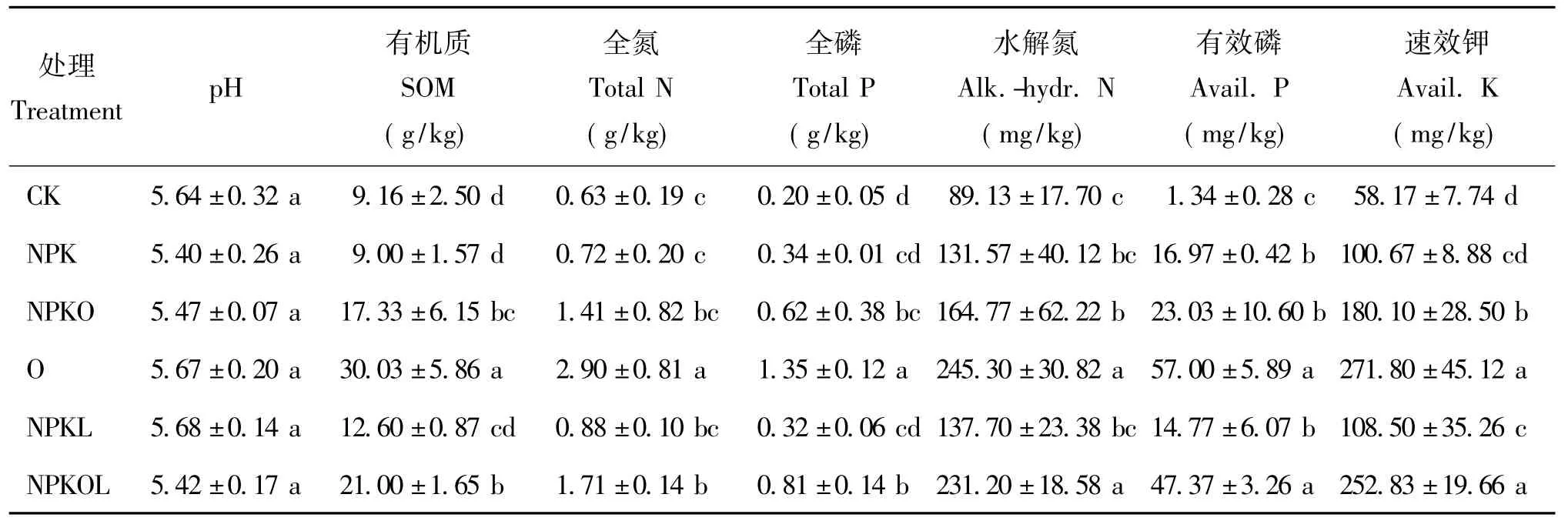
表1 不同施肥处理土壤的化学性质Table 1 The basic soil characteristics under different fertilization treatments
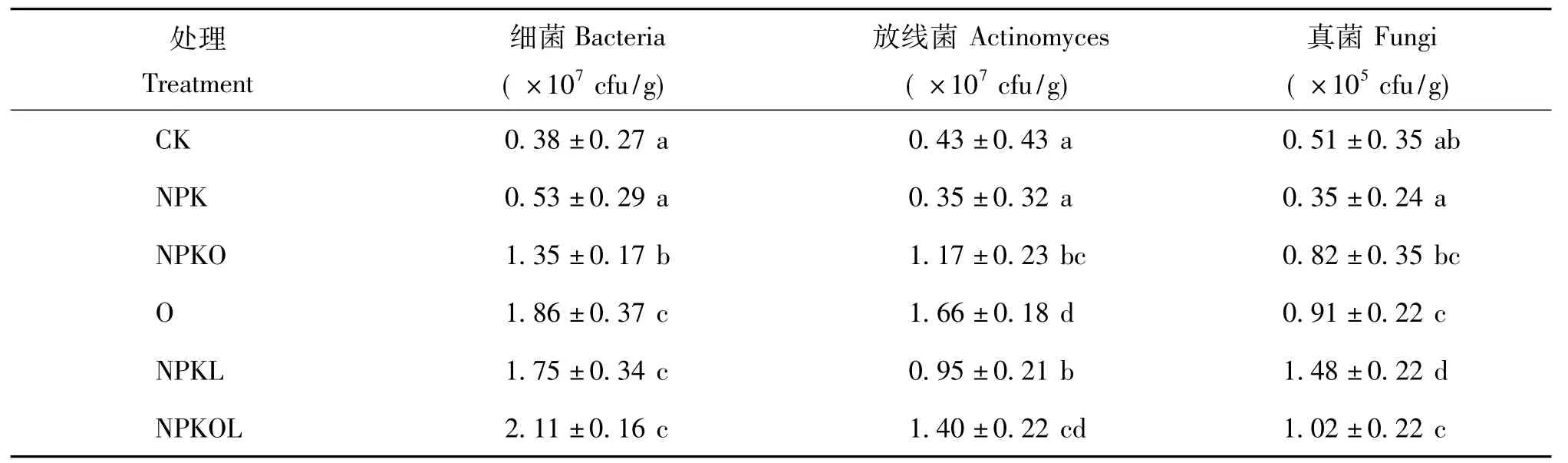
表2 不同施肥处理土壤中可培养细菌、放线菌和真菌数量Table 2 The number of soil culturable bacteria,actinomyces,and fungi under different fertilizations
2.3 不同施肥处理对土壤微生物量的影响
从表3可以看出,与 CK相比,NPK处理和NPKO处理土壤微生物量碳(SMBC)和微生物量氮(SMBN)的值均下降,而O、NPKL和NPKOL则有不同程度的提高,其中NPKOL处理的SMBC和SMBN的值最高,分别为129.00、28.98 mg/kg,比对照分别提高了142.66%和66.17%。各种施肥处理SMBC/SMBN的值均比CK处理高,提高值为0.39~3.24,提高幅度为14.33% ~119.1%,其中NPKL处理最高,比CK高119.1%。但是方差分析结果表明,各种施肥处理的微生物量碳、微生物量氮和微生物量碳/微生物量氮的值与CK相比均未达到显著性差异。
2.4 不同施肥处理对土壤酶活性的影响
酶活性与微生物群落之间关系密切,能够快速反馈土地管理措施的改变。表4结果显示,不同施肥处理茶园土壤各种酶活性存在不同程度的差异。土壤过氧化氢酶酶活性除NPKL比CK降低外,其他施肥方式均有一定程度的提高,提高幅度为9.68%~29.03%,其中NPKOL处理高于其他培肥方式。方差分析表明,各处理间的差异不显著。与CK相比,土壤转化酶酶活性均有不同程度提高,提高幅度为14.86% ~106.34%,其中NPKL处理提高程度最大,NPKOL次之。方差分析表明,NPKL和NPKOL转化酶活性均显著高于其他施肥处理,其他施肥处理与CK差异不显著。土壤脲酶酶活性除NPKL比CK有所降低外,其他施肥方式均有不同程度的提高,提高幅度为22.04% ~84.06%,其中NPKOL>NPKL>O>NPKO。方差分析表明,NPKL和NPKOL转化酶活性均显著高于其他施肥处理,其他施肥处理与CK差异不显著。与CK相比,土壤酸性磷酸酶活性除NPKL和NPKOL处理有一定程度的提高,其余施肥处理均有所下降。NPKL和NPKOL的提高幅度分别为19.91%和20.35%。方差分析表明,NPKL和NPKOL酸性磷酸酶活性均显著高于CK处理。
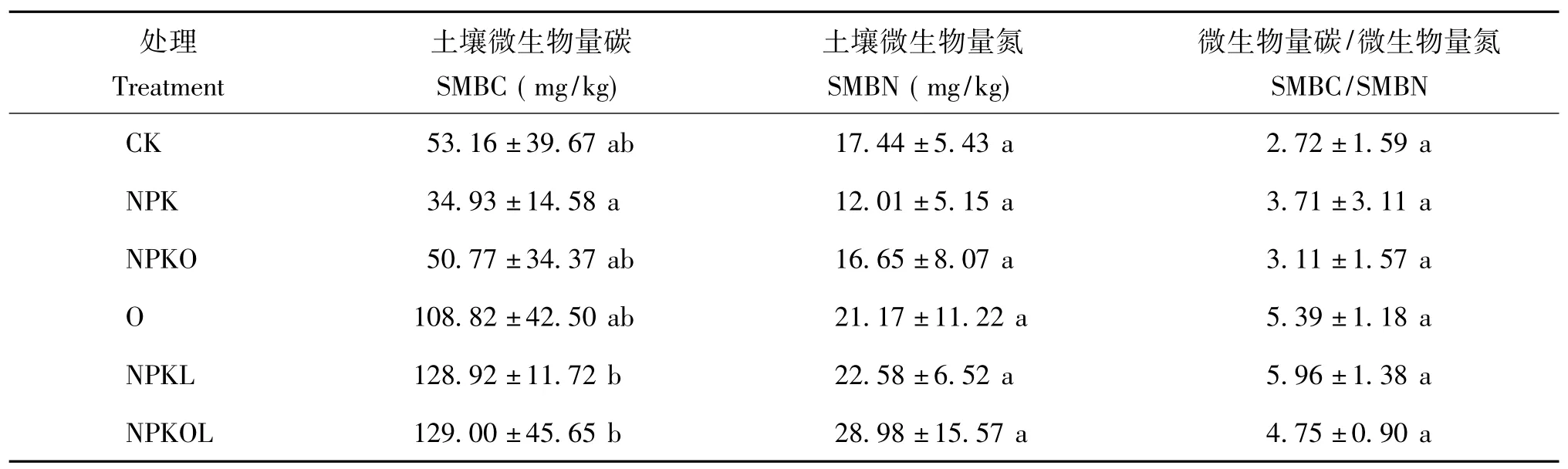
表3 不同施肥处理的土壤微生物量Table 3 Soil microbial biomass under different fertilizations

表4 不同施肥处理的土壤酶活性Table 4 Soil enzyme activity under different fertilizations
2.5 不同施肥处理对土壤微生物PLFAs的影响
不同种类微生物的磷脂脂肪酸(PLFAs)的组成及含量存在差异,所以测定土壤中所有微生物的磷脂脂肪酸种类和含量即可估计土壤中微生物生物量和群落结构[17]。供试土壤共检测到24种特定的PLFAs,不同施肥处理的PLFAs的相对丰度存在差异。放线菌PLFAs和革兰氏阳性菌PLFAs相对丰度的变化趋势为NPKL和NPKOL处理明显高于其他处理(表5),革兰氏阳性菌/革兰氏阴性菌PLFA的变化趋势也是NPKL和NPKOL显著高于其他处理,说明豆科牧草能刺激革兰氏阳性菌和放线菌的生长;真菌和厌氧细菌PLFAs相对丰度的变化趋势一致,均为NPKOL>O>NPKL>NPKO>CK>NPK,多年施化肥降低了真菌PLFAs相对丰度,而NPKOL处理则显著提高;细菌PLFAs相对丰度和细菌/真菌的变化趋势为CK、NPK和NPKO处理高于其他处理;革兰氏阴性PLFAs相对丰度变化趋势为NPK>O>CK>NPKO>NPKL>NPKOL;环丙基脂肪酸/单烯基前体PLFAs的变化趋势为NPK和CK处理高于其他处理。
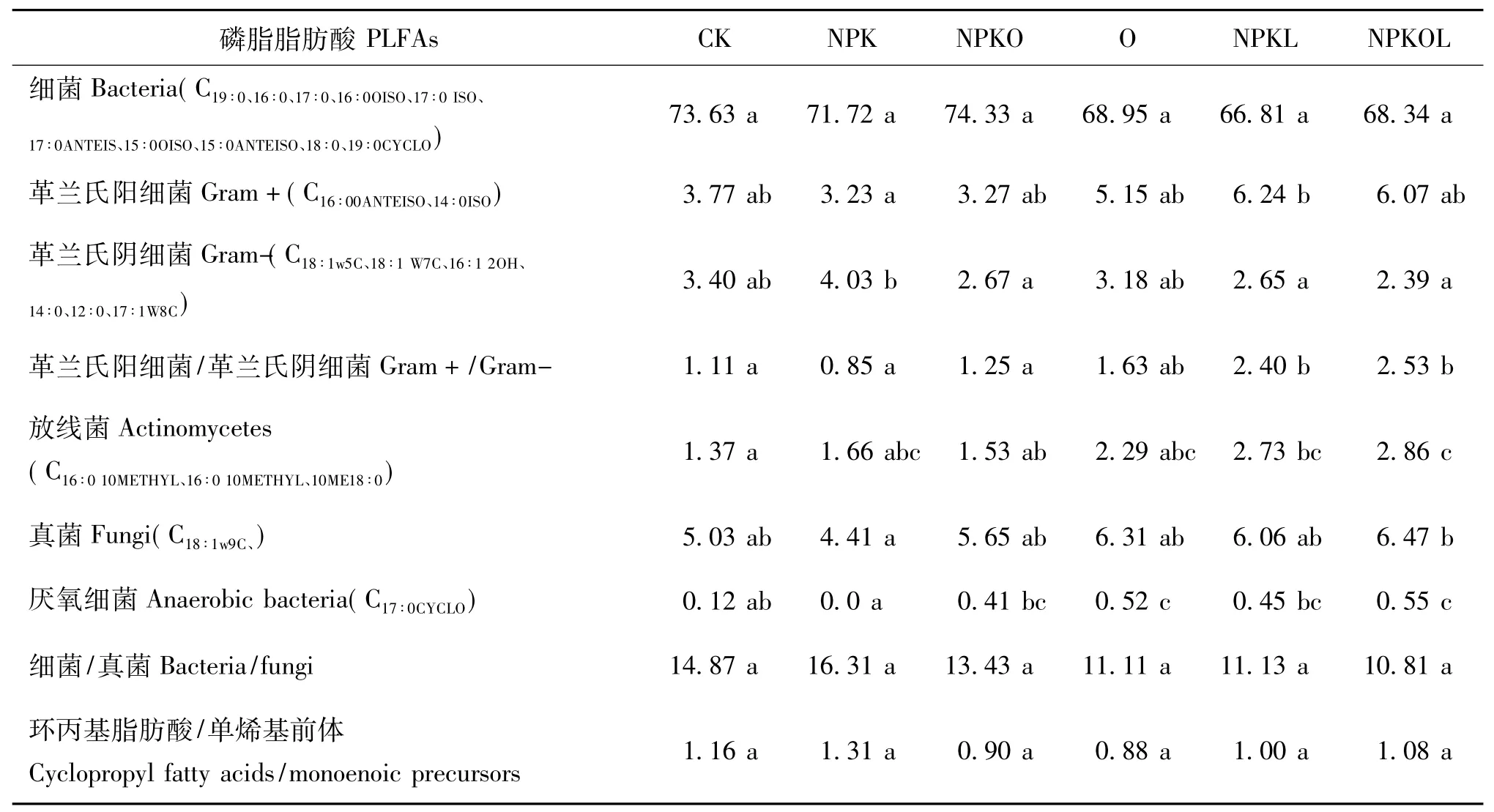
表5 不同施肥处理土壤PLFAs类型和相对丰度Table 5 Types and relative abundance of PLFAs under different fertilizations
主成分分析表明,第一主成分和第二主成分的方差贡献率分别为49.2%和36.9%,两者总和达86.1%,可用于反映系统的变异信息。由图1可知,不同施肥处理土壤微生物群落结构存在差异,NPK和CK处理聚为一类,位于第三象限;NPKO处理单独聚为一类,位于第二象限;其余施肥处理聚为一类,均位于第一象限。同时由图2可知,放线菌、真菌、革兰氏阳性菌、厌氧细菌和革兰氏阳性菌/革兰氏阴性菌PLFAs变异信息处于第一主成分右端,表明单施有机肥(O)和配施豆科牧草(NPKL、NPKOL)均能提高这些菌种的相对丰度。细菌和细菌/真菌PLFAs与PC1呈显著负相关,革兰氏阴性菌与PC2呈显著负相关,说明CK和NPK能增加土壤细菌和革兰氏阴性菌的相对丰度,NPKO处理能明显增加土壤细菌相对丰度。

图1 不同施肥处理土壤微生物PLFAs主成分图Fig.1 Principal component plot for PLFAs of varying microbes under different fertilizations
各指标间的相关分析可知(表6),微生物量与微生物PLFAs相对丰度之间显著相关,微生物量与脲酶、酸性磷酸酶活性也显著相关。可培养微生物与微生物PLFAs相对丰度之间相关性也较为显著。但微生物PLFAs相对丰度分别与微生物量、可培养微生物数量之间的相关性均明显高于多数酶活与微生物量、可培养微生物数量之间的相关性。

图2 土壤微生物PLFAs主成分负载值图Fig.2 PCA showing loading values for PLFAs of varying microbes
3 讨论
3.1 不同施肥处理对土壤化学性质的影响
不同培肥模式均有利于改善茶园红黄壤化学性质,土壤有机质、全氮、水解氮、速效钾含量均有不同程度的增加,特别是含有机肥的3种培肥模式(NPKOL、O和NPKL)的土壤化学改良效果更为显著,增强了土壤的保肥供肥能力。
3.2 不同施肥处理对土壤生物学性状的影响
本研究表明,与不施肥处理相比,单施无机肥茶园土壤可培养细菌、放线菌和真菌的数量均无显著变化,而其他施肥处理细菌、放线菌和真菌等3大类微生物种群的数量均有不同程度的提高,其中NPKOL、O和NPKL处理土壤这3类微生物的数量分别达到最大。这是因为(除NPK处理外)其他施肥处理茶园土壤有机质、全氮、全磷等均有不同程度的提高,这些土壤化学性质的改善有利于增加可培养微生物数量。这与以往的研究结论基本一致[18-19]。同时林新坚等[6]的结果得出,NPKOL 处理对茶叶产量和茶叶营养物质的累积效果最佳。以上说明NPKOL施肥模式在提高茶叶产量、品质和土壤微生物数量上明显优于其他施肥方式。另外,化肥处理的土壤3大类微生物种群的数量与不施肥相比均无明显差异,这与 He等[18]、单武雄等[20]发现单施化肥能提高土壤可培养微生物数量的结论不一致,可能是由于本研究中单施化肥导致土壤pH值、有机质含量降低[6],不利于微生物繁育所致。

表6 各指标间的相关分析(r)Table 6 Correlation analysis between different indicators
土壤微生物量是土壤养分重要的“源”和“汇”,能够反映微生物在土壤中的实际含量和作用潜力[21-22]。本研究中,O、NPKL 和 NPKOL 施肥模式与CK和NPK施肥模式相比均可在一定程度上提高土壤微生物碳(SMBC)和土壤微生物氮(SMBN),其中NPKOL处理下最高。这与张平究等[23]、徐阳春等[24]的研究结果相吻合,表明有机无机肥配施能明显提高土壤微生物量碳、氮,有利于改善土壤质量。与CK相比,NPK处理SMBC和SMBN的值均有下降趋势,这与黄泥土[23]、黄土高原旱地[25]和黑土[26]所得的结果均相反,这可能在一定程度上是由试验用的土壤种类差异引起。
土壤酶能够表征土壤物质和能量的代谢水平和土壤质量。本研究中,NPKOL处理过氧化氢酶活性最高,其他施肥处理与CK处理间无显著差异。这与徐晶等[27]的结果不完全一致。也有文献也指出,过氧化氢酶不能表征肥料对土壤肥力的影响[8]。因此,过氧化氢酶活性作为培肥过程中土壤肥力变化的评价应慎用。各施肥处理均不同程度提高土壤转化酶活性,其中NPKL和NPKOL处理均能显著增加转化酶活性,因为这两个处理均套种具有固氮作用的豆科牧草,能刺激植物根系生长,并促进微生物繁育,进而促使植物根系和微生物分泌更多转化酶。除NPK外,其他施肥处理脲酶活性均比CK处理高,其中NPKOL最高,NPKL次之。这与任泉等[28]的研究结论相一致,主要是因为有机肥能够刺激植物根系生长,同时有机肥本身含有大量的微生物和丰富的酶,这些都有利于土壤脲酶活性的提高。同时套种豆科牧草,其具有固氮作用,能显著提高土壤的供氮水平,从而显著提高脲酶活性。磷酸酶在有机磷矿化中起着重要作用,可表征土壤的供磷能力。本研究中,NPKL和NPKOL处理土壤酸性磷酸酶活性显著高于不施肥处理,而其他施肥处理酶活性均低于不施肥处理。
本试验表明,微生物群落组成相似性在NPK和CK处理中较高;而O、NPKL和NPKOL处理的相似性较高,且微生物种群多样性丰富。于树等[17]的研究也发现,单施化肥处理的土壤微生物群落结构与长期不施肥的较相似,微生物种群多样性单一,没有明显的优势种群,而有机无机配施的土壤微生物群落与不施肥相比差异较大。白震等[29]研究表明,革兰氏阴细菌菌或革兰氏阳细菌菌脂肪酸更易受有机肥影响。这些研究都表明,施用有机肥对土壤微生物群落结构的影响与单施无机肥相比效果更加明显。环丙基脂肪酸/单烯基前体比值在协迫条件如土壤酸化、低氧或高温下升高[30]。研究结果显示,相对其他施肥处理,NPK处理此比率最高。由主成分分析图可知,CK与NPK聚为一类,说明NPK施肥模式不利于茶园土壤微生物的生存和发育。
3.3 土壤微生物指标间的相关分析
相关分析表明,微生物PLFAs相对丰度分别和微生物量、可培养微生物数量之间的相关性明显高于多数酶活性与微生物量、可培养微生物数量之间的相关性,这表明微生物PLFAs相对丰度较土壤酶活性对施肥处理的反映更为敏感。这可能是因为土壤酶是由微生物和植物根系等共同产生,同时有部分土壤微生物处于休眠状态,其代谢活性下降,分泌的酶量变少,导致酶活性与微生物量和可培养微生物数量之间的相关性较低。
4 结论
茶园土壤的各培肥模式不同程度影响土壤可培养微生物数量、微生物量碳氮和土壤酶活,同时改变微生物群落结构。单施化肥不利于微生物的生长和酶活的提高,而“无机肥+有机肥+豆科牧草”的培肥模式下各微生物指标总体趋势均显著优于其他培肥模式,说明该培肥模式有助于改良土壤的生物学性质,应进一步推广和利用。
[1] 徐建明,张甘霖,谢正苗,等.土壤质量指标与评价[M].北京:科学出版社,2010.178-184.Xu J M,Zhang G L,Xie Z M et al.Indices and assessment of soil quality[M].Beijing:Science Press,2010.178-184.
[2] Lugato E,Berti A,Giardini L.Soil organic carbon(SOC)dynamics with and without residue incorporation in relation to different nitrogen fertilisation rates[J].Geoderma,2006,135:315-321.
[3] 徐华勤,肖润林,杨知建,等.不同培肥措施对红壤茶园土壤微生物量碳的影响[J].生态学杂志,2007,26(7):1009-1013.Xu H Q,Xiao R L,Yang Z J et al.Effects of different fertilization on red soil microbial biomass C in tea garden[J].Chin.J.Ecosyst.,2007,26(7):1009-1013.
[4] 徐华勤,肖润林,宋同清,等.稻草覆盖与间作三叶草对丘陵茶园土壤微生物群落功能的影响[J].生物多样性,2008,16(2):166-174.Xu H Q,Xiao R L,Song T Q et al.Effects of mulching and intercropping on the functionaldiversity ofsoilmicrobial communities in tea plantations[J].Biodiv.Sci.,2008,16(2):166-174.
[5] 邓欣,谭济才,尹丽蓉,等.不同茶园土壤微生物数量状况调查初报[J].茶叶通讯,2005,32(2):7-9.Deng X,Tan J C,Yin L R et al.Investigation on the quantitative condition of soil microbes in different tea garden[J].Tea Commun.,2005,32(2):7-9.
[6] 林新坚,黄东风,李卫华,等.施肥模式对茶叶产量、营养累积及土壤肥力的影响[J].中国生态农业学报,2012,20(2):151-157.Lin X J,Huang D F,Li W H et al.Effects of fertilization regimes on yield,nutrition accumulation of tea and soil fertility[J].Chin.J.Eco-Agric.,2012,20(2):151-157.
[7] 中华人民共和国林业部科技司.林业标准汇编[G].北京:中国林业出版社,1991.96-293.The Department of Science and Technology Office Uunderof the Ministry of Forestry in of the People’s Republic of China.Forestry standard compilation of forestry standard[G].Beijing:China Forestry Press,1991.96-293.
[8] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1986.Guan S Y.Soil enzyme and its research methods[M].Beijing:Agriculture Press,1986.
[9] Vance E D,Brookes P C,Jenkinson D S.An extraction method for measuring soil microbial biomass C[J].Soil Biol.Biochem.,1987,19(6):703-707.
[10] Trasar-Cepeda C,Camina F,Leiros M C et al.An improved method to measure catalase activity in soils[J].Soil Biol.Biochem.,1999,31(3):483-485.
[11] Kandeler E,Gerber H.Short-term assay of soil urease activity using colorimetric determination of ammonium[J].Biol.Fert.Soils,1988,6(1):68-72.
[12] Tabatabai M A,Bremner J M.Use of P-nitrophenyl phosphate for assay of soil phosphatase activity[J].Soil Biol.Biochem.,1969,1(4):301-307.
[13] Frostegård A, Tunlid A, Båth E.Phospholipid fatty acid composition,biomass and activity of microbial communities from two soil types experimentally exposed to diferent heavy metals[J].Appl.Environ.Microbiol.,1993,59(11):3605-3617.
[14] Kourtev P S,Ehrenfeld J G,Håggelom M.Exotic plant species alter the microbial community structure and function in the soil[J].Ecology,2002,83(11):3152-3166.
[15] Cavigelli M A,Robertson G P,Klug M J.Fatty acid methyl ester(FAME) profiles as measures of soil microbial community structure[J].Plant Soil,1995,170(1):99-113.
[16] Zelles L,Bai Q Y,Beck T et al.Signature fatty acids in phospholipids and lipopolysaccharides as indicators of microbial biomass and community structure in agricultural soils[J].Soil Biol.Biochem.,1992,24(4):317-323.
[17] 于树,汪景宽,李双异.应用PLFA方法分析长期不同施肥处理对玉米地土壤微生物群落结构的影响[J].生态学报,2008,28(9):4221-4227.Yu S,Wang J K,Li S Y.Effect of long-term fertilization on soil microbial community structure in corn field with the method of PLFA[J].Acta Ecol.Sin.,2008,28(9):4221-4227.
[18] He J Z,Zheng Y,Chen C R et al.Microbial composition and diversity of an upland red soil under long-term fertilization treatmentsas revealed by culture-dependentand cultureindependent approaches[J].J.Soils Sediments,2008,8(5):349-358.
[19] Girvan M S,Bullimore J,Pretty J N et al.Soil type is the primary determinant of the composition of the total and active bacterial communities in arable soils[J]. Appl.Environ.Microbiol.,2003,69(3):1800-1809.
[20] 单武雄,罗文,肖润林,等.连续5年施菜籽饼肥和稻草覆盖对茶园土壤生态系统的影响[J].中国生态农业学报,2010,18(3):472-476.Shan W X,Luo W,Xiao R L et al.Effect of 5-year rapeseed cake fertilization and straw mulching on tea plantation soil ecosystem[J].Chin.J.Eco-Agric.,2010,18(3):472-476.
[21] 高云超,朱文珊,陈文新.土壤微生物生物量周转的估算[J].生态学杂志,1993,12(6):6-10.Gao Y C,Zhu W S,Chen W X.Estimation for biomass and turnover of soil microorganisms[J].Chin.J.Ecol.,1993,12(6):6-10.
[22] 陈国潮.土壤微生物量测定方法现状及其在红壤上的应用[J].土壤通报,1999,30(6):284-287.Chen G C.Situation of soil microbial biomass detection methods and its application in red soils[J].Chin.J.Soil Sci.,1999,30(6):284-287.
[23] 张平究,李恋卿,潘根兴,等.长期不同施肥下太湖地区黄泥土表土微生物碳氮量及基因多样性变化[J].生态学报,2004,24(12):2818-2824.Zhang P J,Li L Q,Pan G X et al.Influence of long-term fertilizer management on topsoil microbial biomass and genetic diversity of a paddy soil from the Tai Lake region,China[J].Acta Ecol.Sin.,2004,24(12):2818-2824.
[24] 徐阳春,沈其荣,冉炜.长期免耕与施用有机肥对土壤微生物生物量碳、氮、磷的影响[J].土壤学报,2002,39(1):89-96.Xu Y C,Shen Q R,Ran W.Effects of zero-tiliage and application of manure on soil microbial biomass C,N and pafter sixteen years of cropping[J].Acta Pedol.Sin.,2002,39(1):89-96.
[25] 来璐,郝明德,王永功.黄土高原旱地长期轮作与施肥土壤微生物量磷的变化[J].植物营养与肥料学报,2004,10(5):546-549.Lai L,Hao M D,Wang Y G.Changes of long-term rotation and fertilization on soil microbial phosphorus under dryland in Loess Plateau[J].Plant Nutr.Fert.Sci.,2005,10(5):546-549.
[26] 李东坡,武志杰,陈利军,等.长期培肥黑土微生物量磷动态变化及影响因素[J].应用生态学报,2004,15(10):1897-1902.Li D P,Wu Z J,Chen L J et al.Dynamics of microbial biomass P and its affecting factors in a long-term fertilized black soil[J].Chin.J.Appl.Ecol.,2004,15(10):1897-1902.
[27] 徐晶,陈婉华,孙瑞莲,周义清.不同施肥处理对湖南红壤中微生物数量及酶活性的影响[J].土壤肥料,2003,(5):8-11.Xu J,Chen W H,Sun R L,Zhou Y Q.Effects of different fertilization systems on amount of soil microorganism and enzyme activity in red soil of Hunan[J].Soils Fert.,2003,(5):8-11.
[28] 任全,单武雄,肖润林,等.不同施肥措施对红壤丘陵茶园土壤酶活性及呼吸强度的影响[J].农业现代化研究,2007,28(4):498-500.Ren Q,Shan W X,Xiao R L et al.Impact of fertilizers on soil enzyme activity and intensity of breathing of tea plantation in redsoil Hilly Region[J].Res.Agric.Modern.,2007,28(4):498-500.
[29] 白震,张明,宋斗妍,等.不同施肥对农田黑土微生物群落的影响[J].生态学报,2008,28(7):3244-3253.Bai Z,Zhang M,Song D Y et al.Effect of different fertilizaiton on microbial community in an arable mollisol[J].Acta Ecol.Sin.,2008,28(7):3244-3253.
[30] Guckert J B,Hood M A,White D C.Phospholipid,esterlinked fatty acid profile changes during nutrient deprivation of Vibrio cholerae:Increases in the trans/cis ratio and proportions of cyclopropyl fatty acids[J].Appl.Environ.Microbiol.,1986,52(4):794-801.
