Ritter反应的研究进展
2013-09-27贾玲晓高占文黄孝近翟昌梅
唐 磊,贾玲晓, 高占文,黄孝近,翟昌梅
(山东鲁抗医药股份有限公司,山东 济宁 272073)
Ritter反应,即腈类和容易形成碳正离子的化合物,诸如烯、醇、羧酸、酯、酮等在强酸存在的条件下发生的一类反应,该反应能生成N- 取代的酰胺或胺类化合物(将N- 取代的酰胺水解即得),是构筑C-N键最为重要的方法之一[1~3]。反应机理如下:

首先形成碳正离子,任何能够形成稳定碳正离子的反应物都可以成为起始原料。
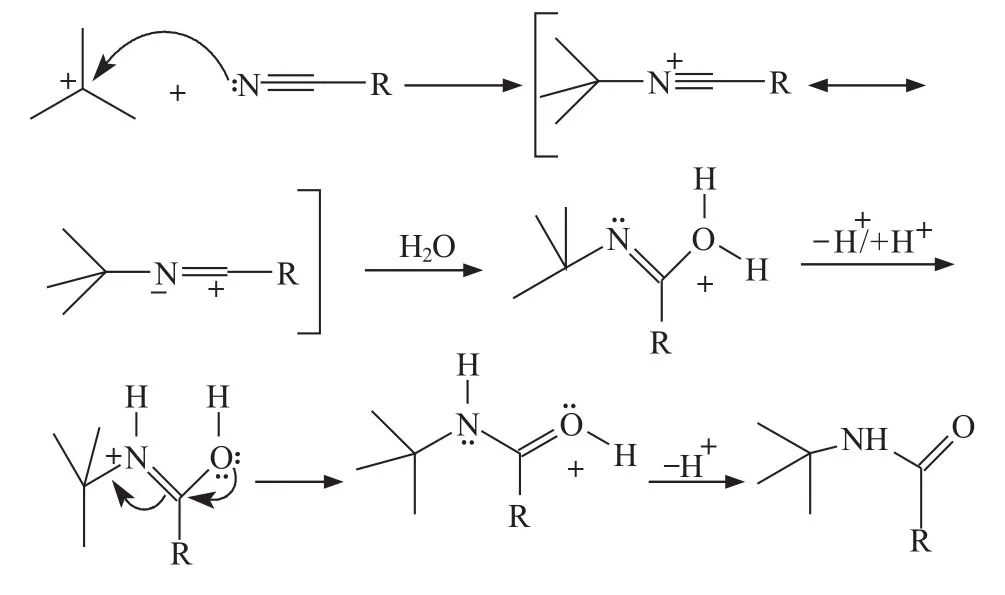
然后碳正离子进攻氰基氮原子,生成的正离子迅速加水,转变为N- 烃基取代酰胺。
Ritter反应的发生需要形成碳正离子中间体,如果它可以通过异构化形成更稳定的碳正离子中间体,则发生分子重排。另外,是否发生分子重排还与反应物的添加顺序有关,如果首先加入醇和酸,然后再加入腈,则会有时间发生重排,生成更稳定的产物;如果首先加入醇和腈,然后加入酸,生成碳正离子后会立刻与腈反应,不会发生重排[4]。
本反应广泛应用于精细有机合成中,包括药品、农药、高分子行业用的功能单体的合成,诸如高分子功能单体N- 异丙基丙烯酰胺的合成[5]。腈与醇之间的Ritter反应通常需要在强酸的催化作用下完成,例如浓硫酸就是催化Ritter反应中常用的一种催化剂,但对于酸性敏感的底物参与的Ritter反应,浓硫酸过强的酸性限制了它的应用。研究人员针对以上问题,对Ritter反应做出了大量的改良和改进工作,目的就是实现温和条件下的Ritter反应。现在从以下几个方面综述近年来该领域的重要研究成果。
1 酸类催化剂的选择
查阅早期的文献可以看出[6],传统Ritter反应的催化剂为浓硫酸。但是对于酸敏感的反应物参加Ritter反应,浓硫酸过强的酸性限制了它的应用。
随后人们通过研究发现,在丙烯腈和苄醇的反应中,除了硫酸具有催化活性外,三氟化硼乙醚(BF3·OEt2)和三氟甲磺酸酐[(CF3SO2)2O]也能起到催化的作用[7]。再如,对于一些反应,采用金属混合物也可以有效地催化反应进行[8],但是这些催化剂存在毒性和后处理复杂等问题。
在随后的研究中发现固体酸催化剂有分离简单和可重复利用等优点,用固体酸代替液体酸作催化剂,已成为开发环境友好新工艺的一个重要研究领域[9]。因此,对于Ritter反应,研发一种环境友好的固体催化剂来代替硫酸是非常必要的,这也成为对Ritter反应进行改进的重要思路之一。
对于很多酸催化反应,Nafion-H[10]是一个广泛应用的商用催化剂。Nafion-H是无孔结构,非共价交联的离聚物,但是内部具有一定规整性,具有离子簇和微胶束结构。它具有高度的化学稳定性和较好的热稳定性,耐强酸、强碱以及氧化剂和还原剂。它是一种高效的非均相催化剂,可用于烷基化、酰基化、异构化、脱水、缩合等多种反应中。对比硫酸,虽然它的选择性稍差,但它的反应条件比较温和,对反应的条件要求不苛刻,且在反应结束后催化活性基本保持不变,可重复使用,尤其在有水产生的反应或以水作介质的反应中,Nafion-H显示了高度的稳定性和活性。
在许多Ritter反应中用到的固体酸催化剂有HZSM-5和杂多酸[11~15]。Xin chen等报道了用H-ZSM-5催化丙烯腈与异丙醇反应生成N- 异丙基丙烯酰胺。在H-ZSM-5中适当添加金属铝可以提高催化活性。结果表明固体酸H-ZSM-5[16]和Cs2.5H0.5PW12O40对于Ritter反应具有活性,前者对于分子量较大的反应物有效,而后者对于从异丙醇合成N- 异丙基丙烯酰胺有特殊的活性。
杂多酸具有强酸位并且有很高的催化活性,广泛用于烯烃的各种转化反应,如烷基化、酯化、水合及醚化等[17~19]。在杂多酸化合物中,磷钨酸作为固体酸催化剂,虽然具有较强的酸性,但是由于其在极性溶剂中具有较大的溶解度,在使用过程中极易流失。磷钨酸铯的酸式盐(Cs2.5H0.5PW12O40)不但具有与磷钨酸相近的较强的酸性,同时还具有不溶于水和甲醇等极性溶剂的特点,是理想的固体酸催化材料[20~21]。另外,Cs2.5H0.5PW12O40的介孔结构也是使它成为最常用的固体酸的原因之一。
通过比较各种不同的酸性试剂在Ritter反应中的催化效率,发现P2O5/SiO2是一个有效的催化体系[22]。在100℃,乙腈与苄基醇反应如下:

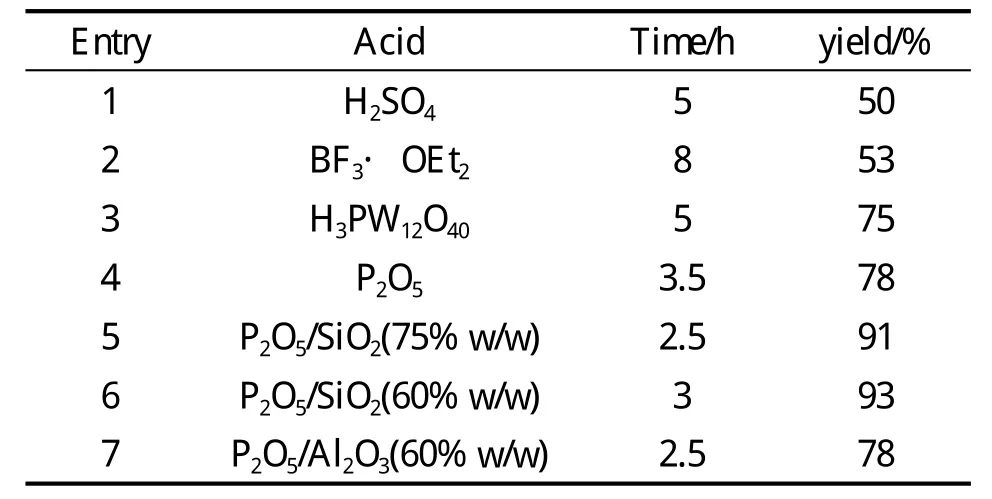
表1 在不同的酸催化下苄醇与乙腈的反应数据
结果表明P2O5/SiO2是一个有效的催化体系,环境友好,具有操作简单,后处理方便,产率较高等优点,比没有固载的P2O5更稳定,更高的活性和低吸湿性。P2O5/SiO2已经用在了酰化[23~24],Fries重排[25],Schmidt重排[26],Beckmann重排[27]和醛或醇的保护和脱保护等方面[28]。
在有机合成中,应用磷钼酸(PMA)作为催化剂的反应越来越多,例如用PMA/SiO2催化醇与腈反应生成酰胺类化合物[29],在没有溶剂的条件下,在反应中加入二氧化硅固载的磷钼酸,可以促进醇与腈反应生成酰胺,反应如下:
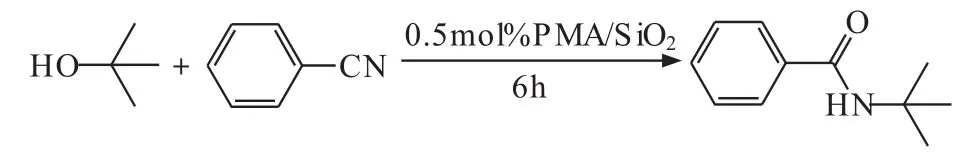

表2 在不同的固体酸催化下叔丁醇与乙腈的反应数据
磷钼酸属于杂多酸,它表现出了高的活性和选择性,在均相和非均相的反应体系中,杂多酸表现出了两种截然不同的催化作用。在有机反应中,杂多酸的催化活性比硫酸要高100~1000倍[30],这就能使它在更低的浓度和反应温度下进行催化。利用PMA/SiO2进行Ritter反应能够提高反应转化率,还有后处理方便,环境友好等优点。
2 Ce(Ⅳ)化合物诱导
Vijay Nair等人[31]用硝酸铈铵(CAN)诱导苯乙烯与腈反应生成1- 氨基 - 4苯基四氢化萘,为改进Ritter反应又提供了一条新的方法,反应如下:

另外,还可以通过硫酸铯[Ce(SO4)2]诱导Ritter反应催化合成乙酰氨基苯酚类化合物[32],人们已经掌握了Ce(SO4)2诱导合成乙酰氨基苯酚类化合物的反应机理,为一锅法合成乙酰氨基苯酚类化合物提供了一种新颖的方法,将来的研究重点是将这种方法广泛应用于其他类型的反应。选用Ce(Ⅳ)化合物的诱导为改进Ritter反应提供了新的思路。
3 微波辅助
将微波辅助应用于催化Ritter反应可以缩短反应时间,提高反应效率。Nafion-H是一个有效的催化剂,可以重复使用和提高反应产率,但是较长的反应时间限制了它的应用。随着微波化学的发展,人们的主要目标是找到环境友好、经济适用的方法将腈转化为N- 取代的酰胺。例如,在微波辅助下,在Nafion-NR50催化下进行Ritter反应[33],如下所示:
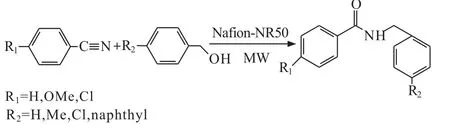
由于有微波的辅助,可以大大缩短反应时间,提高反应产率,在无溶剂的条件下,以Nafion-NR50作为催化剂,这种方法可以实现环境友好并且易于处理。
另外,一些其他的方法也可以用于Ritter反应,例如,采用氰化三甲基硅烷为反应物代替腈类化合物与醇反应转化为相应的酰胺[34]。通过这种方法,可以合成很多用典型Ritter反应无法合成的酰胺类产物,但是用硫酸作为催化剂限制了这种方法的适用范围。
还可以用酯作反应底物与腈反应,将脂肪族腈或芳香族腈转化为相应的酰胺[35~36]。研究表明,腈转化为对应的胺的速率很大程度上取决于叔丁基碳正离子、溶剂、酸、酸和溶剂的混合比等。例如,以叔丁基乙酸酯为碳源,硫酸为催化剂,将腈苯完全转化为酰胺需要12h以上。当加入催化剂量的水时,反应速率明显降低;当增加硫酸浓度时,反应速率明显提高,反应能在3h以内完成。这种方法同样适用于脂肪族腈。
目前,还有一些其他的方法用于改进Ritter反应。例如在传统的Ritter反应中,仲醇、叔醇与腈能反应生成胺类化合物,而伯醇无法参与反应,通过优化反应过程,可以在反应中加入三氟甲磺酸酐,能使伯醇与腈发生Ritter反应[37]。还可以利用蒙脱石催化伯醇或仲醇发生氨化反应[38]。另外,在过渡金属存在的情况下也能催化Ritter反应进行[39~40]。以上这些改进弥补了传统Ritter反应的不足。
综上所述,Ritter反应是一类非常有应用价值的有机合成反应,可以广泛应用于精细有机合成中,通过对一般的Ritter反应进行改良,研究开发条件温和、反应高效、实现简便的清洁化Ritter反应并用于精细化学品的合成仍是今后研究的热点问题。随着环境友好型固体杂多酸的催化Ritter反应的发展,以及微波合成手段的广泛应用,这些方法的提出,为实现清洁化、环境友好的Ritter反应提供了新的思路。
[1] John J.Ritter, P.Paul Minieri.A New Reaction of Nitriles.I.Amides from Alkenes and Mononitriles[J].J.Am.Chem.Soc., 1948(70):4045.
[2] Frederic R.Benson , John J.Ritter.A New Reaction of Nitriles.Ⅲ .Amides from Dinitriles[J].J.Am.Chem.Soc.,1949(71): 4128.
[3] Roberto Sanz, Alberto Martínez, Veronica Guilarte, et al.The Ritter Reaction under Truly Catalytic Bronsted Acid Condition[J].J.Org.Chem., 2007, 4642.
[4] Susan Edwards, Fritz Hans Marquardt.Molecular Rearrangements in the Course of Ritter Reactions[J].J.Org.Chem.,1974(39):1963.
[5] Okuhara Toshio, Urabe Kenji.Production of N-Isopropylacrylamide[P].JP 2000164864, 2000.
[6] John A.Sanguigni, Roberr Levine.Amides from Nitriles and Alcohols by the Ritter Reaction[J].New Compounds,1964(7): 573-574.
[7] M.Kacan, A.McKillop.Simple, High Yield Preparation of N-Benzylacetamides by Lewis Acid-Catalyseed Reaction of Benzyl Chlorides or Benzyl Methyl Ethers with Acetonitrile[J].Synth Commun., 1993(23):2185.
[8] T.Maki, K.Ishihara, H Yamamoto.For the use of a borate complex as catalyst[J].Org.Lett., 2006(8):1431.
[9] Min Enze.Environment Friendly Technology for Producing Basic Organic Chemicals[J].Chemical Industry Times,1997(11):4.
[10] Olah.G.A, Yamato.T, Iyer.P.S, et al.Nafion-HR-catalyzed baeyer-villiger oxidation and ritter reaction[J].Mater.Chem.Phys., 1987(17):21.
[11] A Chakrabarti, M.M.Sharma.Cationic ion exchange resins as catalyst[J].Reactive Polymers, 1993(20):1.
[12] Yijiao Jiang, Hunger.M, Wei Wang.On the Reactivity of Surface Methoxy Species in Acidic Zeolites[J].J.Am.Chem.Soc., 2006(128):11679.
[13] T.Stamm, H.W.Kouwenhoven, D.Seebatch, et al.Zeolite-Catalyzed Isomerization of Aromatic Amines to Methyl-Aza-Aromatics[J].Journal of Catalysis, 1995(155):268.
[14] Toshio Okuhara, Xin Chen, Hideho Matsuda.Catalytic synthesis of N-alkylacrylamide from acrylonitrile and alcohol with solid acids[J].Applied Catalysis, 2000(200):109.
[15] Xin Chen, Toshio Okuhara.A Ritter-Type Reaction over H-ZSM-5:Synthesis of N-Isopropylacrylamide from Acrylonitrile and Isopropyl Alcohol[J].Journal of Catalysis,2002(207):194.
[16] Edward J Rosinski.Fluidized Catalytic Cracking Process[P].US 4552648, 1985.
[17] John F.Knifton, John C.Edwards.Methyl tert-butyl ether synthesis from tert-butanol via inorganic solid acid catalysis[J].Applied Catalysis, 1999(183):1.
[18] Yadav J S, Subba Reddy B V, Aravind S, et al.Threecomponent,one-pot diastereoselective synthesis of 4-amidotetrahydropyrans via the Prins-Ritter reaction sequence[J].Tetrahedron, 2008(64):3025.
[19] Izumi Y, Hisano K, Hida T.Acid catalysis of silicaincluded heteropolyacid in polar reaction media[J].Applied Catalysis, 1999(181):277.
[20] Wen Langyou, Min Enze.Research Development of Solid Heteropolyacid Catalyst[J].Petrochemical Technology,2000(29):49.
[21] Habib Firouzabadi, Nasser Iranpoor.Dodecatungstophosphoric acid (H3PW12O40) as a highly efficient catalyst for the amidation of alcohols and protected alcohols with nitriles in water: A modified Ritter reaction [J].Catalysis Communication,2008(9):529.
[22] Fatemeth Tamaddon, Mehdi Khoobi.(P2O5/SiO2):a useful heterogeneous alternative for the Ritter reaction[J].Tetrahedron Letters, 2007(48):3643.
[23] Hajipour A.R, Zarei A, Khazdooz L, et al.Direct Sulfonylation of Aromatic Rings with Aryl or Alkyl Sulfonic Acid Using Supported P2O5/Al2O3[J].Phosphorus Sulfur Silicon,2005(180):2029.
[24] Eshghi H, Rafei M.P2O5/SiO2AS An Efficient Reagent for Esterification of Phenols in dry Media[J].Synth.Commun.,2001(31): 771.
[25] B.F Mirjalili, M.A Zolfigol.An Efficient Conversion of Aldehydes to their Corresponding Acylals with P2O5/SiO2Under Mild Condition[J].Phosphorus Sulfur Silicon,2004(179):19.
[26] Eshghi H, Hassankhani A.P2O5/SiO2-Catalyzed One-Pot Synthesis of Amides from Ketones via Schmidt Reaction under Microwave Irradiation in Dry Media[J].Synth.Commun., 2006, 2211.
[27] Eshghi H, Gordi Z.An Easy Method for the Generation of Amides from Ketones by a Beckmann Type Rearrangement Mediated by Microwave[J].2003(33): 2971.
[28] Eshghi H, Shafieyoon P.Phosphorus Pentoxide as an efficient catalysis for the tetrahydropyranylation of alcohols under solvent-free conditions[J].Phosphorus Sulfur Silicon,2004(179): 2149.
[29] J.S.Yadav, B.V.Subba Reddy, T.Pandurangam, et al.PMA/SiO2catalyzed amidation of alcohols with nitriles: A simple,cost-effective and recyclable catalytic system for Ritter reaction[J].Catalysis Communication, 2008(9):1297.
[30] Okuhara T, Mizuno N, Misono M.Catalysis by heteropoly compounds-recent developments[J].Applied Catalysis,2001(1):63.
[31] Vijay Nair, Roshini Rajan, Nigam P.Rath.A CAN-Induced Cyclodimerization-Ritter Trapping Strategy for the One-Pot Synthesis of 1-Amino-4-aryltetralins from Styrenes[J].ORGANIC LETTERS, 2002(4):1575.
[32] Nagarajan Panneer Selvam, Paramasivan T.Perumal.A new synthesis of acetamido phenols promoted by Ce(SO4)2[J].Tetrahedron Letters,2006(47):7481.
[33] Vivek Polshettiwar, Rajender S.V.Nafion-catalyzed microwaveassisted Ritter reaction: an atom-economic solvent-free synthesis of amides[J].Tetrahedron Letters, 2008(49):2661.
[34] H.G.Chen, O.P.Goel, S.Kesten, et al.A Novel Modification of the Ritter Reaction Using Trimethylsilyl Cyanide[J].Tetrahedron Letters, 1996(37):8129.
[35] K.Laxma Reddy.An efficient method for the conversion of aromatic and aliphatic nitriles to the corresponding N-tertbutyl amides: amodified Ritter reaction[J].Tetrahedron Letters, 2003(44):1453.
[36] Mikhail Y.Lebedev, Mark B.Erman.Lower primary alkanols and their esters in a Ritter-type reaction with nitriles.An efficient method for obtaining N-primary-alkyl amides[J].Tetrahedron Letters, 2002(43):1397.
[37] Martinez A.G, Alvarez R, Vilar E, et al.An improved modification of ritter reaction[J].Tetrahedron Letters,1989(30):581.
[38] M.M Lakouraj, B.Movassagh, J.Fasihi.Fe3+-Montmorillonite K10: an Efficient Catalyst for Selective Amidation of Alcohols with Nitriles Under Non-Aqueous Condition[J].Synth.Commun., 2000(30): 821.
[39] Mukhopsdhyay M, Reddy M, M;Maikap G.Cobalt(Ⅱ)-Catalyzed Conversion of Allylic Alcohols/Acetates to Allylic Amides in the Presence of Nitriles[J].J.Org.Chem.,1995(60):2670.
[40] E.Callens, A.J.Burton, A.G.M.Barrett, Synthesis of amides using the Ritter reaction with bismuth triflate catalysis[J].Tetrahedron Lett., 2006(47): 8699.
