从废旧碳性锌锰电池正极材料中预分离锌的试验研究
2013-09-27彭蜀君孙维义丁桑岚苏仕军
彭蜀君,孙 铜,孙维义,丁桑岚,于 建,苏仕军
(1.四川大学 建筑与环境学院,四川 成都 610065;2.成都科技大学 环保科技研究所,四川 成都 610065)
废旧锌锰电池中含有大量Zn和Mn,具有回收利用价值。废旧电池资源化利用途径有火法和湿法。火法流程短,能耗低,但一次性设备投资和操作运转费用高;湿法所得产品纯度较高,但流程较长,能耗大,生产成本较高[1-7]。湿法处理过程中可以得到 MnSO4、MnCO3、MnO2、MnCl2、Zn、锰锌铁氧体等副产物[8-10]。总的来说,从废旧锌锰电池正极材料中浸出Zn和Mn的研究比较少。因此研究了用硫酸从废旧锌锰电池正极材料中浸出Zn和Mn。
1 试验部分
1.1 材料、试剂与仪器
废旧锌锰碳性电池,2号,成都市固废治理站;硫酸,分析纯,98%,成都市科龙化工试剂厂;盐酸,分析纯,36%~38%,成都市科龙化工试剂厂;硝酸,分析纯,65%~68%,成都市科龙化工试剂厂;双氧水,分析纯,30%,成都市科龙化工试剂厂;电热鼓风干燥箱,101-2型,北京中兴伟业仪器有限公司;电子恒温水浴锅,DZKW-4型,北京中兴伟业仪器有限公司;电子天平,AL204型,梅特勒-托利多仪器(上海)有限公司;全谱直读型ICP-AES,IRIS Adv型,美国热电器公司;X射线衍射仪,X'Pert Pro MPD型,荷兰飞利浦公司;X射线荧光光谱仪,XRF-1800型,日本岛津制作所。
锌锰碳性电池正极材料(松下2号电池)的XRD测定结果如图1所示。

图1 锌锰碳性电池正极材料的XRD分析图
XRF分析结果表明正极材料中包含C、O、Mn、Zn、Cl、Si、Fe、Al、K、Ca、Pb、Mg、Ba、S、Cr、P、Sr、Br、Cu、Ni、Rb元素。其中C质量分数高达37%,C质量分数高严重干扰其他元素的测定。X射线衍射结果表明,正极材料中存在C、SiO2、Zn5(OH)8Cl2·H2O 3种物质。Mn在高C质量分数的干扰下没有被测出。通过文献[10]方法得出10g正极材料中,Zn的质量为2.838 55g,Mn的质量为3.202 1g。
1.2 浸出原理
正极材料中的Zn和 Mn氧化物,如ZnO、MnO、MnO2、Mn2O3、Mn3O4等与H2SO4以及 H2O2反应,形成离子转入液相。随着电池的放电程度不同,正极材料中的这些氧化物的种类及含量都不同。相关反应式如下[11]:
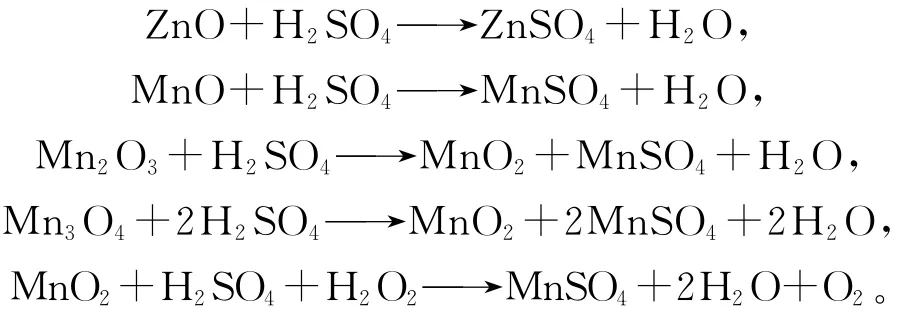
1.3 分析方法
取足量电池正极材料粉末,在烘箱中烘干后,取10g于烧杯中,加入一定浓度的硫酸溶液,搅拌;根据需要再加入一定体积分数的H2O2溶液;在水浴锅中加热至一定温度后保持恒温,手动搅拌一定时间后停止加热和搅拌,冷却后过滤。浸出液中的Zn、Mn采用ICP法测定。
2 试验结果与讨论
2.1 单因素试验
2.1.1 浸出时间对Zn、Mn浸出率的影响
图2为不同浸出时间条件下的Zn、Mn浸出率的变化。其他浸出条件为:硫酸浓度2mol/L,常温,固液质量体积比1∶10,无H2O2添加。从图2看出,Zn、Mn浸出率随浸出时间的延长并无明显变化,浸出0.5h后分别达到约50%和15%,且趋于稳定。
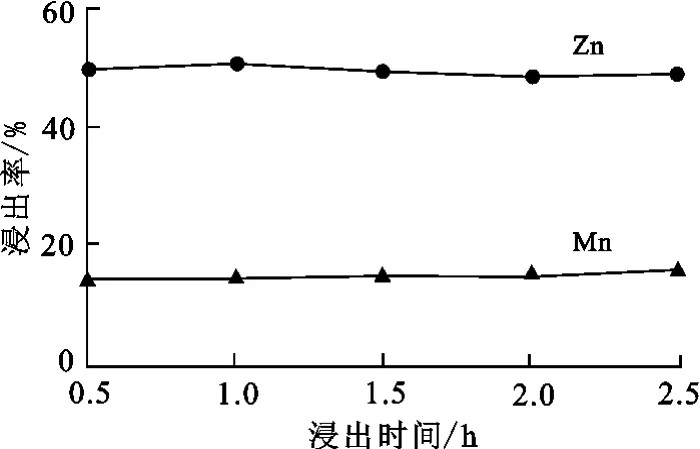
图2 浸出时间对Zn、Mn浸出率的影响
2.1.2 硫酸浓度对Zn、Mn浸出率的影响
图3为不同硫酸浓度下Zn、Mn浸出率的变化。其他条件为:浸出时间1h,常温,固液体积质量比1∶10,无H2O2添加。由图3看出,在硫酸浓度为0.1~4.0mol/L范围内,Zn浸出率始终保持在40%~50%之间,变化不大;Mn浸出率则随硫酸浓度升高而有所升高,在硫酸浓度增大到3mol/L后,Mn浸出率趋于稳定,约为20%。

图3 硫酸浓度对Zn、Mn浸出率的影响
2.1.3 固液质量体积比对Zn、Mn浸出率的影响
图4为不同固液质量体积比对Zn、Mn的浸出率的影响。其他浸出条件为:浸出时间1h,常温,硫酸浓度0.4mol/L,无 H2O2添加。可以看出:固液质量体积比小于1∶50时,Zn、Mn浸出率变化不大;固液质量体积比大于1∶50后,Zn、Mn浸出率均逐渐降低。这是因为,固液质量体积比增大,正极材料和硫酸溶液之间的相互接触面积减小,不利于正极材料中可溶性物质的溶解。固液质量体积比为1∶50时,Zn浸出率在80%以上。
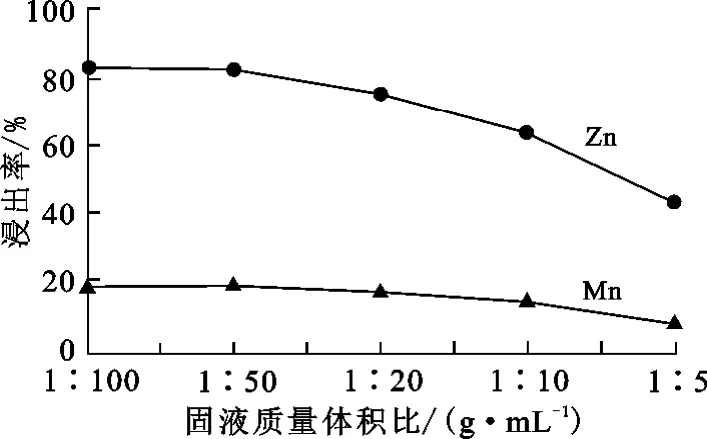
图4 固液质量体积比对Zn、Mn浸出率的影响
2.1.4 H2O2体积分数对Zn、Mn浸出率的影响
图5为不同H2O2体积分数条件下Zn、Mn浸出率的变化。其他浸出条件为:浸出时间1h,常温,硫酸浓度0.4mol/L,固液质量体积比1∶50。由图5看出,H2O2体积分数对Zn浸出率影响不大,而Mn浸出率随H2O2体积分数增大而逐渐增大,并在H2O2体积分数为1.0%以后趋于稳定。加入H2O2后,Mn浸出率从20%增大到80%以上,说明正极材料中含有较大量的MnO2。综合考虑,为充分分离锌和锰,选取较低的H2O2体积分数,以保证大部分MnO2留在渣中,便于后续回收。
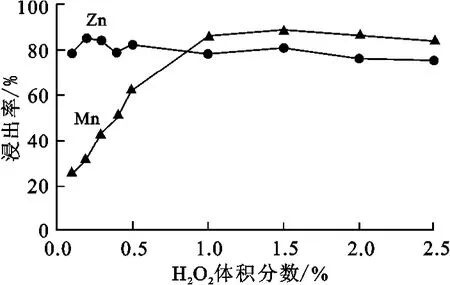
图5 H2O2体积分数对Zn、Mn浸出率的影响
2.1.5 温度对Zn、Mn浸出率的影响
图6为不同温度下的Zn、Mn浸出率的变化情况。除温度外,其他浸出条件为:浸出时间1 h,硫酸浓度0.4mol/L,固液质量体积比1∶50。由图6看出:随温度升高,Zn和Mn浸出率均稍有升高,但变化不大;Zn浸出率在80℃时为98%。综合考虑,确定最佳反应温度为80℃。

图6 温度对Zn、Mn浸出率的影响
2.2 正交试验
选取温度(A)、硫酸浓度(B)、固液质量体积比(C)、H2O2体积分数(D)进行4因素3水平正交试验,确定从电池正极材料中浸出Zn的最佳条件,同时考察Mn的浸出情况。正交试验条件及结果见表1。

表1 正交试验条件及结果
正交试验结果表明:对于Zn的浸出,最佳条件为A3B3C1D2;对于 Mn的浸出,最佳条件为A3B3C3D3。综合考虑,确定试验最佳条件组合为:硫酸浓度0.4mol/L,固液质量体积比1∶10,H2O2质量分数0.3%,温度80℃。此条件下,锌浸出率为99.90%,锰浸出率为32.60%。2.3正极材料组成分析
对松下2号碳性电池的正极材料进行水浸,Zn最大浸出率为12.68%,Mn最大浸出率为0.75%。对比酸浸结果并结合反应原理,可以确定碳性电池正极材料中含有少量易溶于水的ZnCl2、大量不溶于水但溶于硫酸的ZnO或其他Zn化合物,如Zn5(OH)8Cl2·H2O等;而对于Mn来说,MnCl2的量非常少。另外,可能存在放电中间产物MnOOH以及Mn的氧化物,如Mn3O4、Mn2O3、MnO2等,而氧化物中最多的应该是不与硫酸反应的MnO2。
3 结论
用硫酸浸出碳性锌锰电池正极材料分离锌和锰是可行的。单因素试验确定的最佳条件为:浸出时间1h,硫酸浓度0.4mol/L,固液质量体积比1∶50,H2O2体积分数0.2%,温度80℃。在此条件下,Zn浸出率为98%,Mn浸出率为39%。正交试验确定最佳条件为硫酸浓度0.4mol/L,固液质量体积比1∶10,H2O2体积分数0.3%,温度80℃。此条件下,Zn浸出率达99.92%,Mn浸出率为33%。由试验结果可以看出,用硫酸从松下2号碳性电池正极材料中浸出Zn效果非常好,Zn浸出率可达99.9%,几乎完全浸出,滤渣则基本是不溶于酸的C、SiO2、MnO2等,后续处理可与烟气脱硫相结合,使MnO2与SO2反应,回收MnSO4和C。
[1]田喜强,赵东江,白晓波,等.利用废旧锌锰电池回收锰的研究[J].应用化工,2006,35(9):730-735.
[2]赵东江,李秋生,白晓波,等.酸浸法由废旧锌锰电池制取碳酸锰的研究[J].环境科学与技术,2009,32(5):158-160.
[3]杨培霞,张相育,赵倩,等.废旧电池回收工艺的研究[J].化学工程师,2002,89(2):32-33.
[4]李月红,王晓,赵联朝,等.由废旧锌锰电池回收氯化锰和锌的一种工艺[J].河南科技大学学报:自然科学版,2004,25(5):93-95.
[5]田磊,常卿卿,李红超,等.从镍氢电池正极酸浸液中萃取分离镍钴[J].湿法冶金,2011,30(4):320-322.
[6]Giuseppe P,Adriano B,Antonio M.Pyrometallurgical Process for Hg,Cd and Pb Removal from Spent Alkaline-MnO2Batery Cells[J].J Environ Chem Technol,2000(1):16-22.
[7]Abbas H,Askar M A,Abd-Eiaziz EM.Recycling of Zinc-carbon Spent Batteries[J].J Egypt Chem,1999,42(4):361-373.
[8]孔祥平.废旧锌锰干电池中锰的回收条件研究[J].应用化工,2009,38(7):990-993.
[9]席国喜,路迈西,邱宁静.废旧锌锰电池的残渣成分分析,再生资源研究[J].2006(1):38-40.
[10]李运清,席国喜,徐鹏.废旧碱性锌锰电池粉末在盐酸中的溶解研究[J].2005,22(6):125-127.
[11]Ferella F,Michelis I D,Pagnanelli F,et al.Recovery of Zinc and Manganese from Spent Batteries by Different Leaching Systems[J].Acta Mctallurgica Slovaca,2006(12):95-104.
